黄柄曲霉ASD对辣椒疫病根际真菌菌群结构及土壤功能的影响
王 辉,刘 丽,黄宇飞,邹春蕾,赵 颖,王 琦,刘长远*
(1.辽宁省农业科学院植物保护研究所,沈阳 110161;2.沈阳农业大学植物保护学院,沈阳 100866;3.辽宁省农业科学院蔬菜研究所,沈阳 110161;4.辽宁省农业科学院植物营养与环境资源研究所,沈阳 100161;5.中国农业大学植物保护学院,北京 100193)
辣椒疫霉菌Phytophthora capsici Leonian主要是以有性的卵孢子在土壤中越冬,翌年温湿度适宜时可快速生长繁殖,引起辣椒大面积死亡,破坏作物根际微生态环境,造成土壤连作障碍[1,2]。目前,生产上辣椒疫病的防治仍以化学农药为主[3],导致了病原菌抗药性增强与遗传分化[4,5],使防治难度加大,危害环境与人类健康。因此,生产上急需安全有效的替代技术。生防微生物对环境、动植物友好,可以通过抑制、重寄生或竞争等作用改变土壤原有的微生物群落组成与结构,从而达到防治土传病害、提高植物抗逆性、修复病土的目的[6-8],成为植物病害绿色防控的重要手段。研究发现,丛枝菌根菌 AMF(Arbuscular mycorrhizal fungi)、木霉菌Trichoderma spp.、芽胞杆菌Bacillus spp.、假单胞菌Pseudomonas spp.与链霉菌Streptomyces spp.等对辣椒疫病均具有较好的防治效果[9,10]。曲霉属微生物分泌产生的次生代谢产物对植物病原菌具有明显抑制作用[11,12],其中黄柄曲霉Aspergillus flavipes已被证实可产生对辣椒疫霉菌具有拮抗作用的活性成分,且具有稳定的遗传特性及环境适应性[13,14],应用前景广阔。
真菌作为植物根际土壤微生物的重要组成部分,构成了大部分微生物生物量,其物种的组成与丰度变化直接影响土壤养分的转化[15]、土传病害的发生[16]与植物的健康[17]。因此,了解土壤真菌的多样性和群落结构特点,分析与土壤环境功能因子的相关性,对有效改良土壤微环境,维持生态系统物种的多样性、保持生态平衡具有重要意义。黄柄曲霉 ASD来源于辽宁设施辣椒连作土壤,其次生代谢产物中含有辣椒疫病活性抑菌物质已经被证实[13],本文拟探讨 ASD菌株是否同时具有调节土壤微生态环境的功能,结果可为ASD菌株应用于农业生产实践提供理论依据。
1 材料与方法
1.1 土壤采集与采集地情况
试验用土采集于鞍山市温香镇东高村,该地区连续种植辣椒达10 a以上,是辽宁省辣椒种植主产区,种植品种为牛角椒。东高村位于辽宁南部,北纬 41°04′93",东经 122°60′07",年平均气温 10.4 ℃,年降水量721.3 mm,日照时数为1551.25 h。2018年7月于东高村选取3栋未发病的温室,利用5点取样法[18],每点取3株成株的根际土壤,用抖落法获得根际土壤[19]。
1.2 试验材料
1.2.1 试验菌株与菌液的制备 黄柄曲霉Aspergillus flavipes ASD与辣椒疫病菌Phytophthora capsica BZ均由本研究室分离、鉴定并保存。菌株BZ为辽宁省优势3号生理小种、A1交配型,致病力中等。
ASD菌液的制备:将生长于PDA平板[20]的ASD菌株接种于装有100 mL PDA培养液的250 mL三角瓶中,25 ℃ 140 r/min培养7 d后,将发酵液5000 r/min离心1 min,沉淀大块的菌丝球,将上清液配制成浓度为1×107孢子/mL的菌液,4 ℃保存备用。
BZ孢子囊悬浮液的制备:将BZ菌株接种于PDA培养基25 ℃培养5 d,制成菌碟后接种于市场购买的辣椒果实上(接种前用75%乙醇消毒3次),25 ℃培养7 d,待果实长满白色霉状物,用无菌水洗下孢子囊,配制成浓度为1×105个/mL的孢子囊悬浮液,现配现用。
1.2.2 辣椒品种 选用辽宁主栽品种牛角椒37-74为试材,由辽宁省农业科学院蔬菜所辣椒课题组提供。
1.3 试验设计与土壤样本采集
试验于辽宁省农科院试验基地进行,将采集到的土壤充分混匀后分装到直径20 cm、深30 cm花盆中,每盆播种2粒种子,待长至8片真叶期时采用灌根法接种[7]。生防菌ASD处理:在距辣椒植株根茎约2 cm处注入ASD菌液10 mL,翌日在距辣椒根茎5 cm处注入辣椒疫病BZ孢子囊悬浮液10 mL,即为经ASD处理的罹病土壤;辣椒疫霉菌BZ处理:于辣椒根茎5 cm处注入BZ孢子囊悬浮液10 mL,即为罹病土壤;清水对照处理(CK):于辣椒根茎5 cm处注入清水10 mL。正常管理,每处理3次重复,每次重复20株苗。
于接入疫病菌孢子囊悬浮液第20 d连根拔起全部辣椒苗,抖落法获得辣椒根际土壤[19],分别将各处理土壤充分混匀后过筛2 mm,以去除根系和杂质:5.0 g鲜土液氮速冻后−80 ℃保存用于土壤真菌菌群结构分析;150.0 g鲜土储存于−20 ℃用于测定土壤酶活,并在7 d内完成;风干后土样200.0 g用于测定土壤理化因子。
1.4 土壤营养测定
土壤有机质(SOM)测定采用重铬酸钾容量法[21]、铵态氮(NH4+-N)采用联合浸提-紫外光度法[22]、硝态氮(NO3--N)采用氯化钾溶液提取-紫外分光光度法[23]、有效磷(AP)采用碳酸氢钠浸提-紫外光度法[24]、有效钾(AK)采用乙酸铵浸提-原子吸收分光光度法[25]。
1.5 土壤酶活性测定
蛋白酶(PRO)采用 Folin比色法[26,27],酚氧化酶(PHO)采用二羟基苯丙氨酸比色法测定[28],酸性磷酸单酯酶(APA)采用对硝基苯磷酸钠比色法测定[29],β-葡萄糖苷酶(BG)采用对-硝基苯基β-D-葡萄糖苷比色法[30],N-乙酰基-β-D-氨基葡糖苷酶(NAG)采用对硝基酚比色法[31]。
1.6 真菌多样性分析
利用“Mobio土壤强力提取试剂盒”提取土壤样品基因组DNA(美国),真菌多样性分析基于Illumina HiSeq平台,对ITS1区域进行双末端测序,测序结果利用Usearch对相似度97%以上的Tags进行聚类,获得分类单元 OTU;利用 Unite数据库对 OTU进行分类学注释、Heatmap进行聚类分析;利用 Mothur(Versionv.1.30)开展α多样性分析、Bray-Curtis进行β多样性分析;利用R Vegan对物种丰度数据进行计算后,选择RDA(Redundancy Analysis)开展与环境因子的相关性分析。
1.7 发病率与优势物种相关分析
接入BZ孢子囊悬浮液第2 d开始观察并记录辣椒发病情况,于第7 d、第20 d统计辣椒发病株数,按照下列公式计算发病率,病株率(%)=(病株数/调查总株数)×100。每处理3次重复。结合1.6试验结果,利用SPSS 22.4 Bivariate开展优势物种与发病率相关性分析。
1.8 数据统计与分析
采用SPSS 22.4软件进行One-Way ANOVA 0.05水平的差异显著性分析。
2 结果与分析
2.1 ASD对土壤养分与酶活性的影响
生防菌ASD的施用明显提高了罹病土壤NO3--N与AK含量,降低了NH4+-N含量;与清水对照相比,NO3--N与NH4+-N含量明显下降,其余因子变化不显著(F=0.05,表1);ASD施用后NAG酶活性明显低于罹病土壤与清水对照土壤,PRO、APA、PHO与BG酶活性变化不显著(F=0.05,表2)。

表2 生防菌ASD对土壤酶活性的影响Table 2 Effects of biocontrol strain ASD on soil enzyme activities
2.2 真菌菌群多样性与结构分析
2.2.1 α多样性 稀释性曲线表明(图1),3个土壤样品在抽取序列数量10000时出现拐点,此时的OTU数量为200~300,之后各条曲线趋势逐渐平缓,增加测序数据只能产生少量新的OTU,数据量达到饱和,测序深度已经基本覆盖到样品中所有的物种(覆盖率>99.9%)。菌株ASD处理后与罹病土壤相比Shannon、Ace指数与Chao1指数明显升高,Simpson变化不明显。与对照土壤相比,Shannon与Simpson明显升高,Ace指数与Chao1 指数变化不明显(F=0.05,表3),说明生防菌ASD处理后罹病土壤真菌多样性与丰度均提高。
2.2.2 β多样性分析 利用主坐标分析法进行PCoA(Principal coordinates analysis)分析,主坐标PC1、PC2对土壤真菌群落多样性总解释率达67%。在PC1(47.51%)影响下,生防菌ASD处理的3次生物学重复点位于横坐标负轴,罹病土壤与清水对照处理的3次生物学重复点位于正轴。样品点位置与点间距离表明,3个处理组内重复性均较好;罹病土壤与对照土壤真菌群落构成差异较小,两者与ASD处理的土壤真菌群落构成差异较大(图2)。
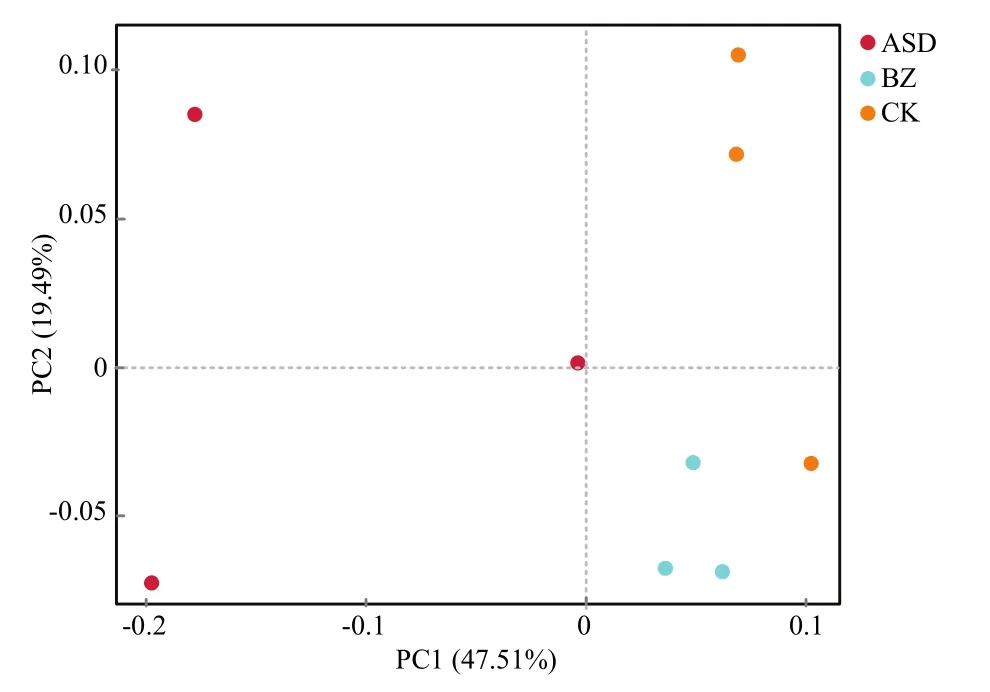
图2 真菌PCoA分析Fig.2 PCoA analysis of fungi
2.2.3 真菌菌群组成与结构 将Euclidean距离算法与Complete聚类方法合并,对Genus水平丰度>1%的真菌物种进行聚类分析。图3显示3个处理优势物种丰度有明显差异:罹病土壤中斜盖伞属Clitopilus与近地伞属Parasola丰度较高,ASD菌液处理后相对丰度降低;嗜热链球菌属Mycothermus、嗜热毁丝霉属Myceliophthora、瑞默氏属Remersonia、青霉菌属Penicillium、曲霉属Aspergillus、镰孢菌属Fusarium、枝孢属Cladosporium、链格孢属Alternaria、锥盖伞属Conocybe与被孢霉属Mortierella在罹病土壤与对照土壤中丰度中等或低,ASD菌液处理后丰度升高;小脆柄菇属Psathyrella只在清水对照土壤中丰度高,在罹病土壤与ASD处理土壤中相对丰度下降。结果说明,ASD处理后丰度升高的优势物种数量明显高于罹病与对照土壤,聚类结果同样显示了罹病土壤与对照土壤真菌丰度接近,二者与生防菌ASD处理距离较远。
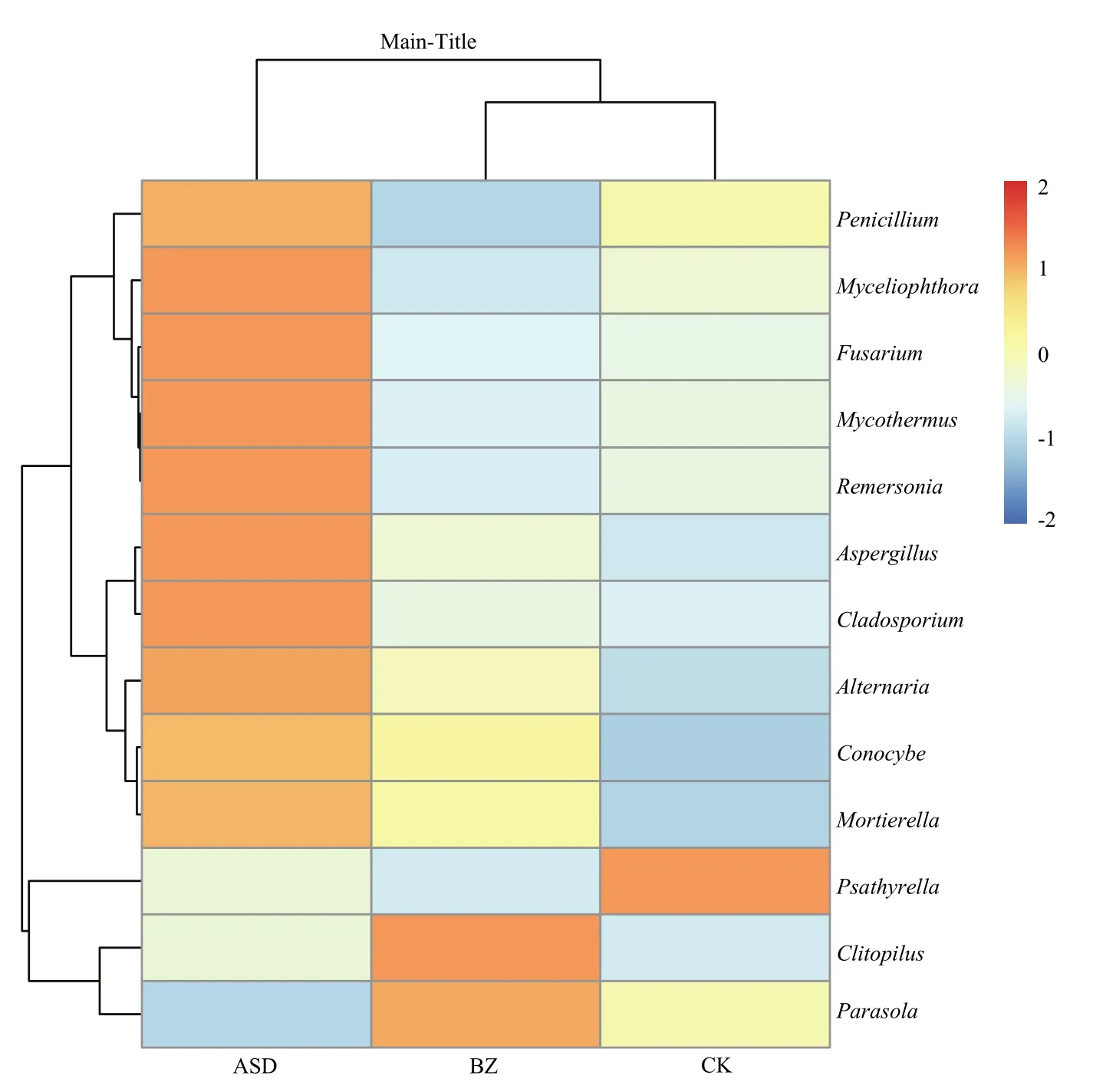
图3 属水平真菌相对丰度聚类热图Fig.3 Clustering heat map of relative abundance of fungi on genus level
2.2.4 与环境因子RDA分析 选取含量显著变化的NH4+-N、NO3--N、AK与NAG开展相关分析。DCA(Discriminant Component Analysis)计算结果中Lengths of gradient第一轴中的Axis lengths最大值为3.31,介于3.0~4.0,在Genus水平开展RDA线型相关分析。RDA1和RDA2占总解释变量的42.82%,罹病土壤和对照土壤处理位于横坐标正轴内,二者群落结构相似,与位于负轴的ASD处理差异较大;NO3--N和AK含量与ASD处理呈正相关,并正向影响锥盖伞属、毁丝霉属、瑞默氏属、嗜热链球菌属、被孢霉属、青霉属、链格孢属及曲霉属的相对丰度;NH4+-N含量、NAG活性与罹病土壤及对照土壤处理呈正相关,正向影响小脆柄菇属与斜盖伞属相对丰度(图4,5)。
2.3 优势物种与发病率相关分析
辣椒植株从接入BZ孢子囊悬浮液第7 d后开始陆续发病,第7 d发病率达98.33%,第20 d时发展病率达100%;施入生防菌ASD菌液后第7 d和第20 d发病率均为11.67%(表4)。Genus水平丰度>1%的优势真菌与发病率的相关分析表明,斜盖伞属与辣椒疫病发病率呈显著正相关(R>0,P<0.05),锥盖伞属和近地伞属丰度与发病率呈正相关不显著(R>0,P>0.05);链格孢属、曲霉属与被孢霉属等10个物种丰度与发病率呈不显著负相关(R<0,P>0.05),结果与聚类热图优势物种变化基本一致(表5)。

表4 生防菌ASD对辣椒发病率的影响Table 4 Effects of biocontrol strain ASD on the incidence in pepper
3 讨论
真菌作为真核生物,是土壤中植物残体的主要分解者[32],对改变土壤营养状况与维持植物正常生长发挥重大作用[33]。本研究通过对土壤营养与酶活性测定发现,ASD可以明显提高罹病土壤硝态氮、有效钾含量,降低铵态氮含量与 N-乙酰基-β-D-氨基葡糖苷酶(NAG)活性。铵态氮与硝态氮的变化趋势不同,一方面可能是由于土壤中2种形态氮素的转化速度不同[34],快速的硝化作用消耗了土壤中的铵态氮导致[35];另一方面可能与取样时间有关,郭媛等[36]研究结果证明,不同施肥处理下土壤中的硝态氮与铵态氮在1~28 d内是一个复杂的动态变化曲线:铵态氮在1~4 d内快速达到峰值,7~14 d又快速下降,28 d后趋势于稳定;硝态氮则反之,在1~28 d内硝态氮含量呈上升趋势,之后含量稳定。本研究的取样时间点为接入ASD菌液第20 d,2种形态的氮素含量水平是否也存在动态变化曲线这需进一步研究证明。NAG作为降解几丁质和肽聚糖的微生物胞外酶,其活性会受到土壤氮素有效性的抑制[37,38]。此外,本研究在20 d取样时发现,土壤有机质、有效磷含量及蛋白酶、酸性磷酸单酯酶、β-葡萄糖苷酶活性影响不显著,这是因为土壤有机质与土壤酶是一个复杂长期变化、互相影响的复杂综合体,受多种因素协同作用,对土壤微生态环境具有缓冲作用,在短时间内可以保持相对稳定性,因此导致多个环境因子在短时间内变化不显著。
生防真菌作为外源功能微生物可以通过改变土壤原有微生物群落结构,从而抑制病害的发生也已经被许多研究证实:刘国坤等[39]利用生防真菌淡紫拟青霉Paecilomyces lilacinus处理柑橘慢衰病根际土壤,扈进冬等[40]利用木霉拌种剂LTR-2处理小麦土壤后,土壤真菌多样性与丰度均有所升高,土壤真菌群落结构发生改变,降低病害的发生。均与本研究结果一致:黄柄曲霉 ASD处理后土壤真菌多样性与丰度均有所提高。ASD的施入提高了嗜热链球菌属与嗜热毁丝霉属等物种丰度、降低了斜盖伞属与近地伞属丰度,使土壤优势种群结构发生改变;丰度上升的优势物种与发病率负相关(锥盖伞属除外),丰度下降的物种与发病率正相关,这也证明了菌株 ASD可以通过改变土壤优势真菌结构与丰度,从而降低了辣椒疫病的发病率。此外,本研究丰度升高的物种中有8个属为子囊菌门Ascomycota,该类真菌多为土壤腐生真菌,广泛存在于土壤中,可以降解木质纤维素[41-43],为土壤有机质的提供起到积极作用[44,45]。值得注意的是,同为担子菌门伞菌目的斜盖伞属与锥盖伞属在 ASD施用后丰度变化方向不同,但均与发病率正相关,这是否与ASD代谢产物中存在抑制或促进其生长的物质有关,需进一步验证。
由致病菌引起的土壤连作障碍是一个长期的化学演变过程,生防菌作为具有活性抑菌物质的天然产物对土壤的改善也需要长期施用才可以实现,而不是短期施用可以实现的。生防真菌 ASD具有改变土壤营养状况、调节土壤微生物数量和种群结构、抑制病原菌生长的作用。研究结果可为黄柄曲霉 ASD作为新的生防资源应用于农业生产实践提供理论依据。

