竹荚鱼浸渍冻结液配方的优化与应用效果
王雪松,谢晶,2,3*
1(上海海洋大学 食品学院,上海,201306) 2(食品科学与工程国家级实验教学示范中心(上海海洋大学),上海,201306) 3(上海冷链装备性能与节能评价专业技术服务平台,上海,201306)
浸渍冻结具有冻结速度快、能耗低、冻结质量好等优点,具有可观的应用前景。然而,浸渍冻结过程中存在一些问题,比如冻结液质量下降和冻结液溶质渗入被冻物品等现象影响了浸渍式快速冻结技术的推广应用。目前,多元载冷剂是浸渍冻结技术的研究重点,一方面可以明显降低载冷剂冰点,从而提高冻结食品品质;另一方面,使用三元组分或更为复杂的溶液可限制溶质渗透。张涛等[1]通过响应面法优化了乙醇、低聚果糖、柠檬酸、CaCl2、丙二醇等组成食品级低温冻结液,冻结点可达-63.5 ℃,黏度4.64 mPa·s;杨贤庆等[2]研究了以甜菜碱、丙二醇、NaCl为主要组分,添加少量甘氨酸、低聚木糖、甘露醇,组成冻结点为-38.1 ℃的多元冻结液;YANG等[3]研究发现由乙醇、NaCl、葡聚糖、活性蛋白、菊花素和柚皮素组成的浸渍冻结液用于暗纹东方河豚冷冻,可以很好保持其品质。PINHO等[4]发现在盐水冷冻液中使用葡萄糖会减少冻结过程中盐的渗透;LUCAS等[5]研究发现,在NaCl水溶液(4.55 mol/kg)中加入2 mol/kg的蔗糖,1 h内NaCl的渗透量减少40%。
载冷剂的选择是食品浸渍冷冻技术推广的关键问题。选择载冷剂需考虑如下因素:(1)冻结温度低,必须低于冻结的运行温度;(2)传热系数大,即导热系数大,而黏度要小;(3)性质稳定,安全、无毒、不燃不爆、腐蚀性小、价格低。目前在食品浸渍冷冻中所用的载冷剂主要有盐水溶液(NaCl、CaCl2)、醇类水溶液(乙醇、乙二醇、丙二醇与丙三醇等)、糖类(蔗糖、转化糖、葡萄糖、果糖、山梨糖醇与玉米糖等)的水溶液。徐慧文[6]研究发现,CaCl2组的鱼肉渗盐量低于NaCl组,且冻结品质好于乙醇、丙二醇、乙二醇组溶液。丙二醇挥发性低、对食品渗透性较低,其浓度对冻结点的影响与乙醇类似,对设备的腐蚀性小,而且安全性符合食品要求。因而丙二醇在载冷剂中可代替乙醇和盐[7]。海藻糖是一种天然的抗冻剂,具有保护生物细胞和生物活性物质的功能。WU等[8]研究发现海藻糖可以较好地抑制冻藏过程中鲈鱼鱼糜肌原纤维蛋白的变性。另外,海藻糖使冰点下降的程度与蔗糖一样,已在食品工业中用于降低冰淇淋和其他冷冻制品的凝结点,且甜度远低于蔗糖[9]。
本实验选用食品级的海藻糖、丙二醇、CaCl2和水组成四元低温冷冻液,通过单因素试验及响应面分析试验找到其最佳配比,以期今后应用于水产品的浸渍冻结过程。
1 材料与方法
1.1 材料与试剂
新鲜竹荚鱼由台州市弘帆渔业服务有限公司提供,选取大小均一的个体,鱼体长度16~20 cm,单体质量(100±40)g,采用一层冰一层鱼的方式运回实验室进行冻结处理。
丙二醇、海藻糖、CaCl2,均为食品级,仪衡(上海)生物科技有限公司;Bradford法蛋白浓度测定试剂盒,南京建成生物工程研究所。
1.2 仪器与设备
MDF-U54V-80 ℃超低温冰箱,日本松下公司;Fluke 2640A网络型多点温度采集仪,美国福禄克电子仪器仪表公司;H-2050R冷冻离心机,湖南湘仪实验室仪器开发有限公司;UV-1102紫外可见分光光度仪,上海天美仪器有限公司;DSC823e差式扫描仪,梅特勒-托利多仪器有限公司;Physica MCR301高级流变仪,奥地利安东帕有限公司;CR-400色彩色差计,日本柯尼卡美能达公司;TA.XT Plus质构仪,英国Stable Micro Systems公司。
1.3 实验方法
1.3.1 速冻液冻结点的测定
将配制好的冻结液置于-80 ℃超低温冰箱进行冻结,并将热电偶探头浸入冻结液中,记录冻结过程中温度随时间变化数据,并得出相对应的冻结曲线。冻结液在降温过程中存在一段出现略微升温现象的曲线。对此段平缓曲线上的温度求取平均值,可视为该冻结液的近似冻结点[2,10]。
1.3.2 冻结液黏度的测定
使用旋转流变仪进行测量,使用同轴圆筒型夹具系统,温度选择4 ℃,剪切速率变化范围为0~1 000 s-1,选取剪切速率为8 s-1时的黏度为冻结液黏度[11]。
1.3.3 冻结液比热的测定
采用蓝宝石比热法,使用差示扫描量热仪(differential scanning calorimetry,DSC)进行测定[12]。通过公式(1)计算待测样品的比热容:
(1)
式中:m1,蓝宝石质量,mg;m2,样品质量,mg;Y0,T1时基线的DSC数值,mW;Y1,T1时蓝宝石的 DSC数值,mW;Y2,T1时待测样品的DSC数值,mW;C1,蓝宝石的比热容,J/(mg· K);T1取40 ℃。
1.3.4 Box-Behnken实验设计
本实验通过查表(ASHRAE手册2005)对丙二醇和CaCl2进行单因素分析,考虑到复配冷冻液的热物性变化,确定主要研究的丙二醇质量分数为8%~12%,CaCl2质量分数为10%~20%,并通过预实验测试不同质量分数海藻糖溶液(5%、10%、15%、20%、25%)的冻结点、比热和黏度,确定海藻糖质量分数为5%~15%为宜。进行Box-Behnken响应面试验,自变量为海藻糖(A)、丙二醇(B)、CaCl2(C)的质量分数,以冻结液的冻结点绝对值、黏度、比热为响应值,设计了3因素3水平的响应面分析实验,试验因素水平见表1。

表1 载冷剂配比的响应面试验因素水平表Table 1 Response surface test factors and levels for refrigerant ratio
1.3.5 不同冻结方式的对比实验
将新鲜竹荚鱼均分为3组,分别做如下处理:
第1组直接置于-30 ℃冰箱冻结;第2组直接浸渍在优化后的复配冷冻液(-30 ℃)中冻结;第3组直接浸渍在目前食品工业中常用25% CaCl2冷冻液(-30 ℃)中进行冻结。当鱼中心温度降至-18 ℃时,用滤纸吸干样品表面残留的液体,放置于4 ℃冰箱中解冻后进行相关理化指标的分析。
1.3.6 保水率的测定
持水力参考TAN等[13]的方法,每组样品重复 3 次,按公式(2)计算:
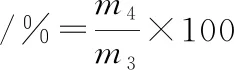
(2)
式中:m3,离心前的竹荚鱼质量,kg;m4,离心后的竹荚鱼质量,kg。
1.3.7 冻结速率的测定
根据BULUT等[14]的方法,把热电偶的探头分别插入竹荚鱼鱼体的几何中心(鱼体长度一半的位置)和鱼体表面,通过多点温度采集仪实时记录鱼体冻结过程的温度变化。冻结速率采用国际制冷学会提出的方法计算,如公式(3)所示:
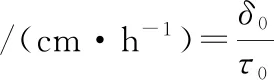
(3)
式中:δ0,食品表面与热中心的最短距离,cm;τ0,食品表面达到0 ℃后至热中心温度达初始冻结点以下15 ℃所需的时间,h。
1.3.8 盐溶性蛋白含量的测定
根据WANG等[15]的方法,鱼肉中的盐溶性蛋白含量使用Bradford法蛋白浓度测定试剂盒进行测定。
1.3.9 鱼肉渗盐量的测定
参考徐慧文等[16]的方法进行测定。
1.4 数据处理与分析
通过Design-Expert 10软件进行分析,绘制响应曲面图,得到复合冻结液最佳配比。除特殊说明外,实验均设3组平行,数据使用SPSS 20.0软件进行单因素方差分析。
2 结果与分析
2.1 响应面分析与实验结果
根据表1进行试验分组,试验共17组,1~12为析因试验,13~17为中心试验,用来估计试验误差。各组的试验结果见表2。
通过Design-Expert 10软件对表2的各组实验数据进行回归拟合,试验因素对3种响应值的影响可分别用以下回归方程表示:
Y黏度=5.54+1.78A+0.97B+1.90C-0.010AB+1.17AC+0.012BC+0.50A2+0.56B2+0.32C2
Y冻结点=22.12+3.53A+1.21B+10.20C+0.76AB+2.30AC+1.45BC+2.36A2-0.31B2+2.75C2
Y比热= 4.48-0.15A-0.091B-0.41C-0.038AB+0.014AC-0.20BC+0.12A2+0.11B2+0.03C2
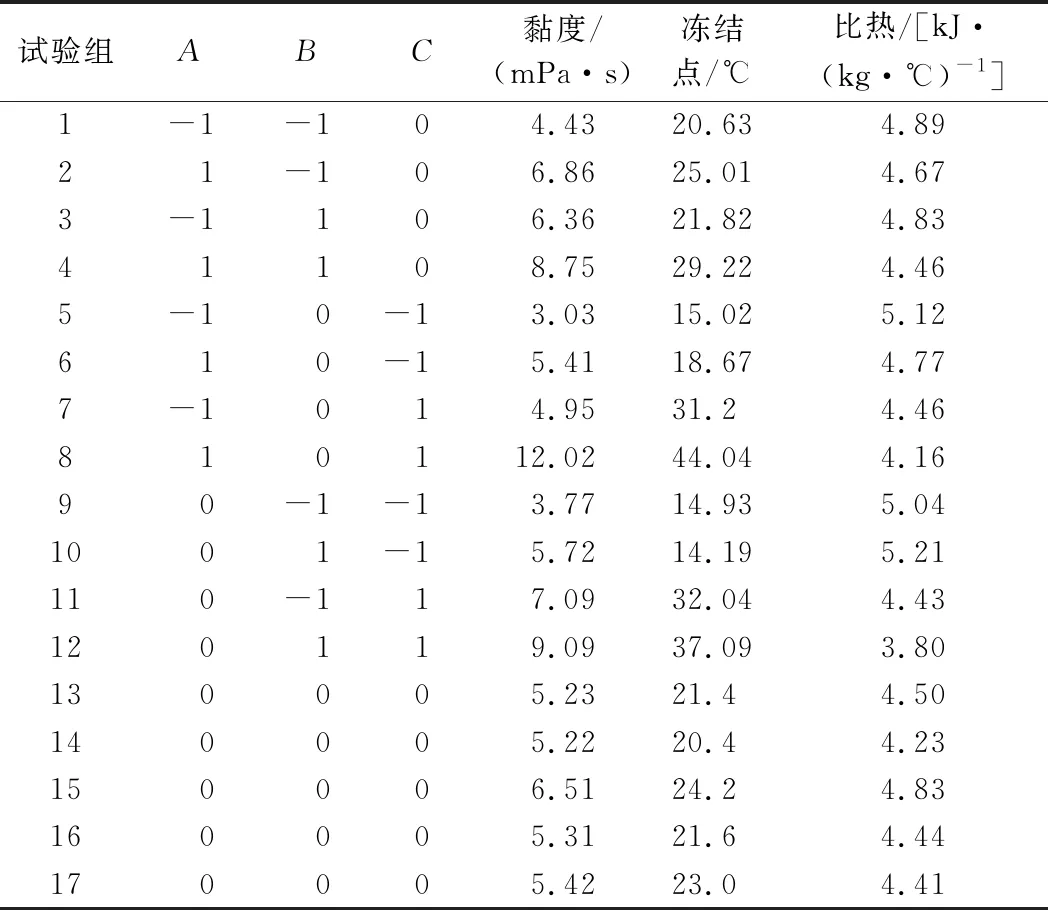
表2 响应面分析试验结果Table 2 Experimental results of response surface analysis
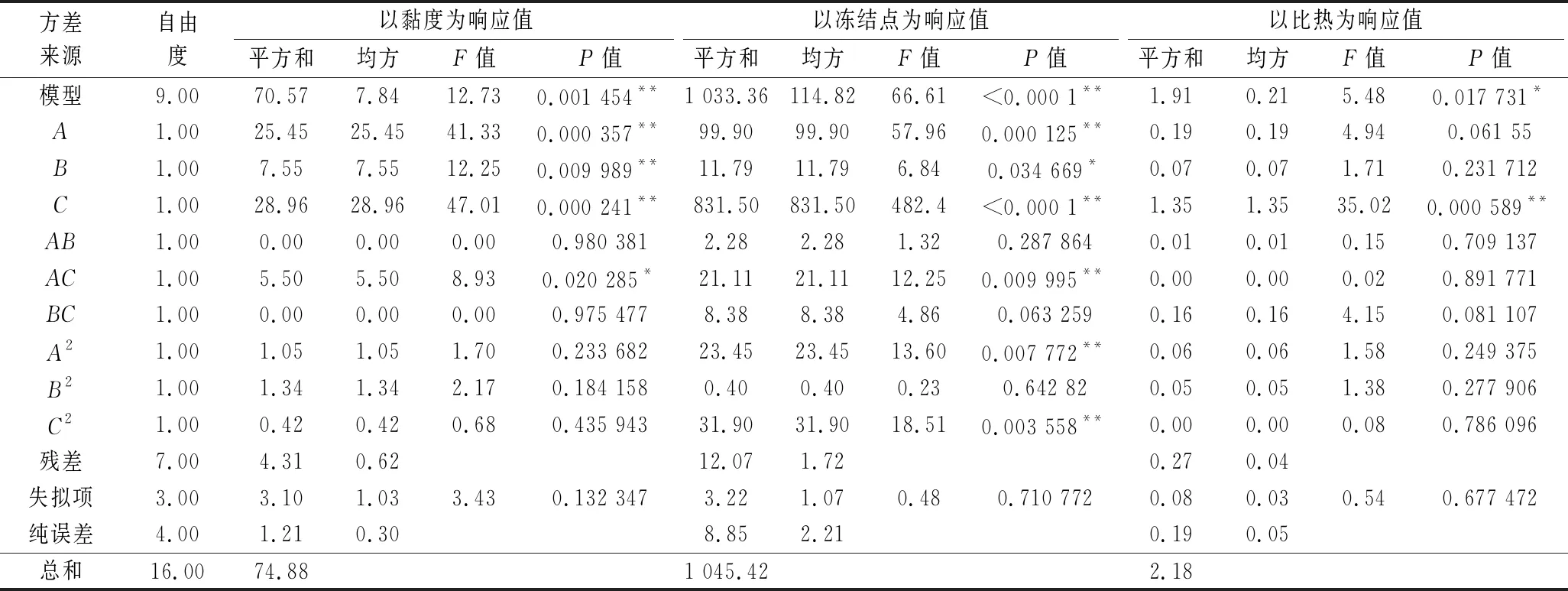
表3 回归方程的方差分析Table 3 Analysis of variance of the regression equation
为更直观地反映各项因素对冻结液传热性能的影响,根据模型方程,通过Design Expert软件对冻结液配方进行响应曲面图分析。图1是3因素间交互作用对冻结液黏度影响的响应面图。当海藻糖添加量不变时,冻结液黏度随着丙二醇添加量的增加而缓慢增加;当丙二醇添加量不变时,冻结液黏度随着海藻糖添加量的增加而快速降低,说明海藻糖对冻结液黏度的影响较丙二醇显著,曲线较陡(图1-a);同样CaCl2对黏度的影响较海藻糖大(图1-b);图1-c也显示出CaCl2对黏度的影响较丙二醇显著。结合表3可知,3因素对冻结液黏度的影响大小为:CaCl2>海藻糖>丙二醇。
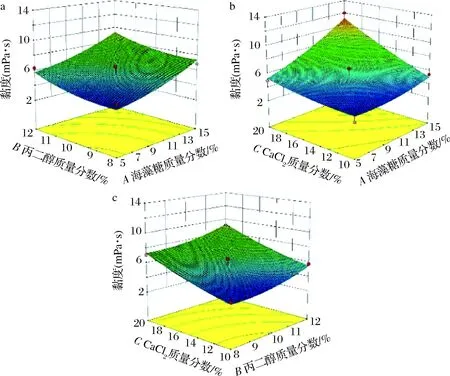
图1 海藻糖、丙二醇和CaCl2各因素交互作用对冻结液黏度影响的响应面图Fig.1 Response surface diagram of the interaction of trehalose,propylene glycol and CaCl2 on the viscosity of quick-freezing liquid
图2是3因素间交互作用对冻结液冻结点绝对值影响的响应面图。由图2-a可以看出,在CaCl2质量分数为15%,海藻糖的添加量不变时,冻结点随着丙二醇添加量的增加而缓慢下降;而当丙二醇添加量不变时,冻结点随着海藻糖添加量的增加而快速下降,这说明海藻糖对冻结点降低的影响较丙二醇显著。图2-b、2-c则分别表明,CaCl2对速冻液冻结点的影响较海藻糖、丙二醇显著。这与表3中各影响因素对速冻液冻结点影响顺序一致,即CaCl2>海藻糖>丙二醇。
由单因素分析可知,比热均随3种物质浓度的增加而降低。根据表3中的F值大小判断各影响因素对速冻液比热的影响程度,F值越大,影响越大,影响程度依次为CaCl2>海藻糖>丙二醇。
在黏度取最小值,冻结点、比热取最大值的条件下,通过Design-Expert 10软件拟合实验结果,得到复配冻结液的最佳配方是5.001%海藻糖,8.092%的丙二醇,19.998%的CaCl2,根据模型方程的预测,复配冻结液的理论黏度、冻结点、比热分别为4.863 mPa·s、-29.490 ℃、4.701 kJ/(kg·℃)。根据响应面优化的结果,以5%海藻糖、8.1%丙二醇、20% CaCl2为配方,进行验证实验来检验模型预测的准确性,在此条件下重复3次,测得最佳冻结液黏度、冻结点、比热分别为4.784 mPa·s、-29.860 ℃、4.864 kJ/(kg·℃),均与预测值较接近,说明通过该响应面模型优化复配冻结液配比是合理可信的。
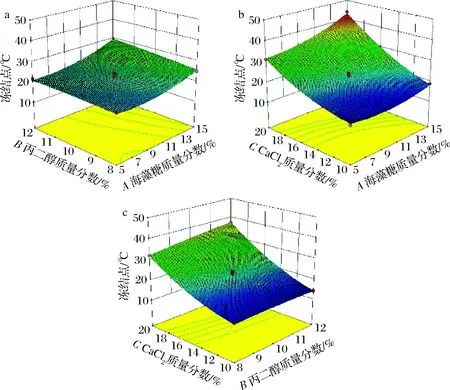
图2 海藻糖、丙二醇和CaCl2各因素交互作用对冻结液冻结点影响的响应面图Fig.2 Response surface diagram of the interaction of trehalose,propylene glycol and CaCl2 on the freezing point of quick-freezing liquid
2.2 不同冻结方式对竹荚鱼品质的影响
冻结速率会影响冻结食品内冰晶大小及分布,冻结方式按冻结速率可分为慢速冻结(0.1~1.0 cm/h)、中速冻结(1~5 cm/h)、快速冻结(5~20 cm/h)[17]。由表4可知,各组冻结速率大小:复配浸渍组>工业浸渍组>冰箱冻结组。
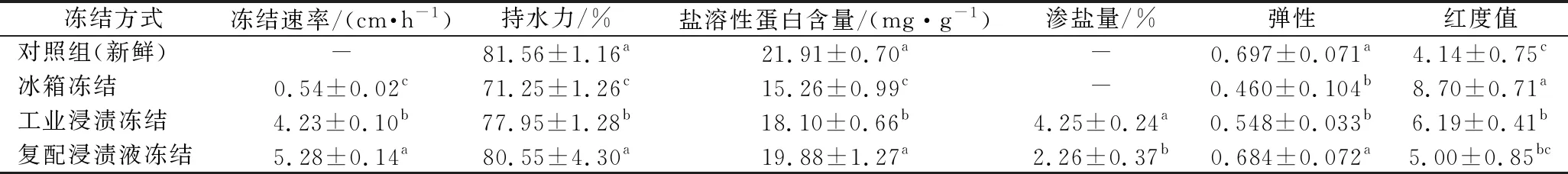
表4 不同冻结方式对竹荚鱼品质影响结果Table 4 Effect of different freezing methods on the quality of T.japonicus
在相同的冻结温度下,浸渍冻结组均快于冰箱冻结,这是由于冻结液的传热系数远大于气体;复配浸渍组属于快速冻结,因其冻结液黏度小于工业浸渍组,且比热大于工业浸渍组,表明冷冻液的传热热阻小且热容量大,因此其传热性能增强,冻结速率提高[7,18]。
持水力是用于评价食品组织保水性的重要指标,由表4可知,复配浸渍液冻结的竹荚鱼持水力显著高于工业浸渍组和冰箱冻结组,最接近新鲜对照组,最能保持鱼肉组织中的水分。这是由于快速冻结使组织内冰层的伸展速度大于水分迁移速度,冰晶细小且量多,分布接近新鲜物料中原来水分分布状态,最能保持鱼肉中的水分状态。辛美丽[19]的研究也表明了-35 ℃浸渍快速冻结显著减少鱼肉汁液损失。
表4中各冻结组的盐溶性蛋白含量大小顺序为:复配浸渍组>工业浸渍组>冰箱冻结组。蛋白含量反映鱼肉蛋白变性程度,可以看出复配浸渍组的盐溶性蛋白含量较高,蛋白变性程度最小,这是由于快速冻结降低鱼肉蛋白的变性,且海藻糖具有抗冻的特性,可以降低冷冻过程中冰晶对蛋白结构的破坏[20]。
渗盐量的增加会直接影响冻品的品质。徐慧文等[21]的研究表明CaCl2浸渍冻结速率越快,浸渍时间越短,渗盐量越低。本实验中的复配浸渍冻结组的CaCl2含量低,冻结速率快,且糖类物质的添加也有助于降低冻结过程中盐的吸收[22]。因此,复配浸渍组的渗盐量显著低于工业浸渍冻结组,可以有效地阻止冻结过程中的渗盐量。
弹性和红度值是评价鱼肉感官品质的重要指标[23-24]。3种不同冻结速率处理后,复配浸渍液冻结组的样品弹性最好,显著高于工业浸渍组和冰箱冻结组,这可能是由于快速冻结减少了鱼肉水分散失,以及蛋白质的冷冻变性,从而保持鱼肉的质地。色泽上,复配浸渍液冻结组的红度值最接近新鲜样品,显著低于冰箱冻结,这一结果可能是因为海藻糖提高了竹荚鱼冻藏期间颜色的稳定性[25]。
3 结论
本实验利用了Box-Behnken实验设计和响应面分析法优化了CaCl2浸渍液配方,得到竹荚鱼浸渍冷冻的多元冻结液最佳配比为:以占冻结液总质量分数计,5%海藻糖、8.1%丙二醇、20% CaCl2。此条件下的冻结液的黏度、冻结点、比热分别为4.784 mPa·s、-29.860 ℃、4.864 kJ/(kg·℃)。并运用该最佳复配冻结液(-30 ℃)进行竹荚鱼冻结实验,与冰箱冻结、工业浸渍冻结相对比,该冻结方式具有最佳的冻结速率,冻结后的样品持水力变化最小,鱼肉弹性与红度值最接近对照组,蛋白变性程度最低,并可有效减少浸渍冻结过程中盐的渗透。综合各指标,优化后的复配冻结液可提高竹荚鱼冻品品质。

