植物GABA信号途径研究
余光辉,涂奕霏,李承龙,周雪妹,刘冰(中南民族大学 生命科学学院,武汉 430074)
γ-氨基丁酸(GABA)是一种代谢型信号分子,在植物发育中扮演着代谢调控和信号调控的双重作用(图1)[1-3]. 在农业实践中,外源GABA的施用能提高香米中一种芳香化合物(2-乙酰-1-吡咯啉,2AP)的含量[4]. 外源GABA可改善玉米早期生长的净光合效率[5]. GABA可以诱导植物对丁香假单胞菌(Pseudomonassyringae)的抗性[6],其可能途径与免疫反应[7]、ROS的调节[8]有关,从而缓解植物的生物胁迫[9]. 此外,本课题组的研究也证实了GABA代谢可作为一个负反馈信号分子参与气孔开度[10]、根毛发育[11]和叶片细胞内复制[12]的调节过程. 最新的研究证实了GABA通过对气孔开度的调控参与植物抗旱胁迫的水分利用效率[13].
虽然GABA在植物发育中的研究已有70多年[1],但GABA参与信号途径调控的许多关键科学问题仍悬而未决. 其中,GABA信号的产生、运输和感知仍然是制约GABA在农作物调控运用中的关键科学问题.
1 GABA信号的产生
GABA作为一种信号分子,依然有3个问题需要回答:是否存在产生GABA信号的信号细胞;GABA是否具有长距离运输的特点;GABA信号到效应细胞后如何和受体结合发挥效应. 这些问题尽管尚无系统回答,但已有研究从不同侧面提供了答案线索. RAMESH等概述了不同植物不同组织部位的GABA含量差异,表明了不同细胞合成GABA能力的不同[13]. 本课题组最近用GUS报告基因系统研究了拟南芥GABA合成的5个关键基因(谷氨酸脱羧酶)的时空表达分布,结果显示GAD家族不同成员的表达模式在整个植株中呈现组织差异性,表现出区域性和局部性分布的特点(图1).

Bar=1.0 mm图1 GAD基因家族在拟南芥不同组织和部位的GUS表达分析Fig.1 The expression patterns of GAD promoters in different developmental stages of Arabidopsis
2 GABA信号的运输
谷氨酸是GABA合成的前体物,通常参与受伤和虫咬反应的远距离信号调控,这一信号途径由类谷氨酸受体(glutamate receptor-like,GLR) 介导[14-16]. GABA是否也参与了远距离的信号调控目前尚缺乏清晰明确的结论. 但积累的数据似乎支持这一可能性. 主要有:GABA代谢支路可能使GABA信号限定在特定的细胞类型中,并调节细胞质中GABA的水平[17];胞质中的GABA可通过质膜上的铝激活苹果酸转运蛋白(ALMT)的介导转向质外体中[18-19]. 但是,就GABA结合的亲和性而言,ALMT转运机制类似于质膜上的GABA转运蛋白(AtGAT1)[20];质外体中的GABA有可能是一种潜在的远距离信号分子[2];同位素追踪技术发现了木质部和韧皮部中有GABA放射性信号[21].
最近,本课题组用GFP荧光标记,显示了GAD3在拟南芥根的中轴鞘的分布,显示了GABA合成和胞外运输的相关性(图2).
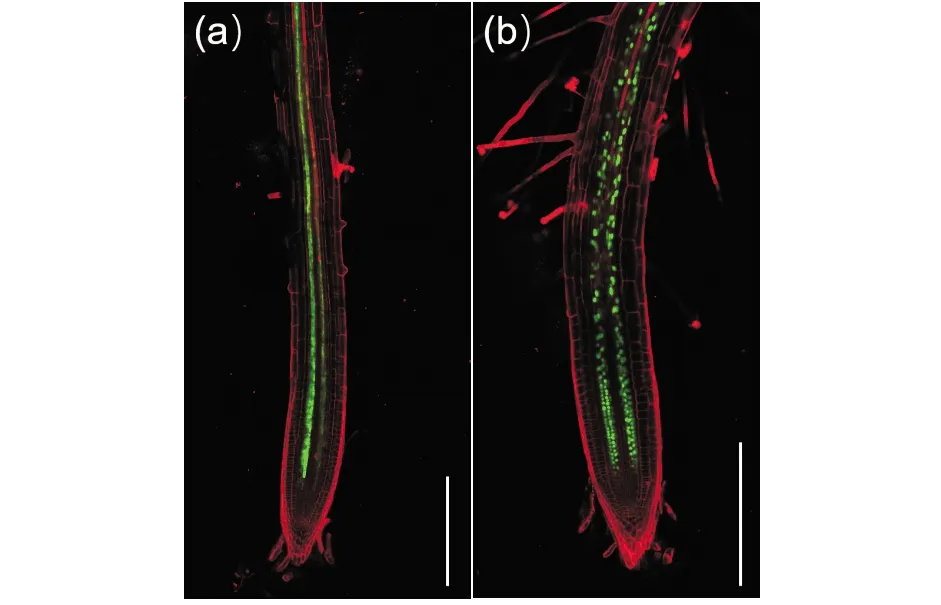
Bar=250 μm图2 GAD3在拟南芥根中柱鞘的荧光分布Fig.2 Fluorescence expression of GAD3 in pericycle of Arabidopsis roots(a) GAD3全长的荧光分布(pGAD3-GAD3:GFP);(b)GAD3核定位信号的荧光分布(pGAD3-H2B:GFP)
但是,现有的碎片化数据仍然不足以形成完整的GABA参与远距离调控的动态图景,其动态变化尚需进一步研究. 在阐明GABA信号系统的关键因素是监测和测量外部刺激和生理反应条件下体内GABA的实时浓度变化. 然而,GABA信号的标记一直是信号途径研究的技术障碍. 最近,基于与GABA高亲和结合位点蛋白(Atu2422)(来自荧光假单胞菌,Pseudomonasfluorescens)开发出检测GABA的荧光传感器(iGABASnFR)[22],为深度解析GABA信号调控的动态网络提供了研究路径和新希望.
3 GABA受体蛋白中对GABA敏感的氨基酸结构域探索
动物的GABAA受体(GABA-AR) 是五聚体(α1β2γ2)配体门控离子通道型受体. 在受体的细胞外结构域(ECD)的β2-α1界面上有两个GABA的结合口袋,决定了GABA羧酸盐和氨基端的定向. 该五聚体受体中决定GABA敏感型的氨基酸残基有环A上的Y97,环B上的Y157,环C上的F200和Y205[23]. 这些侧链氨基酸在GABA的碱性氨基氮周围形成一个芳香手套,F200和Y205的位置对阳离子-π相互作用有利. 其中Y157和Y205的替换会大大降低对GABA的敏感性. T130可能与GABA羧酸盐形成氢键,而R67似乎是GABA识别的关键氨基酸,通过与胍基的静电相互作用稳定配体的羧酸盐头部.
研究表明,蛋白质-蛋白质和蛋白质-配体相互作用的稳定性方面,阳离子相互作用至关重要[24]. GABAC型受体(GABA-CR)属于Cys-环型的离子型受体. 配体结合的位点主要为多个芳香族氨基酸组成的环型结构. GABA与Tyr198之间存在强烈的阳离子-π相互作用,其中Tyr167(Y167)、Tyr200(Y200)和Tyr208(Y208)具有重要的结构互作[25].
GABAB型受体(GABA-BR)属于G蛋白偶联的代谢型GABA受体. 其信号的感知依靠GBR1和GBR2胞外区域形成的捕蝇草型结构域[26-28]. GABA分子结合在GBR1b-VFT的缝隙位置. 配体的羧基端与LB1的残基Ser130(S130)和Ser153(S153)形成氢键,而氨基与His170(H170)和Glu349(E349)形成氢键,而Trp65通过范德华力接触配体[26-27].
考虑到蛋白质序列、结构与功能关系的非线性,一个残基的替换,就可能导致蛋白质功能的完全丧失或显著降低;而序列差异很大的不同蛋白质分子,可能具有非常类似的结构和相同的功能. 动物体系GABA 受体和信号结合位点的多变性为研究植物GABA受体提供了许多未知的不确定性.
4 潜在的植物GABA受体
植物中GABA受体研究相对缺乏,限制了GABA在植物发育调控机制的阐明及其农业应用的前景[1,29]. 作为GABA合成的前体物,谷氨酸的信号途径研究较为深入[15-16,30-32]. 模式植物拟南芥的研究揭示谷氨酸的信号途径主要是通过离子型类谷氨酸受体GLR(glutamate receptor-like)来调控植物的生理过程[14-16,33]. 但是,与动物离子型谷氨基酸受体(iGluR)相比,植物中与GLR结合的配体特异性较低[31-32,34]. 暗示植物的GLR是一种比较宽泛的非特异性的氨基酸感受器,参与生物发育的多种过程[31-32].
在模式植物拟南芥中,GLR有20个成员,在发育进化上分属于3个类别[35-37]. 通过与动物离子型谷氨酸受体(iGluR)蛋白序列的比对,发现在植物GLR受体蛋白的氨基酸端,有两个结合配体的结构域,分别称为LAOBP-Like(位于LBD区域)和LIVBP-Like(位于ATD区域)结构域. LBD区域由S1和S2两个区段的胞外结构域组成(图3). 其中LAOBP-Like结构域是谷氨酸及其他疏水性氨基酸结合触发信号调控的区域,而对LIVBP-Like结构域的功能研究较少. 一个尚待证实的推论是,LIVBP-Like很可能有GABA结合的位点[38]. LAOBP-Like和LIVBP-Like结构域的功能互作及其配体调控机制尚需深入研究.

图3 GLR家族的三个成员(GLR3.3、GLR3.4、GLR3.5)与配体结合的结构域的序列分析(MageX序列比对,SnapGene软件构建)Fig.3 Ligand binding domain sequence analysis of three members (GLR3.3, GLR3.4 and GLR3.5) in GLR family (sequence alignment by MageX and construction by SnapGene software)
配体受体结合的计算机模拟揭示了类谷氨酸受体(GLR)胞外LAOBP-Like和LIVBP-Like结构域可能具有GABA信号分子结合的潜在靶点[39]. 其中,AtGLR家族的5个成员,AtGLR3.3 (AT1G42540)、AtGLR3.4(AT1G05200)、AtGLR3.5(AT2G32390)、AtGLR3.6(AT3G51480)和AtGLR3.7(AT2G32400)具有G蛋白偶联的GABA受体活性[40]. 这些数据都表明AtGLR和GABA 之间可能存在相互作用,这种功能性互作需要进一步实验证据的支持. 有趣的是,AtGLR3.7(AT2G32400)位于胞间连丝中,推测其可能和GABA信号的远距离运输调控有关. 虽然前期的研究揭示了AtGLR3.7 可介导花粉管生长过程中的Ca2+变化[41],但对GABA信号调控的直接机制有待深入研究.
总之,GABA信号在调控农作物发育上的作用依然有待于GABA受体的阐明. GLR是否兼具GABA受体的特性,需要从GLR胞外结构域与GABA结合的动力学特性以及GABA的荧光追踪等方面进行深入研究. 新型GABA检测荧光探针(iGABASnFR)的开发[22]为回答这些科学问题提供了基本的方法和技术手段. GABA信号途径中缺失链环的补全有望最终阐释GABA在调控植物发育中的作用机制.

