拮抗菌HT-6对致病疫霉的竞争及诱导性抑制
蒋继志,张聪颖,梁娇,乔柳,孟翠丽
(1.河北大学 生命科学学院,河北 保定 071002;2. 邢台医学高等专科学校 基础医学部,河北 邢台 054000)
植物病害生物防治因具有低毒、高效、环境友好等特性,越来越受到学者们的关注,细菌因其种类多、繁殖快、易于存活等特点而更显优势[1-2].生防细菌的抑菌机理主要有空间和营养竞争[3]、诱导植物抗性[4]、自发产生抑菌物质[5]、促进植物生长[6]等方式,其中通过空间竞争和营养竞争是众多生防细菌抑制植物病原菌的重要方式之一[3,7],部分拮抗菌能同时借助多种方式抑制植物病原菌.王智荣等[7]发现荧光假单胞菌(Pseudomonasfluorescens)ZX既可以产生抑菌物质,又可通过对葡萄糖、果糖等营养物质的利用优势抑制病原菌指状青霉(Penicilliumdigitatum)的生长;虢雅洁等[8]报道淡紫紫孢菌(Purpureocilliumlilacinum)PLF-1能诱导百合种球对尖孢镰刀菌(Fusariumoxysporum)的抗性,主要是增强植株中超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性,有效减轻尖孢镰刀菌的毒害作用,并促进植株健康生长,同时还能有效抑制尖孢镰刀菌生长,抑制率高达72%.
关于致病疫霉(Phytophthorainfestans)拮抗细菌的抑制机理,当前主要集中于拮抗菌自身产生的抑菌物质及诱导植物抗性与促进植物生长方面.林睿[9]研究表明供试的8株致病疫霉拮抗放线菌均可以产生吲哚乙酸(IAA),且具有解磷能力、产脲酶能力,可以分解土壤中的大分子营养物质,促进马铃薯植株的生长;马强[10]发现弱小珊瑚球菌E10(Corallococcusexiguous)和珊瑚状珊瑚球菌E10(C.coralloides)的次级代谢产物具有比较高的抗致病疫雾活性;王游游[11]证明枯草芽孢杆菌WL-2可以产生Iturin A和Surfactin两类脂肽物质来抑制致病疫霉,并且该菌株对马铃薯植株具有良好的促生作用.迄今为止,对于拮抗细菌是否通过营养与空间位点竞争或通过竞争作用与其他抑菌作用协同抑制致病疫霉鲜见报道.
HT-6菌株是本研究室前期从西藏林芝核桃树病叶中分离出的1株内生细菌,经鉴定为枯草芽孢杆菌(Bacillussubtilis),其菌液对致病疫霉菌丝生长具有很强的抑制作用(抑菌率为89.22%)[12],并能使菌丝体形态发生畸变,但无菌体发酵滤液没有抑菌作用[13],同时在HT-6菌液和致病疫霉菌落之间没有观察到明显且很宽的抑菌带,推测HT-6的抑菌作用可能依赖于细菌的快速生长.另外,本研究室张红霞等[14]发现HT-6菌株经致病疫霉诱导(对峙培养)后能产生纤维素酶(活力为8.141 U),且该纤维素酶可引起致病疫霉菌丝体形态发生明显畸变(畸变率为23%),而HT-6菌株单独培养时不产生纤维素酶.由于致病疫霉细胞壁中主要含有纤维素和葡聚糖等结构物质,菌丝体生长受阻尤其是形态发生畸变,可能是细胞壁中的纤维素和葡聚糖等发生了变化.因此,本实验拟证实HT-6菌株对致病疫霉的营养或空间位点竞争作用,同时探讨致病疫霉菌体和菌丝体细胞壁制剂对HT-6产生纤维素酶和葡聚糖酶的影响,并明确HT-6对致病疫霉的竞争作用和致病疫霉诱导HT-6产生抗菌物质在抑制致病疫霉菌丝生长中的相互关系,为进一步阐明HT-6菌株的拮抗机制提供依据.
1 材料与方法
1.1 供试菌株和供试培养基
枯草芽孢杆菌HT-6(Bacillussubtilis)为河北大学生命科学学院植物病理研究室从西藏林芝核桃树病叶中分离得到的1株内生细菌.致病疫霉[Phytophthorainfestans(Mont.) de Bary]W101菌株为本实验室保存菌株(黑麦培养基斜面14 ℃培养箱黑暗保存).
黑麦固体培养基(Rye)、黑麦液体培养基(RL)、LB液体培养基(LBL)、LB固体培养基(LB)、苯胺蓝葡聚糖酶检测培养基(ABG)、刚果红纤维素培养基(CRC)、CAS固体培养基(CAS)、化学合成培养基(LSM:MgSO4·7H2O, 0.2 g;NH4NO3, 1.0 g;K2HPO4, 0.9 g;KCl, 0.15 g;FeCl2,0.002 g;ZnSO4, 0.002 g;葡萄糖, 5.0 g;蒸馏水1 000 mL).
1.2 HT-6与致病疫霉空间位点竞争的测定
参考Ohtsu[15]的方法并作如下改进,在Rye平板上放置1个琼脂柱(PDA培养基,d=10 mm,h=2 mm),将HT-6菌饼(d=9 mm)经LB培养24 h后置于琼脂柱上表面,再取经Rye培养7 d的致病疫霉菌饼(d=9 mm)置于HT-6菌饼上,20 ℃黑暗培养7 d,以琼脂柱上不接HT-6只接致病疫霉菌饼做为对照,观察记录HT-6及致病疫霉在琼脂柱及Rye表面的生长情况.
1.3 HT-6与致病疫霉营养竞争的检测
1.3.1 产生嗜铁素的检测
参照余贤美[16]的方法观察HT-6和致病疫霉是否产生嗜铁素,取150 μL HT-6菌液加入CAS平板上的孔中(d=9 mm),以接种150 μL LBL作为对照,30 ℃黑暗培养3 d;取致病疫霉(d=9 mm)菌饼置于CAS平板上,以接种空白Rye琼脂块作为对照,20 ℃黑暗培养3 d;分别观察CAS平板上HT-6和致病疫霉菌落边缘是否产生橘黄色晕圈,判断是否产生嗜铁素.
1.3.2 竞争葡萄糖的检测
按照邵江涛等[17]的方法,在150 mL LSM中加入3个HT-6菌饼(d=9 mm)后37 ℃、150 r/min培养5 d,培养液经离心(6 000 r/min,5 min)、过滤(0.22 μm)得到无菌体发酵液;同样在150 mL LSM中加入3个致病疫霉菌饼(d=9 mm)后20 ℃黑暗条件下静置培养5 d,离心及过滤同HT-6无菌发酵液的制备,得到致病疫霉无菌体发酵液;采用硫酸-蒽铜法[18]测定2种无菌体发酵液中剩余葡萄糖含量,利用葡萄糖含量标准曲线与空白LSM培养液中葡萄糖的含量相比,得到细菌HT-6及致病疫霉的葡萄糖利用率.
1.3.3 竞争硝态氮的检测

1.4 致病疫霉活体诱导 HT-6产生细胞壁降解酶的检测
取在Rye上活化培养了7 d的致病疫霉菌饼(d=9 mm)置于新鲜的Rye平板一侧,将在LB上涂布培养24 h的HT-6菌饼(d=9 mm)置于距离致病疫霉菌饼边缘30 mm处,20 ℃黑暗静置培养3 d,取两菌落之间的无菌体琼脂块(DCB,d=9 mm),按照张红霞等[14]的方法,分别在ABG及CRC培养基上培养3 d,观察有无透明圈出现,从而判断有无β-1,3-葡聚糖酶和纤维素酶产生,并用DNS法[14]测定酶活,同时单独培养HT-6菌株,打取其菌落周围的无菌体琼脂块(d=9 mm)作为对照.
1.5 致病疫霉菌丝体细胞壁制剂(CWP)诱导HT-6产生细胞壁降解酶的检测
参照李永才等[20]的方法并作如下改进制备菌丝体CWP,在新鲜Rye表面紧贴放置灭过菌的玻璃纸,取培养了7 d的致病疫霉菌饼放于玻璃纸上,20 ℃黑暗培养7 d,用无菌牙签刮取菌丝体,经无菌蒸馏水和PBS缓冲液冲洗、300目(孔径0.05 mm)筛网过滤后收集菌丝体,取2 g菌丝体溶于100 mL无菌蒸馏水中于组织捣碎机中匀浆,得到致病疫霉菌丝体CWP;分别取3、6、9、12、15 mL CWP加入LBL中,得到CWP质量浓度分别为0.4、0.8、1.2、1.6、2.0 g/L的溶液,再向其中接种经LBL活化培养24 h的HT-6菌液原液200 μL(OD600=1.433),37 ℃、150 r/min培养48 h,培养液经离心(6 000 r/min,5 min)和过滤(0.22 μm)后,得到CWP诱导后的HT-6无菌体发酵液,按照1.4节中的方法分别检测其中β-1,3-葡聚糖酶和纤维素酶的活力.
1.6 CWP诱导后无菌发酵液抑制致病疫霉菌丝生长活性的检测
采用打孔法及平板对峙培养法测定经CWP诱导后的HT-6无菌发酵液对致病疫霉的抑菌活性[14].在新鲜Rye平板中央接种培养7 d的致病疫霉菌饼(d=9 mm),菌饼两侧对称打孔(d=9 mm),孔中滴加适宜质量浓度CWP诱导后的HT-6无菌发酵液200 μL(浓缩10倍),20 ℃黑暗培养7 d,以LBL、HT-6无菌体发酵液及单独培养的HT-6菌液原液分别作为对照,十字交叉法测量菌落直径,统计抑菌率,并挑取受抑制的致病疫霉菌落边缘的菌丝体,镜检观察菌丝体的畸变情况并计算畸变率[14].
抑菌率=(对照菌落半径-处理菌落半径)/(对照菌落半径-菌饼半径)×100%,
畸变率= 发生畸变的菌丝(段)数 / 总菌丝(段)数×100%.
1.7 统计分析
实验数据使用Excel(2020)进行统计,最后经Origin(8.0)软件在P<0.05水平上进行差异显著性分析.
2 结果与分析
2.1 HT-6与致病疫霉对空间位点的竞争
采用空间位点竞争法检测HT-6与致病疫霉的生长速率(mm/d),结果如图1所示.致病疫霉菌饼与HT-6菌饼在PDA琼脂柱上对接培养后,HT-6越过琼脂柱并在Rye表面迅速生长,至第7天菌落半径可达20.0 mm,生长速率为2.8 mm/d(图1a-g),对接培养中的致病疫霉仅在菌饼周围和上方长出很少量菌丝,没有扩展到Rye表面,基本被HT-6菌落抑制,而对照琼脂柱上致病疫霉在第3天开始快速生长,至第7天时菌丝体已布满Rye表面,菌落半径达42.0 mm,生长速率达到6.0 mm/d(图1a1-g1).表明细菌HT-6可以通过自身的迅速生长占据空间位点,从而抑制致病疫霉菌丝的生长.

a-g.HT-6与致病疫霉对接培养1~7 d的结果;a1-g1.单独接种致病疫霉培养1~7 d的结果.图1 细菌HT-6与致病疫霉在PDA琼脂柱上对接后对空间位点的竞争Fig.1 Competition between HT-6 strain and P. infestans in special position on agar column
2.2 HT-6与致病疫霉对营养的竞争

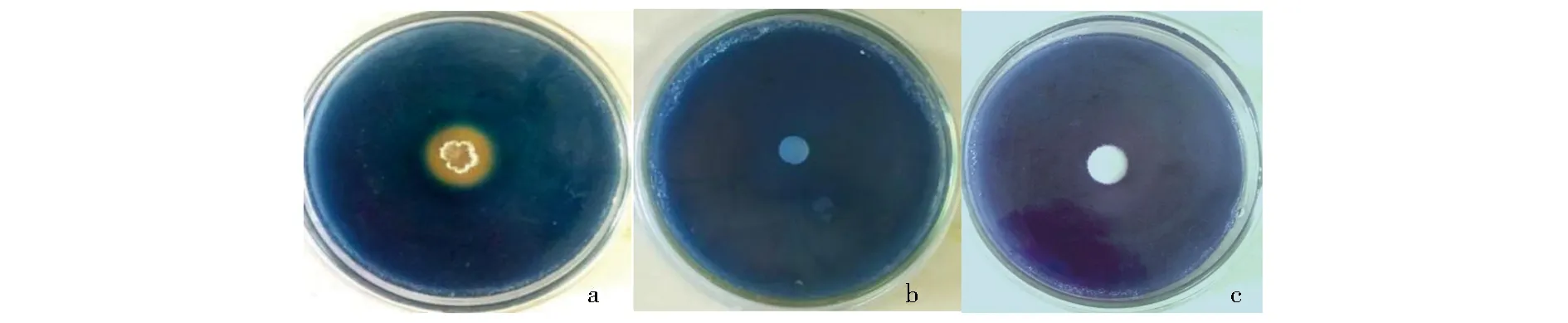
a.HT-6菌液;b.LBL;c.致病疫霉菌饼.图2 HT-6与致病疫霉产生嗜铁素的检测Fig.2 Siderophore in HT-6 strain and P. infestans was detected by chrome azurol sulphonate medium
2.3 致病疫霉诱导对HT-6产生β-1,3-葡聚糖酶和纤维素酶的影响
致病疫霉菌饼与HT-6菌饼对峙培养7 d后,将两菌落之间的无菌体琼脂块(DCB)分别转移至CRC和ABG培养基上继续培养3 d,发现该琼脂块在CRC(图3a)和AGB(图3b)上均有明显的透明圈出现,而单独培养HT-6菌落周围的无菌体琼脂块在CRC(图3a)和AGB(图3b)上均没有观察到明显的透明圈出现,说明HT-6在单独培养时不产生纤维素酶和β-1,3-葡聚糖酶,但受致病疫霉活体或其分泌的某种成分诱导或刺激后产生了这2种酶.进一步用DNS法测得DCB中纤维素酶的活力为6.638 U,β-1,3-葡聚糖酶的活力为2.913 U.

a-b.HT-6与致病疫霉对峙培养之间的无菌体琼脂块;c-d.单独培养HT-6后的无菌体琼脂块.图3 HT-6与致病疫霉对峙培养后产生纤维素酶及β-1,3-葡聚糖酶的检测Fig.3 Detection of cellulase and β-1,3-glucanase after dual culture of HT-6 strain and P. infestans
2.4 CWP诱导对HT-6产生纤维素酶和β-1,3-葡聚糖酶的影响
利用DNS法检测了不同质量浓度CWP诱导后HT-6无菌体发酵液中纤维素酶及β-1,3-葡聚糖酶的活性,结果如图4所示.总体上来看,随着供试CWP质量浓度的增加,诱导后的HT-6无菌发酵液中纤维素酶活先急剧上升而后显著下降,β-1,3-葡聚糖酶活则先上升而后基本保持不变;2种酶活均在CWP为1.2 g/L时达到最高且彼此比较接近,分别为1.326、1.289 U,但在其他质量浓度条件下,β-1,3-葡聚糖酶活均远高于纤维素酶活;在1.2 g/L CWP质量浓度下的纤维素酶活与其他时间段均达到显著性差异(P<0.05),而1.2 g/L CWP质量浓度下的β-1,3-葡聚糖酶活仅与0.4、0.8 g/L CWP质量浓度下的酶活有显著性差异.

不同小写字母及带上标小写字母分别表示纤维素酶、β-1,3-葡聚糖酶酶活在0.05水平上差异显著.图4 CWP诱导后HT-6无菌发酵液中纤维素酶及β-1,3-葡聚糖酶的活性Fig.4 Activities of cellulase and β-1,3-glucanase in HT-6 free cell fermentation liquid after CWP induction
2.5 CWP诱导后无菌发酵液对致病疫霉菌丝生长的抑制活性
由于单独培养HT-6后的无菌体发酵液对致病疫霉菌丝生长没有抑制作用,利用平板打孔法检测了1.2 g/L CWP诱导培养HT-6后的无菌体发酵液对致病疫霉菌丝生长的影响(图5).结果显示,LBL和单独培养HT-6的无菌体发酵液均没有抑制作用,而CWP诱导后的HT-6无菌发酵液展现出了显著的抑制活性,抑菌率达到33.25%,与LBL以及单独培养HT-6的无菌体发酵液之间均有显著性差异(P<0.05),但与单独培养的HT-6菌液原液作为阳性对照(抑菌率81.33%)相比,抑菌活性要低很多,两者之间达到显著性差异(P<0.05).表明本来对致病疫霉菌丝生长没有抑制作用的HT-6无菌体发酵液,经CWP诱导后变得有抑菌作用了,推测CWP诱导后HT-6产生的纤维素酶和β-1,3-葡聚糖酶发挥了抑菌作用,但抑菌活性显著低于HT-6菌液原液,表明CWP诱导后HT-6产生的纤维素酶和β-1,3-葡聚糖酶在抑制致病疫霉菌丝生长过程中并不起主要作用,同时暗示在HT-6菌液中可能还有其他参与抑制致病疫霉菌丝生长的物质存在或HT-6菌株尚有其他抑菌方式存在.
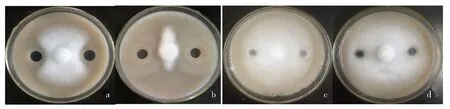
a.CWP诱导后的HT-6无菌体发酵液;b.单独培养的HT-6菌液;c.单独培养HT-6的无菌体发酵液;d.LBL.图5 CWP诱导培养后的HT-6无菌发酵液对致病疫霉菌丝体生长的抑制Fig.5 Inhibition of HT-6 free cell fermentation liquid after CWP induction on P. infestans mycelial growth
进一步挑取致病疫霉菌丝体镜检,观察到经CWP诱导后的HT-6无菌发酵液可使部分菌丝体发生畸变,畸变率约为29.58%,主要有粗细不一、扭曲、折叠、表面凸起增多、分枝增多、内含物分布不均匀或溢出等现象(图6a-c),与受HT-6菌液抑制后的菌丝体形态发生畸变相似(畸变率约为43.2%)(图6d),而正常菌丝体粗细均匀,光滑直顺,内含物饱满且分布均匀(图6e).
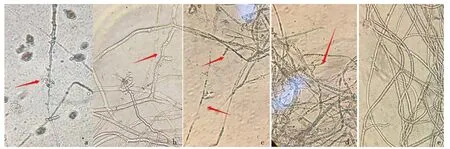
a-c.CWP诱导后的HT-6无菌发酵液处理的菌丝;d.HT-6菌液处理的菌丝;e.单独培养的正常菌丝.a.含物流出;b.粗细不一,凸起增多;c.扭曲折叠;d.内含物分布不均匀.图6 CWP诱导后HT-6无菌发酵液对致病疫霉菌丝体的影响Fig.6 Effect of HT-6 free cell fermentation liquid after CWP induction on P. infestans mycelia
3 讨论
空间位点和营养竞争是生防菌拮抗病原菌的重要作用机理之一[3],一种生物如果能够优于其他生物优先占据空间并快速、有效地利用该空间中的各种营养进行生长定殖, 则能使自身更好地生存、繁殖或传播[16].郭荣君等[21]将枯草芽孢杆菌B006和B010分别与大豆尖孢镰刀菌(Fusariumoxysporum)和腐皮镰刀菌 (F.solani)W1对接培养后,发现这2株细菌均可优先在琼脂柱表面生长并迅速在培养基平板上扩展,完全覆盖病原菌,且病菌菌丝被破坏,无法形成菌落,他们推测如果这2株拮抗菌以产生抗菌物质抑制病原菌生长为主,则自身不会在培养基表面迅速生长并扩展,因而认为这2株细菌主要是通过空间位点竞争发挥抑菌作用[22];Celar等[22]比较了生防木霉菌与多种植物病原菌(F.solani,F.sambucinum,F.moniliforme等) 之间对硝态氮的利用情况,发现分别培养6 d后,生防木霉菌对硝态氮的利用率高达100%,而供试的几种镰刀菌的利用率为60%~75%,均显著低于前者,认为木霉菌主要通过营养竞争抑制上述植物病原菌.此外,在拮抗菌与植物病原菌相互作用中,病原菌的某些成分可作为激发子诱导拮抗菌产生抗菌物质,陈刚等[23]收集植物病原菌尖孢镰刀菌(F.oxysporum)、立枯丝核菌(R.solani)和稻瘟病菌(Pyriculariagrisea)的菌丝,清洗并以滤纸过滤,然后将菌丝体用 120 ℃灭活10 min,再用液氮研磨至粉末,得到细胞壁制剂(CWP),并以10 g/L的CWP对生防菌球毛壳菌(Chaetomiumglobosum)进行诱导,发现诱导前球毛壳菌产β-1,3-葡聚糖酶的能力几乎为0,诱导后产酶能力显著增强,3种病菌的CWP诱导后最高酶活力分别为0.19、0.31和0.61 U;殷福娇[24]以华山松疱锈病菌(Cronartiumribicola)的锈孢子壁CWP诱导木霉菌(Trichodermaspp.)LS020和SS003菌株后,2种菌所产的β-1,3-葡聚糖酶活性均显著增强,其中LS020菌株中酶活由1.71 U升至3.58 U,SS003菌株中酶活由2.08 U升至4.16 U.
本研究中致病疫霉菌饼与细菌HT-6菌饼对接培养后,致病疫霉菌丝被HT-6强烈抑制,基本无法生长,而HT-6可以正常生长并在培养基表面迅速蔓延,表明细菌HT-6在空间位点竞争方面占有绝对优势,这与郭荣君等[22]报道的枯草芽孢杆菌B006和B010主要是通过空间位点竞争抑制大豆尖孢镰刀菌和腐皮镰刀菌的结果一致;同时,致病疫霉不产生嗜铁素,而HT-6可以产生嗜铁素来优先利用环境中的铁,即可以通过在根际中螯合铁来抑制植物病原体的生长(抑菌率为89.22%)[12],这与余贤美等[15]发现枯草芽孢杆菌CAS15可以分泌嗜铁素来抑制稻瘟病菌、尖孢镰刀菌等15种病原菌的结果相一致(抑制率均高于88%);HT-6对于葡萄糖和硝酸盐的利用率均显著高于致病疫霉,这与Celar等[22]对生防木霉菌与几种植物病原菌竞争硝态氮的研究结果一致.此外,本实验还发现HT-6经致病疫霉菌体和CWP诱导后均可产生纤维素酶和β-1,3-葡聚糖酶,只是菌体诱导后产生的2种酶活显著高于CWP的诱导,而HT-6菌株单独培养时不产生这2种酶;进一步发现本来对致病疫霉菌丝生长无抑制作用的HT-6菌株无菌体发酵液,经CWP诱导后对致病疫霉菌丝生长有了较强的抑制作用,可能是诱导后HT-6无菌体发酵液中的纤维素酶和β-1,3-葡聚糖酶发挥了抑菌作用.以上结果表明细菌HT-6既可通过空间与营养竞争又可通过致病疫霉的诱导而产生胞壁降解酶来协同抑制致病疫霉,其中以空间和营养竞争抑制病菌为主.这为深入理解HT-6对致病疫霉的抑制机理提供了新的实验证据,也暗示细菌HT-6在未来防治马铃薯晚疫病中应根据病害发生发展情况预先施用才会有更好的效果.因此,利用细菌HT-6在田间实际防治马铃薯晚疫病的实验研究应尽快开展.
——谷物β-葡聚糖的最新研究进展

