基于亲和超滤技术的天然活性物质筛选方法
王志强,韩晔红,闫宏远,
(1.河北大学 公共卫生学院,河北省公共卫生安全重点实验室,河北 保定 071002;2.河北大学 药学院,药物化学与分子诊断教育部重点实验室,河北 保定 071002)
天然产物具有来源丰富、结构多样等特点,是药物先导结构的重要来源,在药物研发中扮演着极为重要的角色.据统计,从1981年到2019年,在全球批准的1 881种临床药物中有49.5%直接或间接来源于天然产物,以天然产物为基础研发新药的成功率远高于化学合成物质[1].从天然提取物中发现药物先导结构是天然来源药物研发的基础,新颖天然活性物质的快速筛选鉴定是获得药物先导结构关键.但由于天然提取物的化学组成复杂且各组分含量差异巨大,给天然活性物质的筛选鉴定造成了巨大困难,严重阻碍了新药研发的进程.
目前,从复杂提取物中筛选鉴定天然活性物质的研究普遍面临以下几个问题:1)经过数十年的筛选研究,大量天然活性物质被发现报道,现有的研究结果大都是对已知活性物质的重复发现,新颖活性物质的发现比较困难;2)筛选复杂提取物中的微量组分是发现新颖天然活性物质的有效途径,但传统活性追踪分离法反复“分离-活性评价-组分鉴定”的过程费时费力,不但无法在分离前确定活性物质的结构新颖性,而且还容易在富集纯化过程中丢失微量活性物质;3)随着新技术和新材料的快速发展,现代分析化学技术可以为复杂提取物分析提供更全面和更准确的成分与结构表征信息,但各组分的生物活性仍很难做到分离前的表征和预测;4)常规的高通量筛选方法主要是针对小分子化合物库所开发的,并不完全适用于从复杂混合物中筛选活性物质.因此,提高天然活性物质筛选效率需要构建新的策略.
1 亲和超滤技术筛选天然活性物质的原理和影响因素
1.1 亲和超滤技术的原理
亲和超滤是一种将亲和捕获与超滤分离相结合以实现化合物高通量筛选的技术,如图1所示.

图1 亲和超滤技术原理Fig.1 Principles of affinity ultrafiltration techniques
其工作原理是将药物靶标(如蛋白酶、受体、DNA等生物大分子)与小分子混合物(如天然提取物等)在一定条件下培育后,药物靶标将从小分子混合物中选择性吸附与其具有亲和作用的小分子,并以非共价的形式结合成复合物,然后采用适当孔径的超滤膜,通过离心的方式将非共价复合物与其他游离小分子分开,继而实现活性物质分析检测[2].亲和超滤技术根据分析方式,可以分为解离配体小分子分析模式(BFA)和游离小分子分析模式(UFA)[3].BFA是亲和超滤实验常用的分析方式,其一般工作流程包括亲和培育、离心超滤、配体解离和分析检测,即需要在亲和超滤实验后,收集纯化后的非共价复合物,并利用适当的方法(如加入有机试剂、改变pH、超声等)将药物靶标变性,使配体小分子从非共价复合物上解离下来用于后续分析检测,以获取活性物质的结构信息.UFA则是在亲和超滤实验后,直接分析超滤液中的游离小分子,通过与对照组(培育过程中未添加药物靶标)比较检测信号的差异,以锁定活性物质并获取其结构信息.
BFA在亲和超滤之后仍需清洗非共价复合物、解离配体小分子、收集与富集配体小分子等操作[4],工作流程较为复杂.由于实验过程中药物靶标的使用量一般比较少,回收得到的配体小分子浓度即使经过浓缩往往仍然处于较低水平,导致分析检测结果中活性物质的信号响应值普遍偏低,因此一般需要使用质谱等较为灵敏的检测手段.BFA工作流程需要在亲和超滤实验结束后,对非共价复合物进行反复清洗,以避免游离小分子残留在非共价复合物层相中,导致假阳性结果的出现.但清洗过程又可能会使低亲和力配体小分子从非共价复合物上解离下来,因此BFA仅能用于药物靶标的高亲和力配体筛选.此外,由于一些高亲和力配体与药物靶标在培育过程中形成了极为稳定的构象,会产生配体小分子不易从非共价复合物上解离脱落的现象,也因此无法准确获取活性物质的结构信息.
UFA在亲和超滤之后可以直接将超滤液中的游离小分子用于分析检测,工作流程比较简单[5],降低了因操作繁复导致结果误差产生的可能性.因为UFA省去了清洗、解离、收集与富集等步骤,所以UFA可以同时满足高亲和力配体和低亲和力配体的靶向筛选,检测分析结果也将具有更为灵敏的配体检测信号响应.但是,通过UFA筛选活性物质需要设置对照组,即不添加药物靶标进行培育.与对照组相比,检测结果中信号响应值降低的小分子即视为活性物质,表明其与生物大分子结合形成了非共价复合物.但是由于UFA具有更为灵敏的小分子检测信号响应,在信号响应值比较的过程中,容易发生因本底信号噪声过大,不易从复杂体系样品中分辨活性物质,导致假阴性结果现象.此外,若利用UFA筛选酶抑制剂时,复杂体系样品中可能会存在一些物质,在培育过程中作为底物参与酶催化反应被转化为了其他物质,因此检测结果中一些物质的信号响应值降低,并不能完全表明该物质与药物靶标结合形成了非共价复合物,容易导致假阳性结果的出现[6-7].
1.2 影响亲和超滤竞争性亲和的因素
因为天然提取物组成成分复杂且各组分的含量和性质各异,所以无论是采用BFA还是UFA分析模式,在亲和超滤实验过程中,天然提取物都极易与药物靶标产生复杂的相互作用,即原本能和药物靶标结合生成非共价复合物的配体小分子,由于其他小分子的竞争性亲和作用,使该配体-靶标非共价复合物无法形成的现象.影响上述竞争性亲和作用的因素主要有2个,一个是配体小分子与药物靶标的结合亲和力,另一个是配体小分子与药物靶标在亲和培育体系中的浓度[8].配体小分子与药物靶标的结合亲和力越强,表明该配体越易与该靶标结合形成非共价复合物.当2种配体小分子浓度相近且与某药物靶标具有相同结合位点时,具有较高结合亲和力的配体小分子会优先与药物靶标形成非共价复合物;一旦药物靶标浓度远远低于配体小分子的浓度,低亲和力配体小分子则无法与药物靶标形成复合物.然而,即使靶标浓度较低,若具有较高结合亲和力配体小分子的浓度远远低于低亲和力配体小分子,由于高亲和力配体与靶标接触的概率大大降低,低亲和力配体则有了与靶标结合形成非共价复合物的机会.这种复杂的竞争性亲和作用是导致亲和超滤假阴性筛选结果的主要原因,通过优化样品浓度、靶标浓度、培育时间、培育温度、缓冲液pH、离心转速等亲和超滤实验条件因素,可以增加复杂提取物中各类型配体与靶标形成非共价复合物的机会,能最大程度上减少竞争性亲和作用对实验结果的影响[9].
然而,优化亲和超滤实验条件会促进配体小分子与药物靶标的非特异性结合,这种非特异性结合则是导致亲和超滤假阳性筛选结果的主要原因.相关研究结果表明[10],通过合理运用竞争性亲和作用,即在亲和培育体系中加入某已知配体分子作为阻位剂,利用阻位剂占据靶点的特异性结合位点,阻碍提取物中活性物质与药物靶标形成非共价复合物,达到区分配体小分子与靶标特异性和非特异性结合的目的.为了获得更好的区分效果,阻位剂与药物靶标应具有较高的亲和力,其在亲和培育体系中的浓度也需要优化.实际上,复杂提取物与药物靶标的相互作用是更为复杂的,利用阻位剂的竞争性亲和作用也并不能适用于区分所有靶标与配体的非特异性结合.例如,醛糖还原酶与辅酶和底物的结合位点是一条极为深广的沟壑,几乎不存在能完整占据整个特异性结合位点的阻位剂存在,当选择的阻位剂与配体分子的结合位点不能重合时,这一方法也就失效了.
综上所述,与其他天然活性物质筛选方法相比,亲和超滤技术无需对药物靶标或任何小分子进行标记,仅需数微克至数十毫克的药物靶标,即可从复杂混合物中选择性识别药物靶标的特异性配体.此外,由于亲和超滤靶标与小分子结合为非共价复合物的过程是在靶标分子最适的缓冲溶液体系中进行的,因此可以最大程度上的保持靶标与非共价复合物的天然构象,保障筛选结果的准确性.利用亲和超滤技术筛选天然活性物质时,要依据靶标特性和实验目的合理选用BFA或UFA分析模式,优化亲和超滤实验分析条件,选择合适的阻位剂,可以大大提高筛选结果的可靠性(图2)[8].

图2 提高亲和超滤筛选结果可靠性的实验流程Fig.2 Approach for improving the results reliability of affinity ultrafiltration screening
2 亲和超滤筛选数据的量化分析
活性物质与药物靶标之间的结合亲和力是决定其生物活性的关键因素之一,也是评价该活性物质成药潜力的重要指标之一.亲和超滤作为一种天然活性物质筛选技术,目前绝大部分研究均是对活性物质进行简单的定性筛选,鲜有量化分析亲和超滤数据的报道,因此研究人员无法利用筛选结果计算或推测活性物质与靶标之间的结合亲和力.在一些工作中,研究人员利用UFA分析模式,分别获取活性物质与靶标亲和培育前后的信号响应值,活性物质与靶标亲和培育前的信号响应值可以反映活性物质在复杂样品体系中的初始浓度,活性物质与靶标亲和培育后的信号响应值可以反映复杂样品体系中未与靶标结合的活性物质浓度,利用式(1)可以计算出该物质与靶标的结合率(BD).
(1)
式中,BD表示结合率;A0表示活性物质与靶标亲和培育前的信号响应值;A表示活性物质与靶标亲和培育后达到平衡时的信号响应值.Wang等[8]通过计算拟合发现BD确实与结合亲和力存在一定的相关性,但该方法仅能通过比较不同活性物质的BD值来推测各活性物质亲和力的大小关系,而无法真正做到亲和力的量化计算.
2011年,Shibata等[11]首次建立了亲和超滤实验结果的化学计量值与结合亲和力之间的函数关系,见式(2),并通过计算拟合和实验计算的方式证明了该函数关系的成立.
(2)
式中,[L]表示亲和培育后未与靶标结合的游离小分子浓度;[L]0表示亲和培育前游离小分子的初始浓度;[P]0表示靶标的初始浓度;Kd表示解离常数.但该研究并未考虑复杂体系样品中多配体与药物靶标之间存在的竞争性亲和等复杂相互作用,在计算亲和力时需要提前获知靶标初始浓度、配体初始浓度和配体达到亲和平衡时的浓度,因此该函数仅适用于单个分子与药物靶标的亲和超滤分析结果量化.
2015年,Qin等[12]重新构建了亲和超滤实验结果的化学计量值与结合亲和力之间的函数关系,见式(3),并通过实验计算和等温滴定量热法验证了该函数关系是成立的.
(3)
式中,n代表某混合物中含有n个配体;m代表混合物中的一个特定配体;i代表混合物中的一个任意配体;Kdm表示配体m的解离常数;[P]0表示靶标的初始浓度;[Lm]0表示配体m的初始浓度;[PLi]表示各配体与靶标形成复合物的总浓度;[PLm]表示配体m与靶标形成复合物的浓度.该研究考虑了复杂体系样品中多配体与药物靶标之间存在的竞争性亲和等复杂相互作用,但在计算亲和力时同样需要提前获知靶标初始浓度、配体初始浓度和配体达到亲和平衡时的浓度等参数,因此该方法仅适用于小分子化合物库的亲和超滤分析结果量化.
2019年,Wang等[13]在充分考虑了复杂体系样品中多配体与药物靶标之间存在的竞争性亲和等复杂相互作用后,构建了一种基于one-to-one结合模式的适用于复杂未知样品体系的亲和超滤分析结果量化策略(图3),详细描述了亲和超滤实验结果的化学计量值与结合亲和力之间的关系,见式(4),该研究通过计算拟合、动力学分析和等温滴定量热技术分析等方法对量化关系进行了验证.

图3 基于one-to-one结合模式的亲和超滤分析结果量化策略[13]Fig.3 Strategy of affinity ultrafiltration for results quantification based on one-to-one binding mode[13]
(4)
式中,i代表混合物中的一个特定配体;S/Ni表示配体i的信噪比;BDi表示配体i的结合率;Ri表示配体i的回收率;[E]0表示靶标的初始浓度;[Lall]0表示全部配体的初始总浓度;[Lall]表示达到亲和平衡时全部配体的总浓度;Kdi表示配体i的解离常数.在该关系中,靶标初始浓度可依据实验目的任意设置,是实验已知参数,S/Ni、BDi和Ri等化学计量值均可通过实验计算获得.通过计算拟合发现,虽然([Lall]0-[Lall])是无法获取的未知参数,但当靶标初始浓度远远大于([Lall]0-[Lall])时,([Lall]0-[Lall])并不会影响Kd值计算结果,因此该亲和超滤分析结果量化策略满足了复杂未知体系样品的分析要求.
3 亲和超滤与其他分析技术的联用情况
3.1 亲和超滤与其他分析检测技术的联用
亲和超滤技术本质上属于一种样品前处理方法,将亲和超滤技术与其他现代分析技术联用,可以实现不同的分析检测目的.如表1所示,亲和超滤技术与液质联用搭配使用的情况最为常见,因为随着色谱与质谱技术的发展和联用技术的成熟,液质联用技术可以快速检测由亲和超滤技术筛选得到的天然活性物质,并获取其结构信息,实现天然活性成分的快速筛选与初步鉴定.此外,亲和超滤技术还常常与搭载紫外或DAD检测器的液相色谱技术联用,但由于其检测器灵敏度较差,难以应用于BFA分析模式,因此在UFA分析模式中更为常见.亲和超滤-液相色谱或亲和超滤-液质联用技术在获取活性物质结构信息的同时,还能获取其色谱保留信息,通过与高速逆流色谱技术联用,在天然活性物质靶向筛选的基础上还可以实现靶向制备分离,用于结构解析和活性确认.目前,亲和超滤-液质联用技术还常常与电脑模拟分子对接等虚拟活性筛查手段联合使用,在获取活性物质结构信息的基础上,实现药物先导结构的快速优化和活性预测,加快新药研发的进程[14].
3.2 亲和超滤与其他样品前处理技术的联用
天然提取物组成成分复杂且各组分的含量和性质各异,由于受到液相色谱、液质联用等分析技术的分辨率和灵敏度限制,亲和超滤技术难以从复杂体系样品中检测到由亲和超滤技术筛选的微量活性物质.高速逆流色谱是一种液-液色谱分离技术,不需要任何固态载体,能避免固相载体表面与样品发生反应而导致样品的污染、失活、变性和不可逆吸附等不良影响.如图4所示,Wang等[15]将高速逆流色谱与亲和超滤技术结合,从天麻提取物的212种代谢物中筛选出了17种微量酪氨酸酶抑制剂,实现了中药微量活性物质的快速筛选,通过控制分析分离条件,高速逆流色谱技术可以分馏天然产物中的主要成分,并富集微量成分,消除天然产物中不同组分间浓度差异的影响,从而使微量活性物质能被亲和超滤筛选技术检测分析[15].在另外一项工作中(图5),研究人员[16]利用半制备液相色谱分别富集了金银花提取物中的主要组分和微量组分,同样达到了消除提取物中不同组分间浓度差异影响的目的,并应用亲和超滤-液质联用技术筛选鉴定了17种微量神经氨酸苷酶抑制剂.

图4 基于高速逆流色谱-亲和超滤-液相色谱的微量酪氨酸酶抑制剂筛选策略[15]Fig.4 Screening strategy of minor tyrosinase inhibitors based on hyphenation of high-speed countercurrent chromatography, affinity ultrafiltration and liquid chromatography[15]

图5 2D-HPLC-UF-MS筛选策略[16]Fig.5 Screening strategy of 2D-HPLC-UF-MS[16]
4 亲和超滤技术筛选天然活性物质的应用现状
亲和超滤技术1981年首次被应用于血清蛋白结合率的测定[17].1997年,Wieboldt等[18]首次将亲和超滤技术与液质联用技术结合,应用于小分子化合物库中药物先导化合物的发现,自此亲和超滤技术受到了药学界的广泛关注.由于亲和超滤技术克服了传统天然活性物质筛选研究面临的诸多问题,近年来被广泛应用于药用植物和中药提取物中活性物质的快速靶向筛选(表1).2014年,徐晨等[19]首次应用亲和超滤技术筛选中药复方二妙丸中的黄嘌呤氧化酶抑制剂,马丽娜等[20]利用亲和超滤技术首次明确了板蓝根中抗流感病毒的活性成分,共同开启了亲和超滤技术在中药复方及其制剂中药效物质基础研究的应用.2021年,Zhong等[21]首次利用亲和超滤技术从蛋白水解物中筛选到具有黄嘌呤氧化酶抑制效果的功能性小分子肽,进一步扩展了亲和超滤技术的天然活性物质筛选范围.
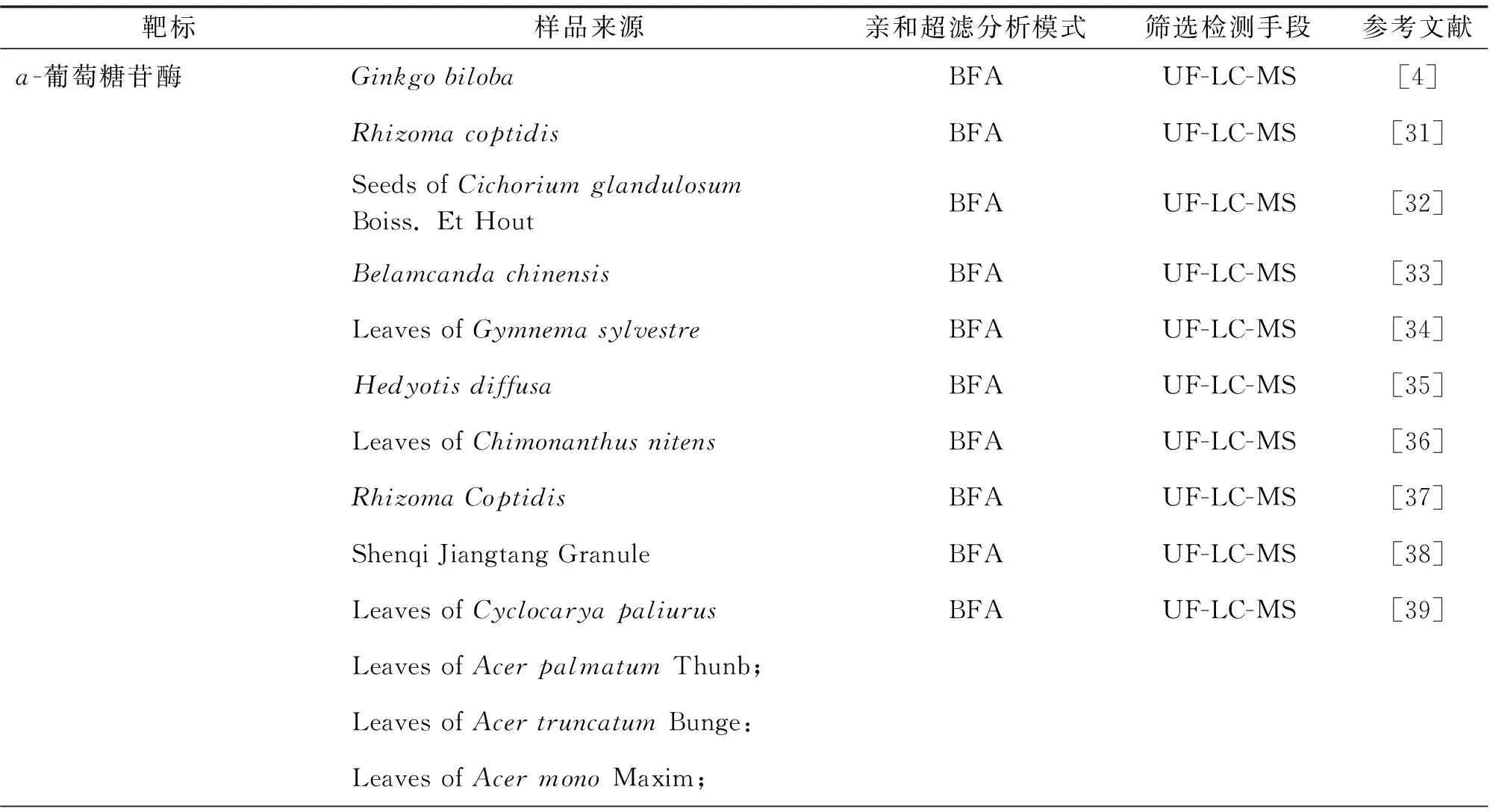
表1 亲和超滤技术筛选天然活性物质的应用情况(2016.01~2021.05)

续表1Continued Tab.1

续表1Continued Tab.1

续表1Continued Tab.1
从复杂体系样品中筛选酶抑制剂是亲和超滤技术最广泛的一种应用,如ɑ-葡萄糖苷酶抑制剂、黄嘌呤氧化酶抑制剂、酪氨酸酶抑制剂、醛糖还原酶抑制剂等.酶作为一类重要的药物靶标,目前已有至少1 500余种被鉴定可作为疾病防治的靶标[22-23].然而,从笔者统计的文献情况来看,近5年亲和超滤技术仅被应用于23种酶抑制剂的筛选研究,这是由于大部分酶试剂还未实现商品化,而实验室制备纯化过程又极为复杂,研究人员缺乏获取新颖靶标的途径,严重限制亲和超滤技术在天然活性成分筛选中的应用.即便是商品化成熟的酶试剂,由于其昂贵的价格,同样限制了亲和超滤技术的推广与普及.如图6所示,Wang等[24]在一项研究中,构建了一种从混合靶标体系中识别特定靶标配体的亲和超滤筛选方法,以肝微粒体为靶标,从丹参提取物中靶向筛选了CYP1A2、3A4、2C9的抑制剂,有望解决亲和超滤筛选技术靶标获取困难的问题.

图6 混合靶标体系中识别特定靶标配体的亲和超滤筛选策略[24]Fig.6 Screening strategy of affinity ultrafiltration for identifying the ligands of a specific target in a mixed target system[24]
除了酶以外,细胞器、蛋白受体、DNA等生物大分子,同样可以作为药物靶标用于活性物质的亲和超滤筛选.例如,Choi等[25]利用亲和超滤技术筛选了艾草提取物中的PPARɑ配体;Yang等[26]和Liang等[27]分别在2个研究中,以线粒体作为药物靶标,从虎杖、黄芩和羌活提取物中筛选鉴定了多种天然活性物;Chen等[28]利用亲和超滤技术,从金银花提取物中发现了8种与脂质体具有相互作用的潜在天然活性成分;马蕾等[29]利用亲和超滤技术从红车轴草中发现了5种DNA结合剂.
近年来,亲和超滤技术也被应用于中药和药用植物等天然产物中多靶点活性成分的筛选.例如,2010年,Mulabagal等[30]首次利用亲和超滤技术筛选了恶性疟原虫硫氧还蛋白还原酶和谷胱甘肽还原酶的双靶点配体;2018年,Wang等[24]首次利用亲和超滤技术从丹参提取物中筛选了CYP1A2、3A4和2C9的多靶点抑制剂.中药和药用植物等天然产物多组分和多靶点的特性,为阐明其药效作用机制带来了巨大困难,亲和超滤技术在天然多靶点活性物质筛选上具有巨大优势,有望为解决这一科学问题提供技术支撑.
5 结语
亲和超滤技术是一种快速、简单、高效的筛选方法,常与高效液相色谱、液质联用等技术结合使用,近年来被广泛应用于天然提取物、中药复方及其制剂、蛋白水解物等复杂未知样品体系中酶抑制剂、蛋白受体配体、DNA结合剂等活性物质的筛选.在利用亲和超滤技术筛选天然活性成分时,由于复杂样品体系极易与药物靶标产生复杂的相互作用,因此要依据靶标特性和实验目的合理选用BFA或UFA分析模式,优化亲和超滤实验分析条件,选择合适的阻位剂,这样可以大大提高筛选结果的可靠性.然而,因为大部分药物靶标还未实现商品化,其制备纯化过程又极为复杂,所以研究人员缺乏获取新颖靶标的途径,亲和超滤技术的应用范围受到了严重限制.随着新技术和新材料的快速发展,将亲和超滤技术与其他现代分析化学技术联用,有望实现亲和超滤结果的定量分析,为复杂样品体系中天然活性物质和多靶点活性物质的筛选提供更全面和更准确的成分与结构表征信息.

