HDAC1基因沉默和HIF-1α过表达改善MSCs定向分化及VEGF分泌的功能*
汤穆浛, 卢俊江, 韩敦正
(1广州市红十字会医院急诊科,广东广州 510220;2广州市胸科医院,广东广州 510095;3广州医科大学附属第一医院心血管内科,广东广州 510120)
骨髓来源的间充质干细胞(mesenchymal stem cells,MSCs)具有容易获取、扩增的特点,同时有着较低的免疫原性和免疫调节能力,现已用于心肌病和心肌梗死等多种心脏疾病的心肌修复与再生,是治疗心血管疾病的理想种子细胞[1]。然而,MSCs 在移植体内的低分化率与低存活率一直制约着它的临床应用。国内外的研究及本课题组前期研究已证实,组蛋白脱乙酰酶1(histone deacetylase 1,HDAC1)基因的表达与MSCs向心肌样细胞分化关系密切,将HDAC1基因敲除可以诱导MSCs 向心肌样细胞分化[2-4]。但是,HDAC1 蛋白也被报道参与了低氧诱导因子1α(hypoxia-inducible factor-1α,HIF-1α)的乙酰化修饰,沉默HDAC1基因可引起HIF-1α 降解[5-6],并影响细胞旁分泌血管内皮生长因子(vascular endothelial growth factor,VEGF)的功能,降低MSCs 移植后的存活率。为解决上述问题,本研究用重组腺病毒HIF-1α三突变体(recombinant adenovirus containing triple-point mutantHIF1-αgene,Ad-HIF-1α-trip)感染的方法使HDAC1沉默的MSCs中HIF-1α 表达上调,从而改善MSCs旁分泌VEGF的功能。
HIF-1α是缺血缺氧发生时维持细胞生存非常重要的分子,可激活下游靶基因包括多种促血管生长因子如VEGF、转化生长因子及其受体基因启动子上的缺氧反应元件,从而启动血管新生过程,提高对缺氧环境的适应性,增强酵解过程,为细胞提供更多的能量[7]。此外,HIF-1α 是组织细胞在低氧状态下激活相应基因转录的核心调节因子之一,其最主要的下游基因VEGF[8]是MSCs 参与心梗后修复过程中最重要的旁分泌因子之一。在缺血缺氧条件下,VEGF的表达上调能改善机体血管形成与侧支微循环建立,有利于MSCs在移植体内的生存及心梗后心功能的恢复。
材 料 和 方 法
1 实验材料
1.1 实验动物 SPF级4~6周龄SD雄性大鼠32只,体重(200±20)g,合格证书编号SCXK(粤)2008-0002,由广东省医学实验动物中心提供。MSCs 由大鼠股骨中分离提取,连续传代3代以上。
1.2 干扰载体病毒 携带绿色荧光蛋白(green fluorescent protein,GFP)基因和HDAC1-shRNA 的慢病毒、携带GFP基因的慢病毒空载体及腺病毒空载体均购自上海吉凯基因化学技术有限公司。构建的Ad-HIF-1α-trip 由南方医科大学心血管内科实验室提供,突变的3个位点分别为:将HIF-1α 的氧依赖性降解结构域(oxygen-dependent degradation domain,ODDD)第402 和564 位脯氨酸(Pro)密码子CCA 和CCC均突变为丙氨酸(Ala)密码子GCA;将HIF-1α的转录激活区第803 位天冬酰胺(Asn)密码子AAT 突变为丙氨酸(Ala)密码子GCA。在HEK293A 细胞中扩增、纯化得到Ad-HIF-1α-trip[9]。
1.3 试剂与仪器 兔抗大鼠HDAC1 抗体和兔抗大鼠HIF-1α 单克隆抗体(Abcam);兔抗大鼠VEGF 单克隆抗体(北京博奥森生物技术有限公司);逆转录试剂盒和荧光定量SYBR Premix Ex Taq PCR 试剂盒(TaKaRa)。PCR 仪(Bio-Rad);MX3000P 荧光定量PCR扩增仪(Stratgene)。
2 实验方法
2.1 全骨髓贴壁法提取大鼠骨髓MSCs 并予以HDAC1-shRNA 慢病毒感染(参考前期实验)[4-5]无菌条件下迅速剥离大鼠股骨与胫骨,清除骨表面附着组织包括肌肉组织,剪刀在骨两端横行剪出小口,DMEM 培养液反复冲洗骨髓并收集骨髓冲洗液,置离心机560×g离心30 min 后弃上清,再加入DMEM/F12 完全培养液悬浮细胞,接种至T-25 cm2塑料培养瓶内进行培养。
2.2 嘌呤霉素筛选获得HDAC1基因沉默的大鼠MSCs 稳 定 细 胞 株(HDAC1-shRNA-MSCs) 骨 髓MSCs 原代培养初期,约4 h 后出现贴壁细胞,随着传代次数的增加,细胞形态渐趋均一稳定,排列可呈鱼群状或旋涡状(图1A)。HDAC1-shRNA 慢病毒感染(MOI=100)24 h 后于荧光显微镜下可观测到GFP 表达(图1B)。再以不同浓度梯度(0、0.5、1、1.5、2、2.5、3、3.5、4 和4.5 mg/L)的嘌呤霉素进行筛选,当药物浓度为0~2 mg/L 时仍有MSCs存活,而浓度大于2 mg/L 时MSCs 全部死亡,所以最终选用2 mg/L 嘌呤霉素筛选目的细胞,构建HDAC1-shRNA-MSCs(图1C)。
2.3 RT-qPCR 检测HDAC1-shRNA-MSCs 中HDAC1
的mRNA 表达 为确定获得的HDAC1-shRNA-MSCs其HDAC1基因表达已被沉默,行RT-qPCR 检测其mRNA 表达情况,以正常MSCs 及慢病毒空载体感染后的MSCs作为对照组。提取细胞中的总RNA,以其中的mRNA 作为模板,采用Oligo(dT)或随机引物利用逆转录酶反转录成cDNA,再进行荧光定量PCR。HDAC1 的 上 游 引 物 序 列 为5′-TCACCGAATCCGAATGACTCATAA-3′,下 游 引 物 序 列 为5′-CTGGGCGAATAGAACGCAAGA-3′;内 参 照GADPH 的上游引物序列为5′-GGCACAGTCAAGGCTGAGAATG-3′,下游引物序列为5′-ATGGTGGTGAAGACGCCAGTA-3′。荧 光 定 量PCR 参 数:95 ℃30 s;95 ℃5 s,60 ℃3 s,72 ℃30 s,共30 个循环;72 ℃10 min,16 ℃10 min。
2.4 Western blot检测HDAC1-shRNA-MSCs中HDAC1蛋白表达 对各组收集的细胞进行总蛋白提取,行BCA 法蛋白含量测定,再取各样本50 μg 蛋白行SDS-PAGE 分离、切胶、转膜;然后5%脱脂牛奶室温下封闭2 h,行相应抗体孵育杂交,应用ECL 法显影、X 胶片显色、暗室曝光后,扫描分析各组蛋白与β-actin的灰度比值,来代表目的蛋白的相对表达量。
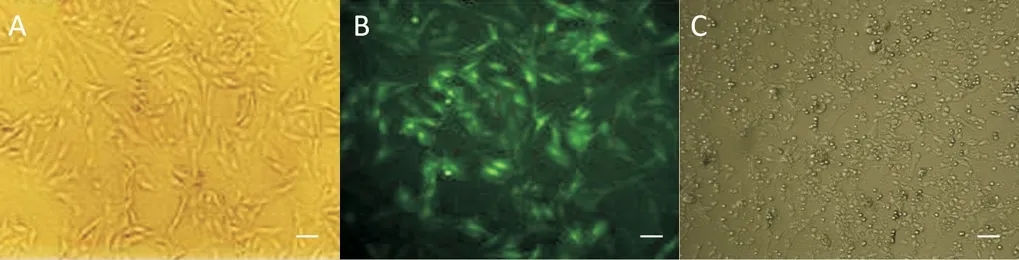
Figure 1. Screening of HDAC1-shRNA-MSCs. A:MSCs at passage 3 showed adherent and spindle-shaped;B:HDAC1-shRNAMSCs were established(GFP indicated the MSCs were transfected by the lentivirus carrying HDAC1-shRNA;C:few of HDAC1-shRNA-MSCs survived when cultured with puromycin at concentration of 2 mg/L. Scale bars=100 μm.图1 HDAC1-shRNA-MSCs稳定细胞株的筛选
2.5 实验分组 实验分为4 组,主要包括MSCs 对照组(细胞不进行任何基因修饰)、HDAC1-shRNA组、vector+HDAC1-shRNA 组(将腺病毒空载体转染至HDAC1基因沉默的MSCs 中)和Ad-HIF-1α-trip+HDAC1-shRNA 组(将Ad-HIF-1α-trip 腺病毒转染至HDAC1基因沉默的MSCs使之过表达HIF-1α)。
2.6 Ad-HIF-1α-trip 腺 病 毒 感 染HDAC1-shRNA
MSCs 取HDAC1-shRNA-MSCs,以每孔3×105个细胞接种于6孔板中,24 h后吸去培养液,PBS洗涤细胞,加入1 mL不含血清及双抗的DMEM培养液培养2 h。取出Ad-HIF-1α-trip 病毒液,冰上溶解后转染入HDAC1-shRNA-MSCs 稳定细胞株中(MOI=100),于37 ℃的细胞培养箱中继续培养24 h。吸去含腺病毒的培养液,加入完全培养液继续培养。
2.7 RT-qPCR 和Western blot 检 测 各 组HIF-1α 和VEGF 的 表 达 RT-qPCR 和Western blot 的 方 法 同2.2和2.3,内参照亦分别为GADPH和β-actin。HIF-1α 的上游引物序列为5′-TACTGCAGCAACCAGGTGAC-3′,下 游 引 物 序 列 为 5′-ACAGAAACGAAACCCCACAG-3′;VEGF 的上游引物序列为5′-TGTACCTCCACCATGCCAAG-3′,下 游 引 物 序 列 为5′-AACAAATGCTTTCTCCGCTCTG-3′。
3 统计学处理
采用SPSS 13.0 软件进行统计分析。数据以均数±标准差(mean±SD)表示。计量数据多组间比较采用单因素方差分析,两两比较采用LSD-t检验。以P<0.05为差异有统计学意义。
结 果
1 RT-qPCR检测HDAC1-shRNA-MSCs中HDAC1的mRNA表达量
RT-qPCR 结果均采用2-ΔΔCt法算出各组模板起始拷贝数之间的相对倍数,从而得出各组间HDAC1 mRNA 表达情况的差别。RT-qPCR 结果显示,HDAC1 mRNA 在各组样本均有表达,其在HDAC1-shRNA-MSCs 中的表达量显著低于正常对照和NTshRNA对照组(P<0.01),见图2A。
2 Western blot 检 测HDAC1-shRNA-MSCs 中HDAC1蛋白表达量
Western blot 结果显示,HDAC1-shRNA-MSCs 中HDAC1 蛋白表达量显著低于正常对照和空载体对照组(P<0.01),见图2B。
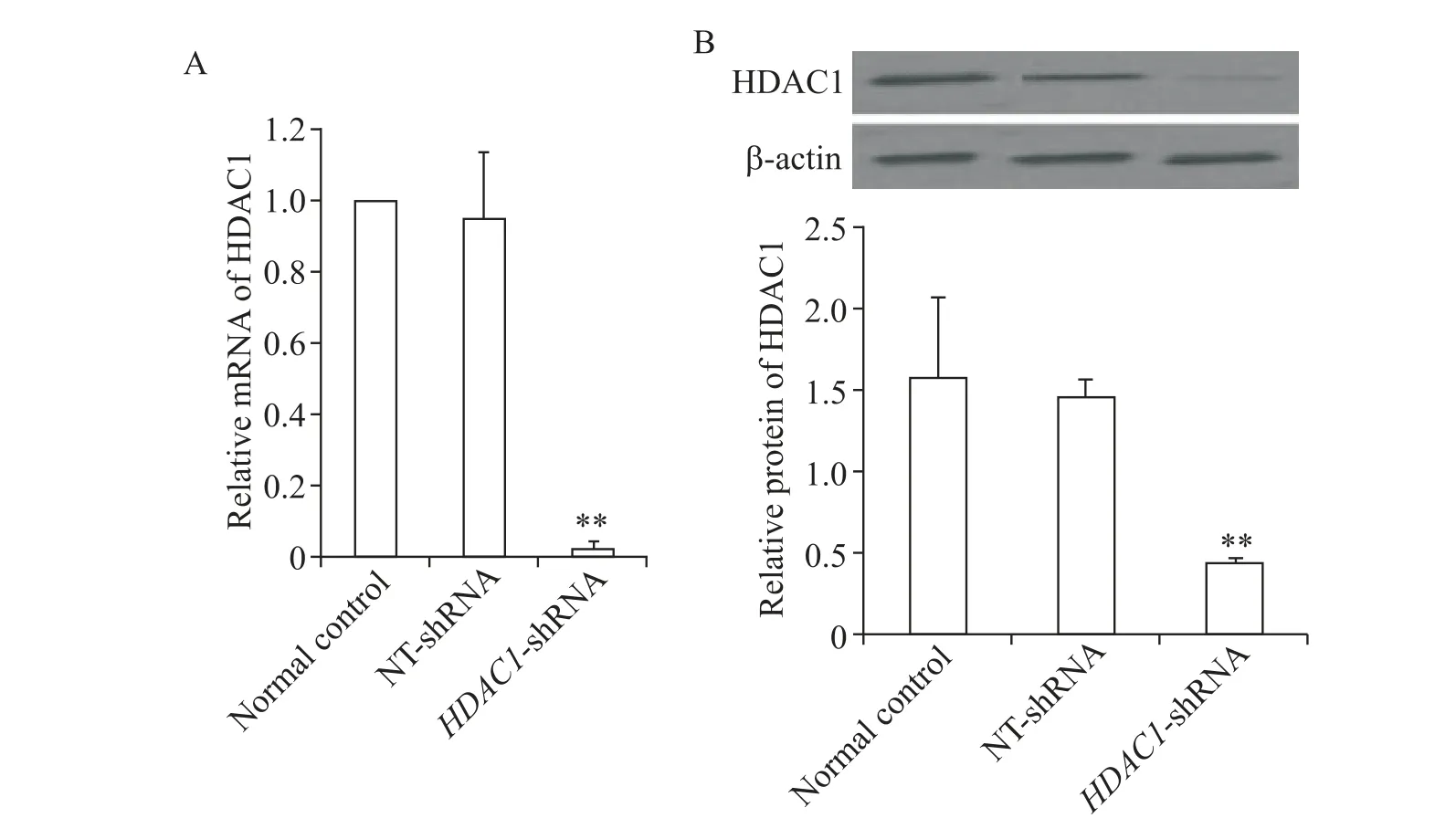
Figure 2. HDAC1 mRNA and protein expression of HDAC1-shRNA-MSCs. RT-qPCR(A)and Western blot(B)results for HDAC1 were shown. Mean±SD. n=6.*P<0.01 vs NT-shRNA.图2 HDAC1基因沉默MSCs中HDAC1 mRNA及蛋白表达的检测
3 Ad-HIF-1α-trip 腺病毒感染HDAC1-shRNAMSCs后各组HIF-1α和VEGF的表达
RT-qPCR 及Western blot 检 测 结 果 显 示,Ad-HIF-1α-trip 腺 病 毒 感 染HDAC1-shRNA-MSCs 后,HIF-1α 和VEGF 的mRNA 及蛋白相对表达量均显著高于其它3组(P<0.05),见图3。
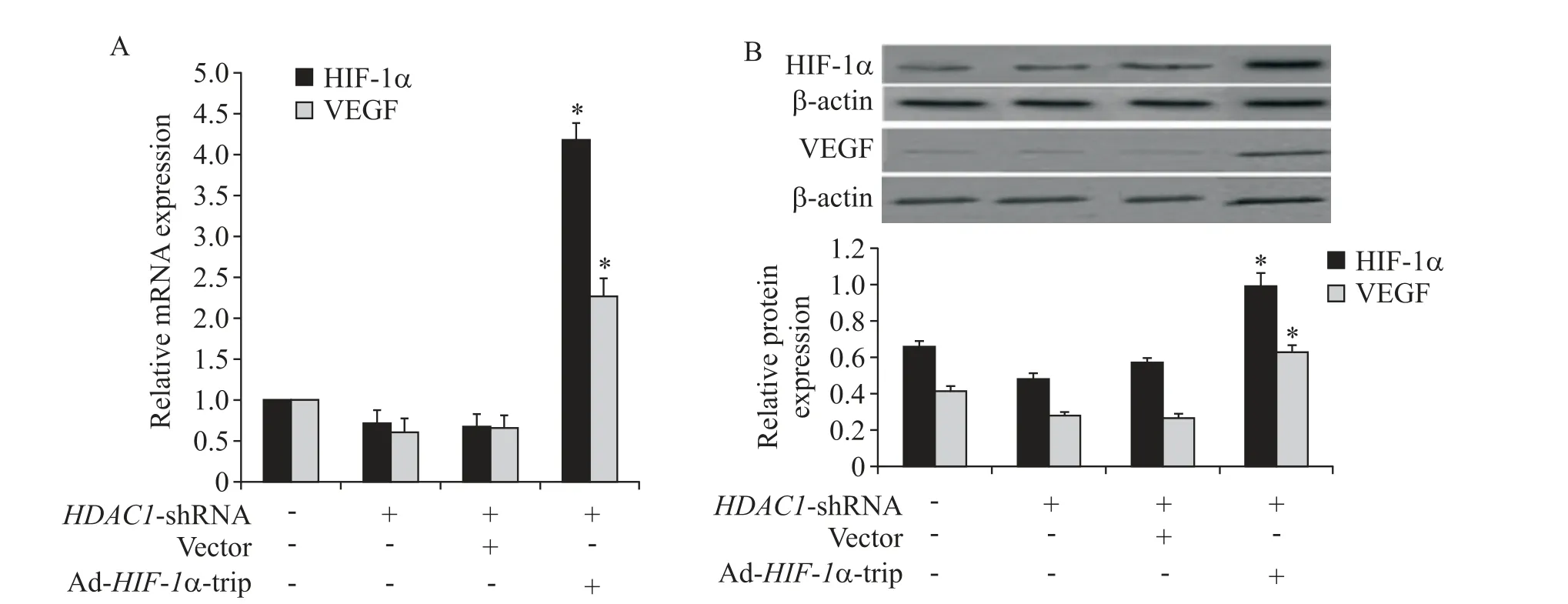
Figure 3. Detection of HIF-1α and VEGF expression. A:RT-qPCR results for HIF-1α and VEGF;B:Western blot results for HIF-1α and VEGF. Mean±SD. n=6.*P<0.05 vs vector+HDAC1-shRNA.图3 各组MSCs中HIF-1α及VEGF表达量的检测
讨 论
干细胞移植疗法仍然是目前治疗心脏疾病的研究中最有前景的治疗方法,众多的基础及临床研究证明MSCs移植治疗急性心肌梗死能够改善血供,实现心肌重建,最后达到改善心脏功能的目的[10]。然而,干细胞的向心肌细胞定向分化的能力以及在缺血缺氧环境中的存活能力有限,大大限制了这种移植治疗带来的获益。为了解决上述问题,学者们开始尝试导入外源基因,提高干细胞的定向分化能力。其中,我们在前期研究中已证实组蛋白乙酰化水平与大鼠MSCs向心肌细胞分化存在着密切关系,随着大鼠MSCs 向心肌样细胞分化,其HDAC1基因表达量逐渐下降,而且HDAC1基因敲除可以促进MSCs向心肌样细胞分化[3-4]。同时,也有学者证实HDAC1蛋白可以调节组蛋白乙酰化水平从而影响着干细胞系在体外向心肌细胞的诱导分化[2]。然而,HDAC 是通过乙酰化/去乙酰化循环而改变了染色质的空间构型,使得染色体结构变得致密,起到基因转录调控的作用。在此过程中,HDAC1基因沉默不仅激活了心肌特异性基因的转录,同时也使HIF-1α 蛋白乙酰化从而增加其降解,HIF-1α 蛋白表达的下降将影响着MSCs促血管新生的作用。因此,为了解决上述问题,我们用腺病毒转染的方法上调HIF-1α的表达。
HIF-1α 是血管新生的上游核心调控因子,能促进VEGF 等重要因子的转录,引起细胞对缺氧的一系列适应性反应,是血管生成的总开关基因,其表达的稳定性取决于其结构域中有氧依赖降解区第402和564 位点上的脯氨酸羧基化程度和C 末端转录激活区中第803 位点上天门冬酰胺的羟化水平[11-12]。而Ad-HIF-1α-trip 通过对上述三个位点进行联合突变,在保证HIF-1α完整性的基础上最大程度地提高其稳定性和转录活性。Li 等[9]证实,将三突变的HIF-1α基因通过腺病毒直接注射至心肌梗死周围区域,能显著增加缺血区域的新生血管密度,改善心功能。此外,也有研究表明,MSCs 移植后的存活率十分低下,而过表达HIF-1α可以通过调节AMPK 和mTOR 通路,有效提高MSCs 的移植后存活能力[13]。综上所述,通过三突变HIF-1α基因可以显著提高HIF-1α 表达量,增加VEGF 表达,对改善缺血组织血供发挥着重要作用。
在本课题组的前期研究中,HDAC1基因沉默已被证实可以促进MSCs向心肌样细胞分化;而在本研究中,我们通过嘌呤霉素的筛选获得了大鼠HDAC1基因沉默的MSCs 稳定细胞株,并更进一步通过Ad-HIF-1α-trip腺病毒感染上述细胞从而获得HDAC1基因沉默和HIF-1α过表达的MSCs,实现了在提高MSCs定向分化能力的同时,也成功上调了其HIF-1α的表达,增强了VEGF 的分泌能力,对MSCs 移植后促进局部血管新生、改善心脏血供更有帮助。然而,HDAC1基因沉默和HIF-1α过表达的MSCs 在体内的移植疗效仍有待下一步实验进行验证。此外,HDAC1基因沉默和HIF-1α基因过表达的MSCs 对血管新生影响有着良好的应用前景,其机制及作用通路仍需深入探讨。

