生长激素长效制剂的研究概况
杨云霞,任雅丽
作者单位:224000 盐城,江苏丰华生物制药有限公司
人生长激素(human growth hormone,hGH)是由脑垂体前叶中的生长激素细胞合成、存储和分泌的一种肽类激素,主要生理功能为促进身体各组织、器官及骨骼中受体细胞的蛋白质合成和脂肪分解,从而调节机体代谢和生长发育,是人体内最重要的促进生长的激素。生长激素不同于类固醇激素,不会产生糖皮质激素或性激素样的副作用[1]。
生长激素适应证广泛,最早于 1985年被 FDA 批准用于治疗儿童生长激素缺乏症(pediatric growth hormone deficiency,PGHD)和成人生长激素缺乏症(adult growth hormone deficiency,AGHD),至今获得批准用于十多种常规疾病和罕见病的治疗(表 1)。此外,还有黏多糖症、非酒精性脂肪肝、肥胖和甲状腺功能不足等多种潜在适应证在研。hGH 最主要的适应证是矮小症,据中华医学会儿科学分会内分泌遗传代谢学组统计,我国儿童矮小发病率约为3%,全国 4~15 岁矮小患儿总数约有 700 万人,以其中1/3 为儿童生长激素缺乏症计算,国内约有 200 万儿童需要用生长激素治疗。但是由于国民对 GHD 缺乏足够的认识,及每日注射给药依从性差等原因,我国每年接受合理治疗的患者不足 3 万人,治疗率极低。
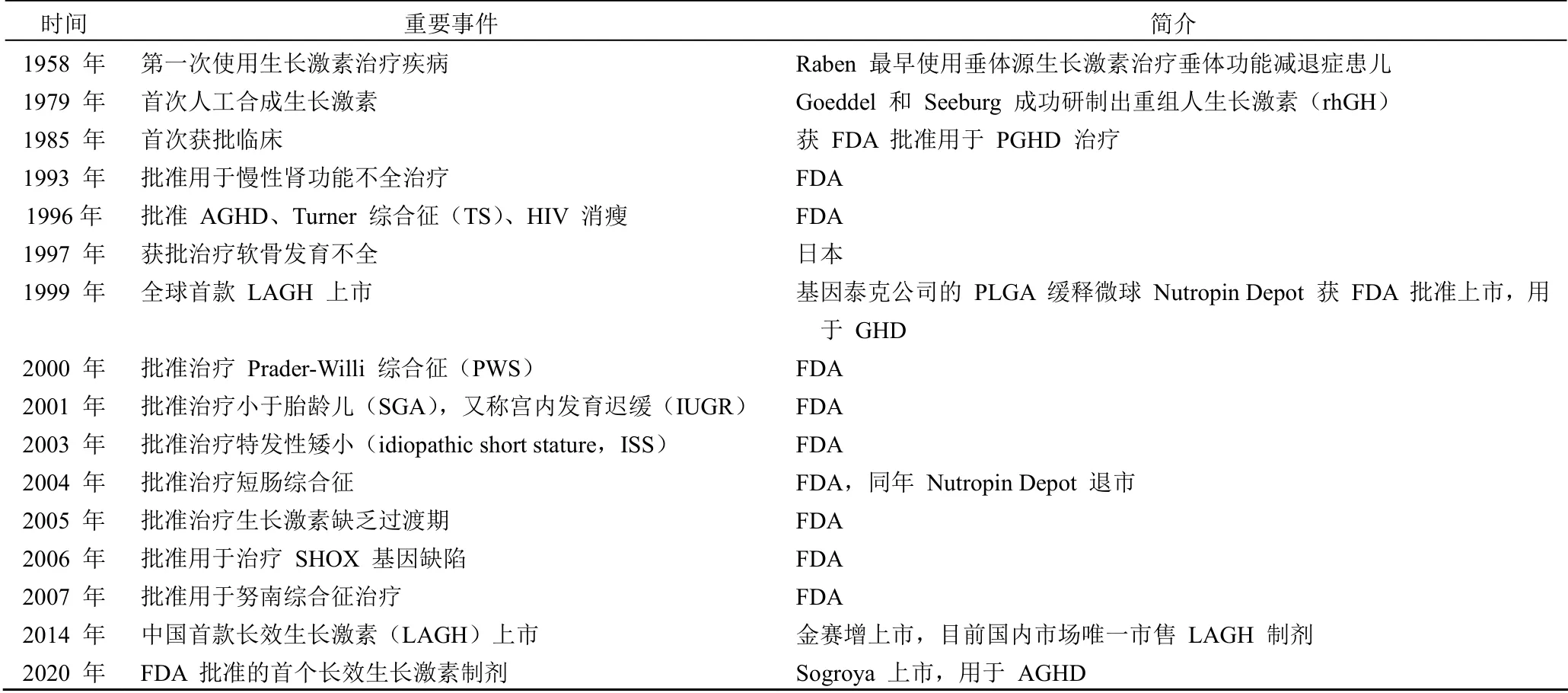
表1 生长激素时光轴
自 20世纪 50年代以来,生长激素的获得经历了尸源垂体提取、大肠杆菌合成、酵母菌合成、哺乳动物细胞重组DNA 技术合成、基因重组修饰合成等不同阶段[2]。迄今在全球多个国家已有三十多年的使用历史,未报道过用药相关严重不良反应(SAE),在全球多数发达国家被纳入医保。
1 作用机制
下丘脑-垂体-生长轴中各因子之间相互作用,共同完成对生长和代谢的调控。体内外的各种刺激作用于下丘脑,促进下丘脑分泌促生长激素释放激素(GH-releasing hormone,GHRH ) 和生长激素释放抑制因子( somatotropin release-inhibiting factor,SRIF),GHRH 和 SRIF 作用于脑垂体 GHRH 受体(GHRHR)和 SRIF 受体(SRIFR)启动细胞传导通路,调节 GH 合成和分泌,GH 调节 IGFs 的分泌,IGFs 对GH 的分泌具有负反馈调节作用[3],GH 和IGFs 的分泌调节见图 1。
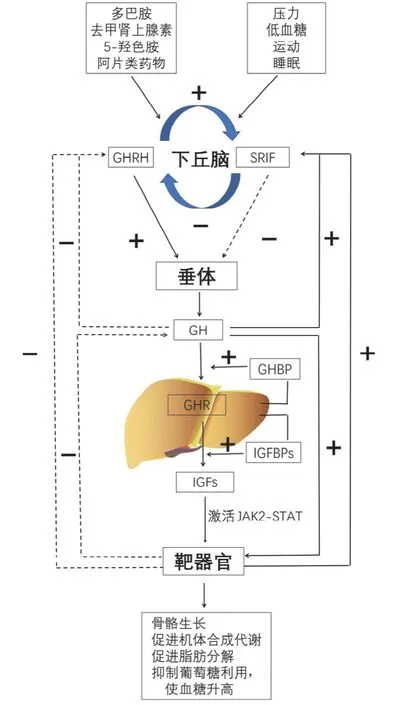
图1 GH 和 IGFs 分泌调节
通过基因工程技术合成的重组人生长激素(recombinant human growth hormone,rhGH)与人脑垂体正常分泌的生长激素结构和作用机制一致。GHR 先与 hGH 高亲和力的位点 1 结合,然后第二个 GHR 再与同一 hGH 上低亲和力的位点 2 结合,形成激素-受体复合物(GH-2GHR),激发JAK2 酪氨酸激酶信号通路,启动细胞核内的应答基因表达IGFs、IGFBP3 和 ALS(图 2)。ALS-IGFs-IGFBP3 形成三元络合物进入血管输送至靶器官,由蛋白酶除 IGFBP3和 ALS 释放出 IGFs,IGF 分为 IGF-I 和 IGF-II 两种类型。IGF-I 的产生更依赖于 GH,其促生长作用强,是儿童期的重要生长因子;IGF-II 的类胰岛素作用更强,对胎儿生长起重要作用[4-5]。IGF 与受体结合后通过多种信号通路发挥生理功能。
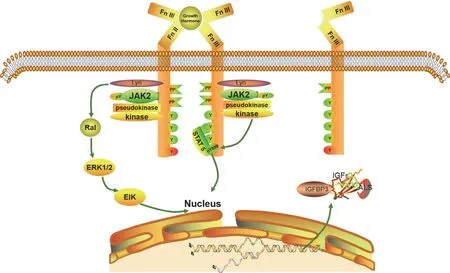
图2 GHR 结构图及信号转导途径
2 理化特性
hGH 基因位于 17 号染色体长臂,垂体可以分泌多种形式的 GH,通常所说的 hGH 是指分子量为 22 kD 的分子,由 191 个氨基酸组成,等电点 4.9,分子内有 4 个α-螺旋、2 个二硫键,为单链非糖化亲水性球蛋白[1,3,6],氨基酸序列和分子结构见图 3。
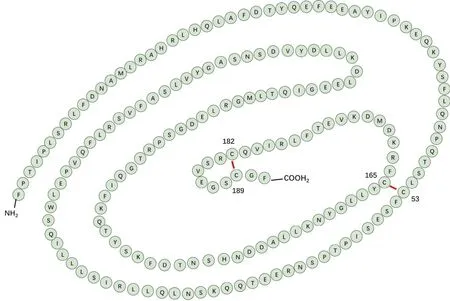
图3 hGH 结构图
3 研发现状
由于生长激素的分泌呈脉冲式,需达到一定血药浓度才能发挥疗效,为保证药效以及模拟人体内的分泌规律,患者需每天注射给药。长期、频繁注射给药极大地影响患者依从性、增加患者痛苦。据中华医学会儿科学分会统计,对常规rhGH 治疗的患者进行长期随访发现,治疗期 13% 的儿童患者会漏打一半以上的处方剂量,50% 以上的患者没有严格遵守治疗方案。而 LAGH 制剂能延长药物半衰期、降低注射频率、减少痛苦,可以有效提高患者依从性、降低医护成本[7]。
LAGH 制剂的常见修饰类型包括:微球、聚乙二醇化修饰、融合蛋白、hGH 衍生物等[7]。目前,全球处于临床在研状态的 LAGH 制剂有 11 个,其中 3 个已上市,2 个已递交上市申请,1 个退市,详细情况见表 2。

表2 国内外在研生长激素长效制剂
3.1 Nutropin Depot
基因泰克公司的 PLGA 缓释微球 Nutropin Depot,于1999年获 FDA 批准。Nutropin Depot 可以诱发 PGHD 儿童的追赶生长和正常骨骼成熟,不良事件(AE)主要为注射后疼痛,注射部位产生结节和红斑。由于存在难以大规模生产和 GH 突释现象,并且后续研究发现存在感染和蛋白质降解等问题,该产品在 2004年停产退市。
3.2 Eutropin Plus
Eutropin Plus(Declage,SR-hH,LB03002)是 LG 公司推出的微球 LAGH 制剂,由酵母菌表达,采用透明质酸技术制成的,用于 PGHD、TS、SGA 或 IUGR、ISS、PWS、儿童肾功能衰竭(Pediatric CRF),在中国获批适应证为PGHD、AGHD 和 TS。评估 Eutropin Plus 用于儿童 GHD、TS、CRF、SGA、ISS 和 PWS 长期安全性和有效性的一项开放、多中心、前瞻性和回顾性观察研究(NCT01604395),计划招募 600 例患者,该研究正在进行中。
3.3 金赛增
金赛增是由大肠杆菌表达的 PEG 化 rhGH,PEG 化增大了 hGH 有效体积,延长了药物在体内的滞留时间。回顾性研究 238 例 PGHD 的疗效表明,患儿给予 0.2 mg/(kg·w)金赛增或 0.067 mg/(kg·d) 短效生长激素赛增,治疗 3 个月后金赛增组生长速率增至 11.7 cm/年,赛增组生长速率增至8.4 cm/年;金赛增组血清 IGF-1 和 IGF-BP3 水平分别升至 627.3 ng/ml 和 10.5 μg/ml,赛增组血清 IGF-1 和IGF-BP3 水平分别升至 584.28 ng/ml 和 9.87 μg/ml,金赛增对 PGHD 患儿的疗效优于赛增,两者在短期疗效内均无副作用[8]。
3.4 Sogroya
诺和诺德的 Sogroya(Somapacitan)是 FDA 批准的首个 LAGH 制剂。Sogroya 由天然 hGH 修饰而来,分子式:C54H95N13O20S2,分子量 1310.5,主链中 GH 部分的半胱氨酸残基中的硫醇基被巯基乙醇替换,连接有包含带电荷接头、四唑和具有非共价白蛋白结合特性的脂肪酸部分的侧链(图 4),能够可逆地、广泛地(>99%)与内源性循环白蛋白结合。2020年10月在中国获批 IND,受理号为CXSL2000184、CXSL2000185。
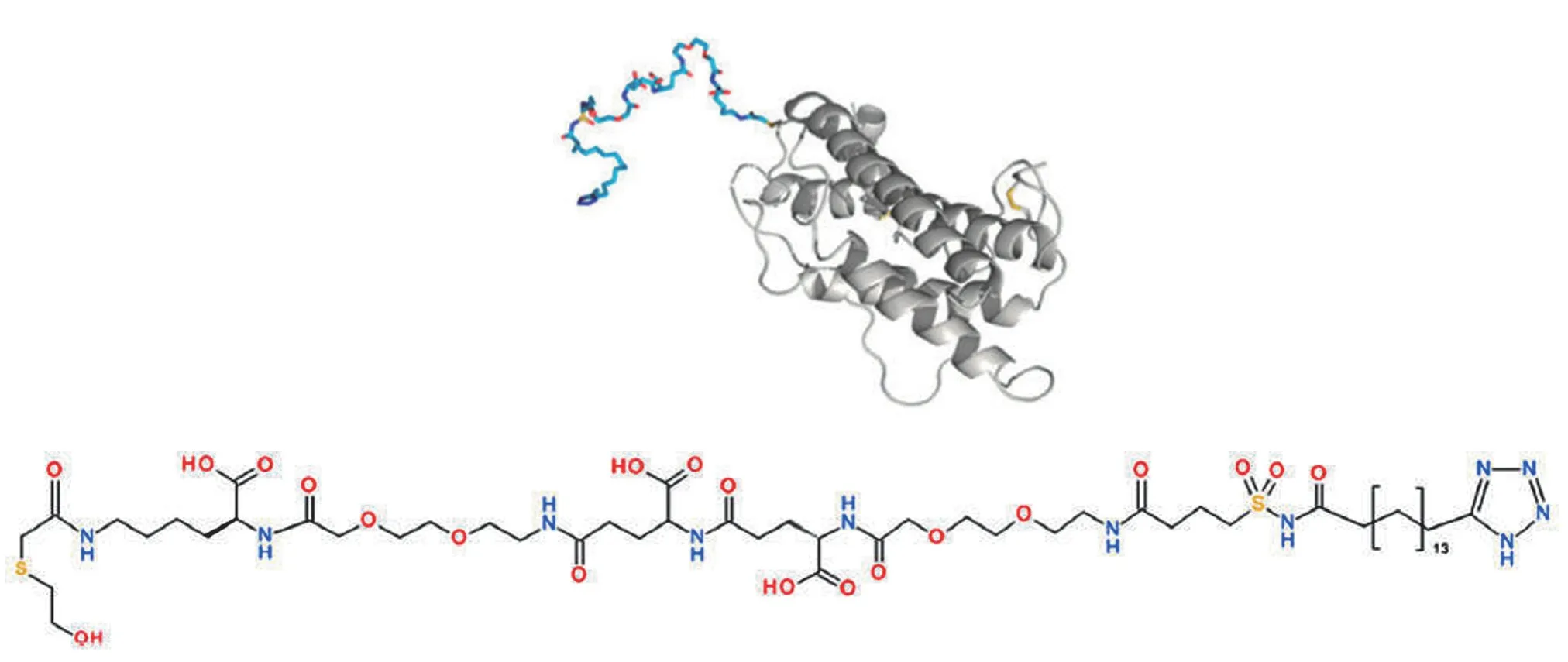
图4 Somapacitan 结构示意图[9]
Somapacitan III 期临床研究 REAL-1(NCT02229851)是一项国际多中心研究,在 301 例 AGHD 患者中,评估了治疗 35 周后与安慰剂相比,每周一次 Somapacitan 和每日一次 Somatropin 的疗效和安全性,基于该项研究结果,FDA 于 2020年9月获批其用于 AGHD。
Somapacitan II 期临床研究 REAL-3(NCT02616562)评估了每周一次 Somapacitan 相对于每日一次Norditropin治疗 26 周和 52 周的疗效和安全性。青春期前初治 PGHD患者随机分配,接受 Somapacitan 0.04、0.08、0.16 mg/(kg·w)或 Norditropin 0.034 mg/(kg·d) 治疗。结果表明,年化身高成长率(HV)Somapacitan 0.16 mg/(kg·w) 显著高于每日一次 Norditropin;3 种剂量水平 Somapacitan 的 HV 分别为7.8、9.7、11.5 cm/年,每日一次 Norditropin 的平均 HV 为10.0 cm/年;Somapacitan 在所有剂量下的耐受性良好,没有发现与临床相关的安全性或局部耐受性问题[10]。
3.5 TransCon
TransCon(lonapegsomatropin,ACP-001)是 Ascendis 公司在研的 LAGH,分子包括三部分:未经修饰的 hGH、惰性载体分子和将两者暂时连接起来的连接结构。其设计原理为载体分子可以保护 hGH,使 hGH 暂时失活并且不被人体清除,当注射至人体后,在生理条件的 pH 和体温下,有活性的、未经修饰的 hGH 以可控的方式释放出来。
TransCon 于 2019年10月和 2020年4月获得欧洲委员会(EC)和 FDA 治疗 GHD 的孤儿药认定。2020年6月,Ascendis 向 FDA 提交了 TransCon 治疗 PGHD 的BLA 申请。该产品在中国用于PGHD 的 III 期临床试验(CTR20200399)正在进行中,用于软骨发育不全(ACH)的 IND 申请于 2021年1月获中国 CDE 批准。
3.6 Somatrogon
辉瑞与 OPKO 联合开发的 Somatrogon(MOD-4032,PF-06836922),在天然 GH 的 N-末端连接了 1 个来自人绒毛膜促性腺激素(HCG)β 亚基的 CTP 拷贝,在 C-末端添加了 2 个上述 CTP 拷贝(图 5),CTP 可以有效延长半衰期。Somatrogon 在美国和欧盟均获得了用于治疗儿童和成人 GDH 的“孤儿药”资格。2021年1月在日本递交了新药申请(NDA);同期,FDA 也受理了其 BLA 申请。
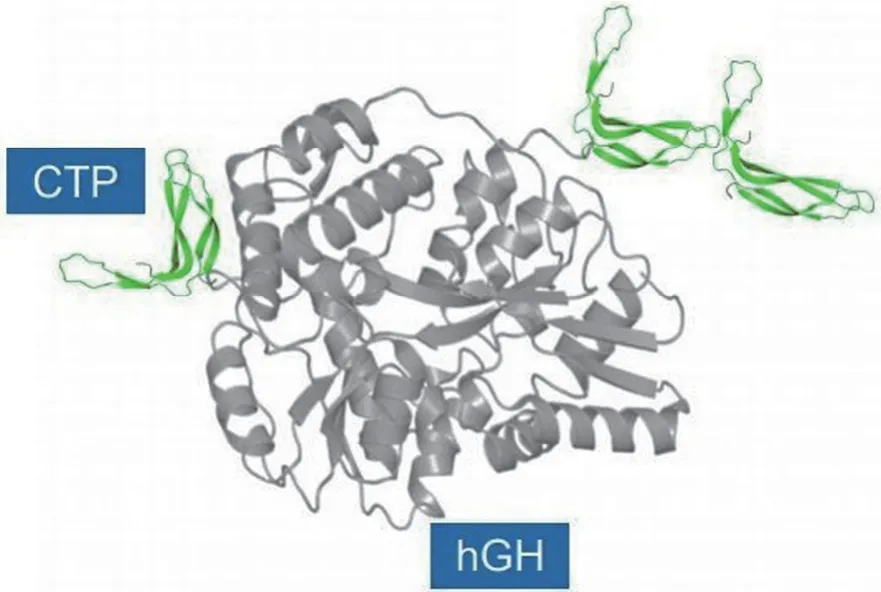
图5 Somatrogon 分子结构图
2020年6月OPKO 宣布Somatrogon III 期临床试验(NCT03874013)达到了其主要和次要目标,每周注射Somatrogon 治疗 PGDH 的有效性和安全性与每天注射一次的 Genotropin 相当。
Somatrogon 另外一项 III 期临床研究(NCT02968004),计划招募 224 名初治青春期前 PGDH 患者,2020年公布的结果表明,治疗 12 个月后每周一次的 Somatrogon(0.66 mg/kg)与每日 Genotropin 相比,Somatrogon 组的平均 HV 为 10.12 cm/年,Genotropin 组为 9.78 cm/年,并且耐受良好[11]。
3.7 HyTropin
韩国 Genexine 公司的 HyTropin(TJ101,GX-H9)为杂合 Fc(hyFc)和 rhGH 融合蛋白,分子量 103 kD。HyFc 由人 IgD 和 IgG4构成(图 6),HyFc 与 hGH 融合增加了 hGH 的分子量,减少了肾脏清除率从而增加了药物的半衰期;IgG4通过新生 Fc 受体介导的内吞和 Fc 融合蛋白的回收进一步延长了 HyTropin 半衰期。HyTropin在 2020年7月向中国 CDE 了递交 IND 申请(受理号为:JXSL2000137),目前处在临床 III 期准备阶段(CTR20202305)。
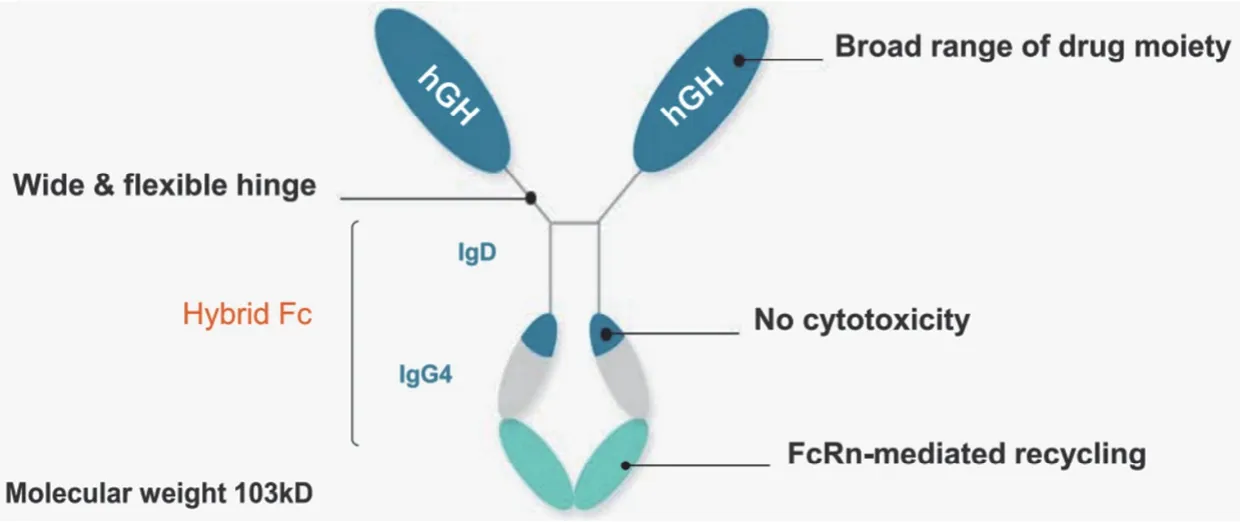
图6 HyTropin 分子结构[12]
HyTropin 第一个临床试验在 4 组健康受试者中进行,受试者随机给予 0.2、0.4、0.8、1.6 mg/kg HyTropin(n=6)或安慰剂(n=2)。研究表明,HyTropin 单剂量给药在0.2~1.6 mg/kg 的范围内均可耐受,没有发现安全隐患,不存在任何脂肪萎缩或抗药物抗体,t1/2在 69.2~138.0 h 之间,IGF-1 血清浓度以剂量依赖性方式增加[12]。
HyTropin 在 AGHD 患者进行的每周和每半个月一次的 II 期临床研究表明,12 周内接受最低剂量[0.1 mg/(kg·w)]HyTropin 的 AGHD 患者(n=11)与接受 6 μg/(kg·d)Genotropin 的患者(n=2),安全性和耐受性相似,没有报道意外的不良反应,HyTropin 具有每周和每半个月给药一次治疗 GHD 的潜力[13]。
在 PGDH 患儿进行的临床研究,24 例患儿分别接受0.8 mg/(kg·w)、1.2 mg/(kg·w)、2.4 mg/kg·半月、GENO/d 治疗,HV 分别为 10.7、15.6、12.4、12.7 cm/年[14]。
3.8 Somavaratan
Versartis 公司 Somavaratan(VRS-317,XTEN1-rhGHXTEN2),是大肠杆菌表达的融合蛋白,分子量119 kD,通过在 hGH N-端和 C-端连接 XTEN 氨基酸序列降低受体结合,从而减小受体介导的清除率[15]。
Somavaratan 治疗 AGHD 的 II 期临床试验(NCT02719990),每月给药两次,未达到非劣于日常治疗的主要终点;在日本 PGHD 患者进行的开放、长期安全性研究 II/III 期临床研究(NCT03145831),3.5 mg/kg 每月给药 2 次,也未达到非劣于日常治疗的主要终点指标。
3.9 Albutropin
TEVA 公司 Albutropin(TV-1106)为 hGH 与 HAS 融合蛋白,在 N-末端融合了 HSA。在动物体内的药代动力学和药效学研究结果表明,猴皮下给药 0.3 mg/kg 与 rhGH相比,Albutropin 血浆半衰期延长了 6 倍、清除率降低8 倍,连续 7 天 rhGH(0.3 mg/kg)与 Albutropin 单次给药(4 mg/kg)诱导增加的 IGF-1 水平相当[16]。在 65 例初治早产 PGHD 患儿进行的 II 期安全性和剂量探索研究(NCT02092077),给药剂量 0.554、0.924、1.20 mg/kg,阳性对照 Somatropin 0.033 mg/(kg·d),目前该研究由于商业决策被终止。
3.10 安苏明
安科生物 LAGH 制剂安苏明为 PEG 化长效重组人生长激素水针,用于 PGHD,于 2011年10月获临床批件,目前已完成 III 期临床试验,处于上市申报准备阶段。
3.11 YPEG-GH
宝特生物开发的 LAGH 制剂 YPEG-GH,是 Y 型分支 PEG 化重组人生长激素,该项技术是将 PEG 结构的两条支链分别通过稳定性更强的酰胺键和 C-N 键与母核连接,具有较好的稳定性以及支链不易水解脱落等优势。目前正在进行 II/III 期临床试验(CTR20190901)。
4 市售 LAGH 有效性和安全性
目前,多种 LAGH 制剂处于开发的各个阶段,其中Declage 上市已有 14年,未报道用药相关的 SAE。回顾有关 LAGH 制剂的最新文献和会议报道,LAGH 的有效性初步得到了证实,年化身高增长率方面和诱导 IGF-1 水平升高的能力均非劣效于每日传统生长激素治疗,安全性方面未见报道与 LAGH 用药相关的重大 SAE。但是不同人群对不同 LAGH 治疗的耐受性和疗效差异尚需更多的临床数据证实,目前市售 LAGH 的有效性和安全性总结见表 3。

表3 市售 LAGH 有效性和安全性
5 展望
开发 LAGH 的主要目的之一是提高患者用药依从性,目前已上市的 LAGH 制剂使得 hGH 注射频率从每天一次减少到每周或每两周一次,有效性和安全性得到初步证实。目前大多数 LAGH 制剂处于临床试验阶段,国内目前仅有金赛增一款 LAGH 制剂在售,随着更多 LAGH 获批进入临床,将带来长效生长激素治疗的更多选择,民众用药的可及性和选择性将大大增加。
但是,LAGH 制剂不同种群的用药剂量调整和耐受性等问题尚需更多临床数据支持,长期有效性和安全性有待进一步研究。在 LAGH 制剂研发和临床应用中,应该重点关注以下问题:①不同表达体系和生产条件生产的 LAGH 制剂的高级分子结构差异;②对 LAGH 高级结构进行解析,分析其高级结构与药物活性和免疫原性的关系;③微球缓释剂类型的 LAGH 要关注是否存在 GH 突释现象,以及注射部位疼痛等不良反应;④PEG 和融合蛋白等修饰方法,不同程度地增加了 GH 分子量,要关注其注射入人体后的免疫原性,对药物抗体进行密切监控;⑤LAGH 治疗期间,设置合理的时间点检测 IGF-1 水平,根据治疗效果合理调整用药方案。随着生物制药技术的进步和临床研究成果的积累,LAGH 制剂的研发和应用必将越来越广泛,惠及需要生长激素长期治疗患者尤其是儿童患者。

