错配修复功能缺陷的结直肠癌术后患者预后影响因素的分析
黄庆?邹旻红?蒋叶?李旺林?曹杰
【摘要】目的 探討错配修复功能缺陷(dMMR)的结直肠癌术后患者错配修复(MMR)蛋白表达情况和预后影响因素,分析辅助化学治疗(化疗)对Ⅱ、Ⅲ期dMMR结直肠癌预后的影响。方法 回顾性分析dMMR结直肠癌根治性手术病例106例,分析其MMR蛋白(包括MLH1、MSH2、MSH6、PMS2)缺失的情况。单因素和多因素Cox分析dMMR结直肠癌术后患者的无病生存期(DFS)和总生存期(OS)预后影响因素,Kaplan-Meier法分析Ⅱ、Ⅲ期dMMR结直肠癌化疗组与无化疗组的差异。结果 MLH1/PMS2蛋白缺失率为45%,MSH2/MSH6蛋白缺失率为18%,单个MLH1蛋白的缺失率为11%,单个MSH6蛋白的缺失率为9%,单个PMS2蛋白的缺失率为12%。单因素Cox分析显示,术前癌胚抗原(CEA)≥5 ng/ml、直肠、T4、N1、N2、神经侵犯、脉管侵犯和淋巴结获取数量< 12枚是dMMR结直肠癌患者DFS的危险因素;术前CEA≥5 ng/ml、术前糖链抗原199(CA199)≥34 U/ml、直肠、T4、N1、N2和淋巴结获取数量< 12枚是dMMR结直肠癌患者OS的危险因素。多因素Cox分析显示术前CEA≥5 ng/ml[HR = 2.68(1.08 ~ 6.63),P = 0.034]、 N1[HR = 2.94(1.12 ~ 7.73),P = 0.028]、 N2[HR = 9.31(2.49 ~ 34.77),P = 0.001]和淋巴结获取数量< 12枚[HR = 3.97(1.66 ~ 9.50),P = 0.002]是dMMR结直肠癌患者DFS的独立危险因素;N1[HR = 6.64(2.25 ~ 19.64),P = 0.001]、 N2[HR = 9.68(1.92 ~ 48.96,P = 0.006)]和淋巴结获取数量< 12枚[HR = 6.36(2.28 ~ 17.73),P < 0.001]是dMMR结直肠癌患者OS的独立危险因素。Ⅱ、Ⅲ期dMMR结直肠癌化疗组与无化疗组的DFS和OS比较差异无统计学意义(P均> 0.05)。结论 术前CEA≥5 ng/ml是dMMR结直肠癌患者DFS的独立危险因素;N1、N2和淋巴结获取数量< 12枚是dMMR结直肠癌患者DFS和OS的独立危险因素。辅助化疗不影响Ⅱ、Ⅲ期dMMR结直肠癌的预后。
【关键词】结直肠癌;错配修复功能缺陷;预后;根治性手术
Analysis of prognostic factors in colorectal cancer patients with mismatch repair deficiency after
radical surgery Huang Qing, Zou Minhong, Jiang Ye, Li Wanglin, Cao Jie. Department of General Surgery, Guangzhou First Peoples Hospital, the Second Affiliated Hospital of South China University of Technology, Guangzhou 510180, China
Corresponding author, Zou Minhong, E-mail: 375578617@ qq. com
【Abstract】Objective To investigate the MMR protein expression and the prognostic factors of patients with mismatch repair-deficient (dMMR) colorectal cancer (CRC) after radical surgery and to evaluate the effect of adjuvant chemotherapy on the clinical prognosis of stage Ⅱ and Ⅲ dMMR CRC patients. Methods A total of 106 patients with dMMR CRC undergoing radical surgery were enrolled and MMR proteins deficiency were analyzed. Prognostic factors for disease-free survival (DFS) and overall survival (OS) of patients with dMMR CRC after surgery were identified by univariate and multivariate Cox regression analyses. DFS and OS of stage Ⅱ and Ⅲ dMMR CRC patients were statistically compared between the chemotherapy and non-chemotherapy groups by Kaplan-Meier survival analysis. Results The MLH1/PMS2 protein deletion rate was 45%, the MSH2/MSH6 protein deletion rate was 18%, the single MLH1 protein deletion rate was 11%, the single MSH6 protein deletion rate was 9%, and the single PMS2 protein deletion rate was 12%. Univariate Cox regression analysis showed that preoperative CEA level harvested≥5 ng/ml, rectum, T4, N1, N2, nerve invasion, vascular invasion, and the number of lymph nodes harvested < 12 were the risk factors for DFS in patients with dMMR CRC. Preoperative CEA level harvested≥5 ng/ml, preoperative CA199 level harvested≥34 U/ml, rectum, T4, N1, N2, and the number of lymph nodes harvested <12 were the risk factors for OS in dMMR CRC patients. Multivariate Cox regression analysis demonstrated that preoperative CEA level harvested ≥5 ng/ml (HR = 2.68(1.08 ~ 6.63),P = 0.034), N1 (HR = 2.94(1.12 ~ 7.73),P = 0.028), N2 (HR = 9.31(2.49 ~ 34.77),P = 0.001), and the number of lymph node harvested < 12 (HR = 3.97(1.66 ~ 9.50),P = 0.002) were the independent risk factors for DFS in dMMR CRC patients. N1 (HR = 6.64(2.25 ~ 19.64),P = 0.001), N2 (HR = 9.68(1.92 ~ 48.96),P = 0.006), and the number of lymph nodes harvested <12 (HR = 6.36(2.28 ~ 17.73),P < 0.001) were the independent risk factors for OS in dMMR CRC patients. DFS and OS of stage Ⅱ and Ⅲ dMMR CRC patients did not significantly differ between the chemotherapy and non-chemotherapy groups(all P > 0.05) . Conclusions Preoperative CEA level harvested≥5 ng/ml is an independent risk factor for DFS in patients with dMMR colorectal cancer. N1, N2, and the number of lymph nodes harvested <12 are the independent risk factors for DFS and OS in patients with dMMR CRC. Adjuvant chemotherapy does not affect the clinical prognosis of patients with stage II and III dMMR CRC.
【Key words】Colorectal cancer;Mismatch repair deficiency;Prognosis;Radical surgery
结直肠癌是最常见的恶性肿瘤之一,我国结直肠癌发病率、病死率在全部恶性肿瘤中分别位居第3及第5位[1]。随着分子生物学的发展,结直肠癌的诊治逐渐要求个体化精准治疗;在结直肠癌的诊治当中,错配修复(MMR)蛋白的状态至关重要。研究认为10% ~ 20%的结直肠癌的发病基础为微卫星不稳定(MSI),即由MMR缺陷造成,MMR蛋白状态也直接影响结直肠癌的预后。美国国立综合癌症网络指南和中国临床肿瘤学会指南均建议结肠癌患者行免疫组织化学检测MMR基因相关蛋白(MLH1、MSH2、MSH6和PMS2)的表达,如果任何1个蛋白表达缺失为错配修复功能缺陷(dMMR),dMMR相当于高度微卫星不稳定(MSI-H);所有4种蛋白表达均阳性为错配修复功能完整(pMMR),pMMR相当于低度微卫星稳定或微卫星稳定。
研究显示,在Ⅰ、Ⅱ期结直肠癌中,MSI-H dMMR患者有更好的预后,而Ⅲ期结直肠癌中,MSI-H dMMR患者预后仍然存在争议,部分研究认为Ⅲ期结直肠癌患者MSI-H dMMR仍是预后良好的因素,而也有研究显示在Ⅲ期结肠癌中MMR状态与预后无关[2-4]。既往的研究大多关注结直肠癌MSI-H dMMR表型与其他表型的对比,很少关注MSI-H dMMR结直肠癌本身的预后因素;再者,Ⅱ、Ⅲ期MSI-H dMMR结直肠癌患者是否需要行辅助化学治疗(化疗)仍然存在争议。基于此,我们收集106例dMMR结直肠癌病例,研究其预后影响因素和辅助化疗对Ⅱ、Ⅲ期dMMR结直肠癌的影响。
对象与方法
一、研究对象
采用回顾性分析,收集广州市第一人民医院(华南理工大学附属第二医院)2014至2018年行根治性手术后病理诊断为dMMR结直肠癌患者共106例。纳入标准:①诊断为原发性结直肠癌患者;②行根治性手术患者;③术后病理诊断MMR蛋白(MLH1、MSH2、MSH6和PMS2)任何1个蛋白或多个蛋白表达缺失。排除标准:①同时或既往合并其他恶性肿瘤患者;②术前诊断有远处或腹膜转移患者;③术后病理诊断有腹膜转移患者;④合并同时性结直肠多发癌;⑤随访或收集数据不完整的患者。
二、病理诊断标准
常规免疫组织化学方法检测MLH1、MSH2、MSH6 和 PMS2均定位于细胞核,由有经验的2名病理科医师判定阴性或阳性,将4种MMR蛋白中的1种或多种表达缺失(阴性)判定为dMMR。病理分期:患者采用美国癌症联合委员会AJCC分期(第七版)/国际抗癌联盟(UICC)TNM分期进行术后分期。
三、观察指标
收集患者年龄、性别、基础疾病(高血压病史、糖尿病病史、冠状动脉粥样硬化性心脏病病史)、糖类抗原199(CA199)水平、癌胚抗原(CEA)水平、肿瘤位置、手术方式(腹腔镜和开放)、合并器官切除、术后并发症、肿瘤大小、病理类型、分化程度、T分期、N分期、TNM分期、神经侵犯、脉管侵犯、术后淋巴结获取数量和是否行辅助化疗等指标。
四、随访
采用门诊复查和电话随访相结合的方式进行随访。手术后复查5年,前2年内每3个月随访1次,后3年每年随访1次。随访内容包括:体格检查(包括直肠指诊)、血CEA和CA199、胸部X线、腹部彩色多普勒超声(彩超)及肠镜、胸腹部CT、盆腔MRI等检查。复查结果异常时进一步腹部MRI或骨的放射性核素CT检查,必要时行PET/CT检查[5]。随访终点為发现患者死亡,随访至2021年2月,中位随访时间为54个月。
五、统计学处理
应用SPSS 26.0进行分析。正态分布的计量资料用表示,无病生存期(DFS)和总生存期(OS)的生存曲线采用Kaplan-Meier法绘制,生存曲线的比较采用log-rank检验。预后因素分析使用Cox单因素分析,当P值 < 0.05时纳入多因素Cox分析(Forward: LR法),结果以风险比(HR)值、95%CI、 P值表示。P < 0.05为差异有统计学意义。
结果
一、dMMR结直肠癌的基线资料
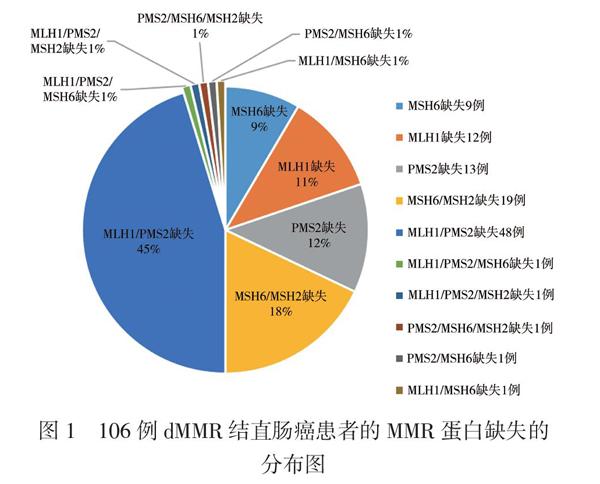
我们收集了106例病理诊断为dMMR的结直肠癌患者,患者术前未发现转移灶,术中没有发现腹膜转移,术后根据指南建议行化疗,部分患者未行化疗。106例患者中男60例、女46例;年龄(60.73±15.69)岁,≥65岁46例, < 65岁60例;术前CEA≥5 ng/ml 39例;术前CA199≥34 U/ml 25例;合并基础疾病(高血压病史、糖尿病病史、冠状动脉粥样硬化性心脏病病史)24例;升结肠癌48例,横结肠癌14例,降结肠癌及乙状结肠癌22例,直肠癌22例;行腹腔镜手术68例,行开放手术38例;联合器官切除5例,分别为联合切除胆囊、膀胱,小肠和胰腺、十二指肠、子宫各1例;术后出现并发症12例,其中伤口愈合不良4例,肠梗阻3例,肠瘘1例,直肠阴道瘘1例,术后出血1例,肺炎1例,晕厥1例;肿瘤大小≥5 cm 49例, < 5 cm 57例;T1分期2例,T2分期13例,T3分期51例,T4分期40例;N0分期76例,N1分期26例,N2分期4例;TNMⅠ期14例,Ⅱ期62例,Ⅲ期30例;15例患者有脉管侵犯;17例患者有神经侵犯;术后淋巴结获取数量≥12枚76例, < 12枚30例;黏液腺癌患者6例,含黏液成分的癌16例,腺癌84例;低分化腺癌10例,中分化腺癌76例,高分化腺癌4例,未定分化的癌16例(包括黏液腺癌);行化疗患者56例,未行化疗50例。106例患者MMR蛋白表达情况,MLH1/PMS2缺失率为45%,MSH2/MSH6缺失率为18%,单个MLH1蛋白的缺失率为11%,单个MSH6蛋白的缺失率为9%,单个PMS2蛋白的缺失率为12%,见图1。
二、dMMR結直肠癌的预后影响因素
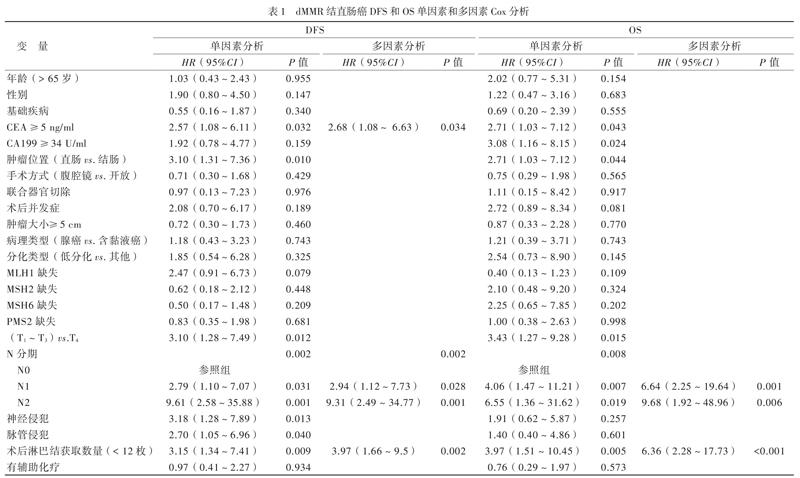
单因素Cox分析显示术前CEA≥5 ng/ml、直肠、T4、N1、N2、神经侵犯、脉管侵犯和术后淋巴结获取数量< 12枚是dMMR结直肠癌患者DFS的危险因素;多因素Cox分析显示术前CEA≥5 ng/ml、N1、N2和术后淋巴结获取数量< 12枚是dMMR结直肠癌患者DFS的独立危险因素,见表1。
单因素Cox分析显示术前CEA≥5 ng/ml、术前CA199≥34 U/ml、直肠、T4、N1、N2、和术后淋巴结获取数量< 12枚是dMMR结直肠癌患者OS的危险因素;多因素Cox分析显示N1、N2和术后淋巴结获取数量< 12枚是dMMR结直肠癌患者OS的独立危险因素,见表1。
三、辅助化疗对Ⅱ、Ⅲ期dMMR结直肠癌的影响
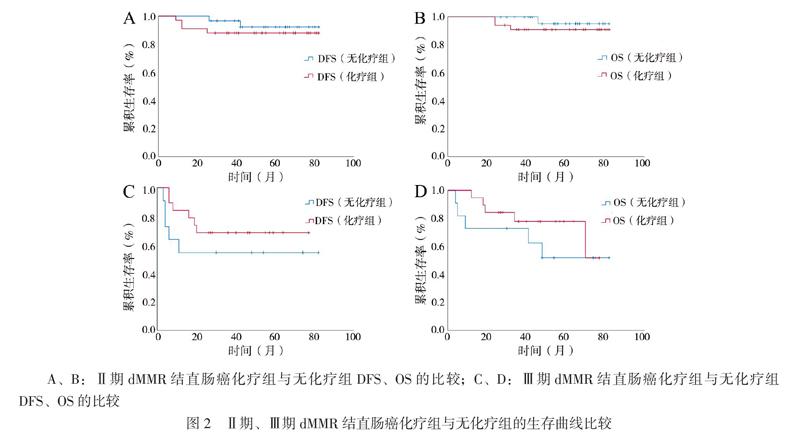
Ⅱ期dMMR结直肠癌化疗组与无化疗组DFS比较无统计学差异(log-rank检验χ2值 = 0.543,P = 0.461);Ⅱ期dMMR结直肠癌化疗组与无化疗组OS比较差异无统计学意义(log-rank检验χ2 = 0.756,P = 0.385)。Ⅲ期dMMR结直肠癌化疗组与无化疗组DFS比较差异无统计学意义(log-rank检验χ2值 = 1.125,P = 0.298);Ⅲ期dMMR结直肠癌化疗组与无化疗组OS比较差异无统计学意义(log-rank检验χ2值 = 0.803,P = 0.370),见图2。
讨论
MMR是细胞DNA在复制过程中选择性移除整合了错误核苷酸的新生DNA,防止子代细胞出现基因突变的过程。MMR的产物是MMR蛋白,包括MLH1、MLH3、MSH2、MSH3、MSH6、PMS1 和PMS2等。结直肠癌的MMR蛋白检测主要为MLH1、MSH2、MSH6 和PMS2,通常使用免疫组化检测任何一个或多个蛋白缺失(阴性)则诊断为dMMR。错配修复蛋白家族具有一些基本特征,由两个错配修复功能的复合体构成;MLH1和PMS2是一个复合体,MSH2和MSH6是一个复合体,其中MLH1和MSH2是两个复合体内的主要功能蛋白。大部分散发性dMMR结直肠癌(约80%)是由MLH1基因启动子的甲基化引起的,而超过70%的遗传病例与MLH1和MSH2基因的种系突变有关[6]。本研究调查的数据中3例有家族性遗传倾向。我们的数据也显示MLH1/PMS2缺失率为45%,MSH2/MSH6缺失率为18%,单个MLH1蛋白的缺失率为11%,单个MSH6蛋白的缺失率为9%,单个PMS2蛋白的缺失率为12%,这与既往的研究类似[7]。同时,我们发现4种MMR蛋白的状态都不是dMMR结直肠癌的预后影响因素。
研究认为大约有10% ~ 20%的结直肠癌的发病基础为MSI / dMMR,dMMR结直肠癌的预后比pMMR结直肠癌更好[2-3, 8]。本研究显示dMMR结直肠癌更好发于右半结肠,直肠癌是预后不良的一个危险因素。淋巴结转移N1、N2是dMMR结直肠癌患者DFS和OS的独立危险因素,表明Ⅲ期dMMR结直肠癌预后较Ⅰ和Ⅱ期更差。NCCN指南规定Ⅱ期结直肠癌术后淋巴结获取数量< 12枚为高危因素,我们的研究也显示术后淋巴结获取数量< 12枚是dMMR结直肠癌患者DFS和OS的独立危险因素。我们还发现术前CEA≥5 ng/ml是dMMR结直肠癌患者DFS的独立危险因素,在dMMR结直肠癌术前CEA≥5 ng/ml提示预后较差,我们查阅相关文献未找到类似的报道。我们的研究提示在dMMR结直肠癌患者治疗过程中,如果患者有这些危险因素可以考虑密切复查,或调整辅助治疗方案,比如联合使用靶向或免疫治疗。
结直肠癌指南推荐Ⅲ期和高危Ⅱ期的结直肠癌行术后辅助化疗,然而鉴于dMMR结直肠癌对化疗敏感性较差(主要为氟尿嘧啶类),所以辅助化疗对dMMR 结直肠癌的作用存在争议,尤其是Ⅱ期患者的辅助化疗争议较大[9]。对于高危Ⅱ期MSI-H/dMMR结直肠癌患者,目前NCCN指南建议患者单纯观察,而中国临床肿瘤学会指南则建议此类患者行联合化疗[10]。对于Ⅲ期dMMR结直肠癌,尽管指南推荐辅助化疗,但研究显示辅助化疗对Ⅲ期dMMR结直肠癌的作用仍然存在争议。目前大部分研究支持氟尿嘧啶单药对Ⅲ期dMMR结直肠癌辅助治疗不获益;而奥沙利铂在dMMR情况下并不影响其与DNA形成螯合物来发挥抗肿瘤作用,同时有研究关注Ⅲ期dMMR 结直肠癌可能需要将靶向治疗和免疫治疗作为一线治疗[11-14]。本研究的辅助化疗方案都为氟尿嘧啶为基础的化疗,为卡培他滨单药、XELOX或mFOLFOX方案,因此本研究结果显示Ⅱ期、Ⅲ期dMMR结直肠癌的化疗组与无化疗组DFS、OS差异无统计学意义,显示化疗并未影响其预后。遗憾的是因为病例数量有限,深入分层研究比较困难,需要以后进一步的深入研究。
我们的研究也存在以下不足,本研究为回顾性研究,可能存在偏倚;同时因为我们收集的病例只用免疫组化检测MMR蛋白,未使用PCR检测MSI状态,可能会纳入极少部分不是MSI-H表型的患者(大部分研究显示5%以下)。
综上所述,术前CEA≥5 ng/ml是dMMR结直肠癌患者DFS的独立危险因素;N1、N2和术后淋巴结获取数量< 12枚是dMMR结直肠癌患者DFS和OS的独立危险因素。辅助化疗不影响Ⅱ、Ⅲ期dMMR结直肠癌的预后。
参考文献
[1] 中国结直肠癌诊疗规范(2020年版)专家组.国家卫生健康委员会中国结直肠癌诊疗规范(2020年版). 中华胃肠外科杂志,2020,23(6):521-540.
[2] Deng Z, Qin Y, Wang J, Wang G, Lang X, Jiang J, Xie K, Zhang W, Xu H, Shu Y, Zhang Y. Prognostic and predictive role of DNA mismatch repair status in stageⅡ-Ⅲ colorectal cancer: a systematic review and meta-analysis. Clin Genet,2020,97(1):25-38.
[3] Sinicrope FA, Shi Q, Allegra CJ, Smyrk TC, Thibodeau SN, Goldberg RM, Meyers JP, Pogue-Geile KL, Yothers G, Sargent DJ, Alberts SR. Association of DNA mismatch repair and mutations in BRAF and KRAS with survival after recurrence in stage iii colon cancers : a secondary analysis of 2 randomized clinical trials. JAMA Oncol,2017,3(4):472-480.
[4] Sinicrope FA, Mahoney MR, Smyrk TC, Thibodeau SN, Warren RS, Bertagnolli MM, Nelson GD, Goldberg RM, Sargent DJ, Alberts SR. Prognostic impact of deficient DNA mismatch repair in patients with stage Ⅲ colon cancer from a randomized trial of FOLFOX-based adjuvant chemotherapy. J Clin Oncol,2013,31(29):3664-3672.
[5] 黄庆,邹旻红,蒋叶,李旺林,曹杰. 结直肠黏液腺癌术后患者的预后影响因素分析. 新医学,2021,52(1):26-31.
[6] André T, Shiu KK, Kim TW, Jensen BV, Jensen LH, Punt C, Smith D, Garcia-Carbonero R, Benavides M, Gibbs P, de la Fouchardiere C, Rivera F, Elez E, Bendell J, Le DT, Yoshino T, Van Cutsem E, Yang P, Farooqui MZH, Marinello P, Diaz LA Jr;KEYNOTE-177 Investigators. Pembrolizumab in Microsatellite-Instability-High Advanced Colorectal Cancer. N Engl J Med,2020,383(23):2207-2218.
[7] Chen L, Chen G, Zheng X, Chen Y. Expression status of four mismatch repair proteins in patients with colorectal cancer: clinical significance in 1238 cases. Int J Clin Exp Pathol,2019,12(10):3685-3699.
[8] Guo TA, Wu YC, Tan C, Jin YT, Sheng WQ, Cai SJ, Liu FQ, Xu Y. Clinicopathologic features and prognostic value of KRAS, NRAS and BRAF mutations and DNA mismatch repair status: A single-center retrospective study of 1,834 Chinese patients with Stage I-IV colorectal cancer. Int J Cancer,2019,145(6):1625-1634.
[9] 梁承華,郑晓明,张亚琴,雷普润,蔡梓凯,魏波. 含奥沙利铂化学治疗方案对Ⅱ期结直肠癌患者肝纤维化的影响. 新医学,2019,50(6):427-431.
[10] 张琪,李健,沈琳,王晰程. 结直肠癌与微卫星不稳定的十个临床问题. 肿瘤综合治疗电子杂志,2020,6(3):75-84.
[11] Sinicrope FA, Foster NR, Thibodeau SN, Marsoni S, Monges G, Labianca R, Kim GP, Yothers G, Allegra C, Moore MJ, Gallinger S, Sargent DJ. DNA mismatch repair status and colon cancer recurrence and survival in clinical trials of 5-fluorouracil-based adjuvant therapy. J Natl Cancer Inst,2011,103(11):863-875.
[12] Vaisman A, Varchenko M, Umar A, Kunkel TA, Risinger JI, Barrett JC, Hamilton TC, Chaney SG. The role of hMLH1, hMSH3, and hMSH6 defects in cisplatin and oxaliplatin resistance: correlation with replicative bypass of platinum-DNA adducts. Cancer Res,1998,58(16):3579-3585.
[13] Innocenti F, Ou FS, Qu X, Zemla TJ, Niedzwiecki D, Tam R, Mahajan S, Goldberg RM, Bertagnolli MM, Blanke CD, Sanoff H, Atkins J, Polite B, Venook AP, Lenz HJ, Kabbarah O. Mutational analysis of patients with colorectal cancer in CALGB/SWOG 80405 identifies new roles of microsatellite instability and tumor mutational burden for patient outcome. J Clin Oncol,2019,37(14):1217-1227.
[14] Chalabi M, Fanchi LF, Dijkstra KK, Van den Berg JG, Aalbers AG, Sikorska K, Lopez-Yurda M, Grootscholten C, Beets GL, Snaebjornsson P, Maas M, Mertz M, Veninga V, Bounova G, Broeks A, Beets-Tan RG, de Wijkerslooth TR, van Lent AU, Marsman HA, Nuijten E, Kok NF, Kuiper M, Verbeek WH, Kok M, Van Leerdam ME, Schumacher TN, Voest EE, Haanen JB. Neoadjuvant immunotherapy leads to pathological responses in MMR-proficient and MMR-deficient early-stage colon cancers. Nat Med,2020,26(4):566-576.
(收稿日期:2021-03-05)
(本文编辑:杨江瑜)

