自体脐血造血干细胞移植治疗儿童获得性再生障碍性贫血三例并文献复习
詹丽萍?阙丽萍?陈晗?吴正宙?刘典典?王开美?徐宏贵?方建培?黄科

【摘要】目的 了解自体脐血造血干细胞移植(ACBT)治疗儿童获得性再生障碍性贫血(AA)的疗效。方法 对接受ACBT治疗的3例获得性AA患儿的临床资料进行回顾性分析,其中男2例、女1例。以“再生障碍性贫血”和“自体脐血造血干细胞移植”(包括中英文)为关键词,对以下数据库的相关论文进行检索:PubMed、Web of Science、CNKI、万方数据知识服务平台,收集检索到的资料并进行分析。结果 3例患儿均成功获得造血重建,移植1年后骨髓均未见异常染色体克隆。病例1、2接受移植后继发血细胞减少,调整免疫抑制治疗方案后,血象均恢复正常,分别于移植后18个月、15个月停用免疫抑制剂。病例3接受移植后血象平稳,移植12个月顺利停用免疫抑制剂。3例患儿移植后540 d CD3+T淋巴細胞、CD3+CD4+T淋巴细胞、CD3+CD8+T淋巴细胞绝对计数均逐渐达到或者接近正常水平。检索到11例接受ACBT治疗的获得性AA患儿,其中8例于ACBT后使用了免疫抑制剂,10例病情完全缓解,1例首次ACBT后无使用免疫抑制剂,在接受了二次ACBT后死亡。结论 ACBT是治疗儿童获得性AA的安全有效方法。ACBT后适当应用免疫抑制剂有助于机体造血及免疫重建的稳定。
【关键词】儿童;再生障碍性贫血;自体脐血造血干细胞移植;免疫抑制;免疫重建
Successful autologous cord blood transplantation in 3 children with acquired aplastic anemia: case report and literature review Zhan Liping, Que Liping, Chen Han, Wu Zhengzhou, Liu Diandian, Wang Kaimei, Xu Honggui, Fang Jianpei, Huang Ke. Department of Pediatrics, Sun Yat-sen Memorial Hospital, Sun Yat-sen University, Guangzhou 510120, China Corresponding author, Huang Ke, E-mail: hke@mail. sysu. edu. cn
【Abstract】Objective To evaluate clinical efficacy of autologous cord blood transplantation (ACBT) in the treatment of pediatric acquired aplastic anemia (AA). Methods Clinical data of three children with acquired AA, 2 male and 1 female, who received ACBT were retrospectively analyzed.Using the keywords of “aplastic anemia” and “autologous cord blood transplantation”, relevant literatures were searched from PubMed, Web of Science, CNKI and Wanfang databases, data were collected and analyzed. Results Successful hematopoietic reconstitution was performed in all three patients. No abnormal chromosomal clones were found after 1-year ACBT. Case 1 and case 2 suffered from cytopenia following ACBT. After adjusting the immunosuppressive therapy, hematopoiesis returned to normal. Both of them received post-transplantation immunosuppression therapy for 18 and 15 months. Case 3 achieved normal persistent hematopoiesis and received routine full-dose administration of cyclosporine A for 6 months, followed by a 6-month taper. The absolute count of CD3+T cells, CD3+CD4+T cells and CD3+CD8+T cells reached or approached normal levels at 540 d after ACBT. Eleven children with acquired AA undergoing ACBT were retrieved. Eight of them were treated with immunosuppressants after ACBT, 10 cases achieved complete remission, and 1 child died after secondary ACBT without use of immunosuppressants after the initial ACBT. Conclusions ACBT is a safe and efficacious treatment for pediatric acquired AA. Appropriate post-transplantation immunosuppression contributes to stabilizing hematopoietic and immune reconstitution.
【Key words】Child;Aplastic anemia;Autologous cord blood transplantation;Immunosuppression;Immune reconstitution
获得性再生障碍性贫血(AA)是一种由多种病因引起的骨髓造血功能衰竭性疾病,治疗方法包括免疫抑制治疗(IST)及造血干细胞移植(HSCT)[1]。AA患者对IST的反应率为30% ~ 70%,但存在复发、克隆演变等问题[2]。据报道接受兔抗人胸腺细胞免疫球蛋白(r-ATG)治疗患者10年克隆演变发生率为5%,复发率高达15%[3]。欧洲骨髓移植协作组关于0 ~ 12岁儿童重型AA的数据显示,IST组3年的无失败生存率仅为33%[4]。IST治疗时间长,疗效达平台期后足量環孢素A需维持至少1年,总疗程一般需2 ~ 3年,减量过快、异常免疫损伤清除不彻底将增加复发风险[5-6]。而HSCT见效快,疗效彻底,可避免长期使用免疫抑制剂,远期复发及克隆性疾病转化风险小。全相合异基因造血干细胞移植长期生存率超过90%,无失败生存率超过80%,单倍体相合造血干细胞移植(Haplo-HSCT)长期生存率及无复发存活率超过80%[7-10]。因此,对于生命周期长的儿童患者来说,HSCT可能是更为合理的治疗选择。但目前植入失败及移植物抗宿主病(GVHD)仍是HSCT面临的主要问题,影响最终移植效果。自体脐血造血干细胞移植(ACBT)无发生GVHD的风险,造血重建后患者的生存质量高。目前有文献显示,ACBT治疗获得性AA是可行的[11-16]。在此,我们报道3例获得性AA患儿,其在接受非清髓性预处理方案后,接受自体脐血联合脐带血来源间充质干细胞(MSC)输注,成功获得造血重建,在移植后维持1 ~ 1.5年的免疫抑制治疗,造血及免疫重建良好。另外,我们还结合文献复习相关内容以供临床参考。
对象与方法
一、3例获得性AA患儿临床资料的收集
收集2018年8月至2019年5月在本中心接受ACBT治疗的3例获得性AA患儿的临床资料进行总结分析。
二、文献检索方法
以“再生障碍性贫血”和“自体脐血造血干细胞移植”(包括中英文)为检索关键词,对以下数据库截至2020年1月收录的论文进行检索:PubMed、Web of Science、CNKI、万方数据知识服务平台。收集检索到的接受ACBT治疗的儿童获得性AA的临床资料,包括:年龄、性别、预处理方案、移植后是否接受IST治疗、IST治疗时间、造血重建时间及临床结局等相关信息。
结果
一、3例获得性AA患儿病历资料
1. 基本情况
3例患儿在初诊时常规行骨髓形态、骨髓活组织检查(活检)、染色体核型分析、先天性骨髓衰竭性疾病相关致病基因检测,排除先天性骨髓衰竭性疾病、骨髓增生异常综合征等其他血液病。病例1为2岁10个月男性患儿,诊断为重型获得性AA,移植前曾接受6个月的环孢素、泼尼松、艾曲泊帕治疗,效果不佳。病例2为5岁9个月男性患儿,诊断为非重型获得性AA,予环孢素治疗1年后血象三系仍呈进行性下降,移植前复查骨髓活检残存造血组织仅为5%,考虑预后不良。病例3为7岁5个月女性患儿,诊断为极重型获得性AA,依赖输血,移植前未接受免疫抑制治疗,病程2个月。3例患儿均无HLA全相合同胞供体,移植前无严重感染。
2. 预处理方案
3例患儿均接受FCA预处理方案如下:氟达拉滨150 mg/m2、分5 d, r-ATG10 mg/kg、分4 d;病例1环磷酰胺为160 mg/kg、分4 d,因考虑免疫清除欠佳,病例2、3环磷酰胺加量至200 mg/kg、分4 d。
3. 干细胞回输
3例均接受ACBT,输注有核细胞数分别为2.72×107/kg、3.54×107/kg、3.58×107/kg;CD34+细胞数分别为0.24×105/kg、5.66×105/kg、1.11×105/kg。于输注当日、输注第7日、输注第14日,加输注第三方脐带血来源MSC 1次,剂量为1×106/kg。
4. 免疫抑制剂
输注干细胞前1日起使用环孢素 2.5 ~ 3.0
mg/(kg·d)抑制免疫,谷浓度维持在150 ~ 200 ng/ml,移植后半年开始减量,1 ~ 1.5年停用。随诊时根据血象及感染情况作药量加减:①甲泼尼龙2 mg/(kg·d)口服,起效后维持治疗2周,后缓慢减量;②西罗莫司1 ~ 1.5 mg/(m2·d)口服,谷浓度维持在10 ~ 15 ng/ml;③吗替麦考酚酯20 mg/(kg·d)口服;④利妥昔单抗注射液每周1次,每次100 mg/m2或375 mg/m2,最多输注4次。
5. 免疫细胞的流式细胞术检测
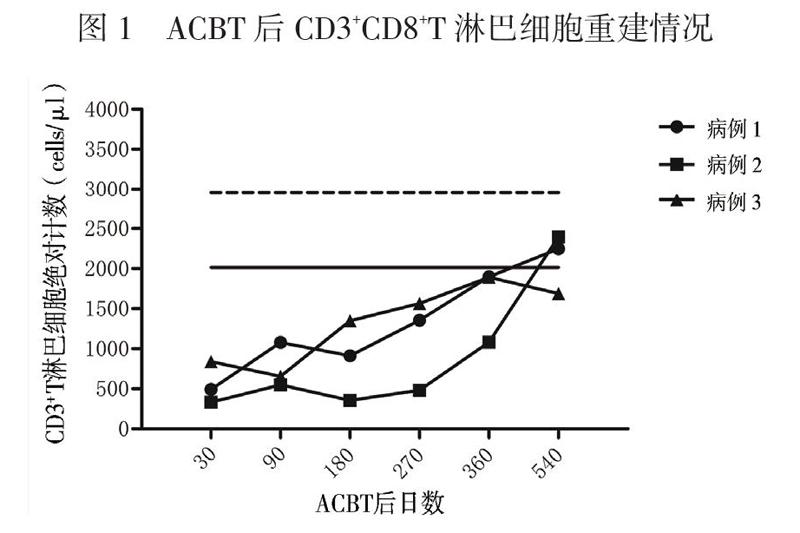
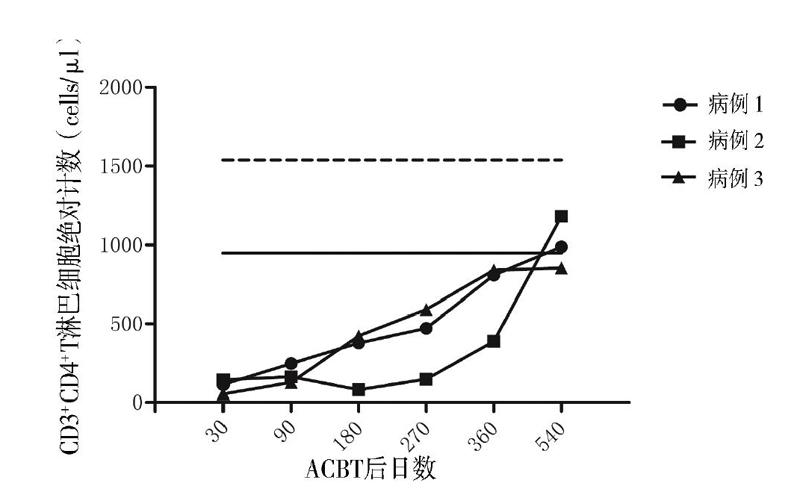
采用流式细胞术检测10例健康儿童外周血CD3+T淋巴细胞、CD3+CD4+T淋巴细胞、CD3+ CD8+T淋巴细胞绝对计数,计算其95%CI作为淋巴细胞绝对计数的参考范围。3例患儿分别于移植后第30、90、180、270、360、540日监测外周血CD3+T淋巴细胞、CD3+CD4+T淋巴细胞、CD3+CD8+T淋巴细胞绝对计数。
6. ACBT情况
6.1 病例1
患儿移植后第19日中性粒细胞植入,第30日血小板植入。粒细胞植入前出现腹泻,粪便培养见肠道铜绿假单胞菌,予头孢哌酮钠舒巴坦钠抗感染治疗后痊愈,ACBT后第31日顺利出院。ACBT 3个月后中性粒细胞及血小板减少。全血EB病毒、巨细胞病毒阴性;核周型中性粒细胞胞浆抗体阳性(1134 U/L);淋巴细胞亚群发现CD20+B淋巴细胞百分比增高(52.68%);骨髓形态有核细胞增生活跃,见4个巨核细胞。予利妥昔单抗注射液100 mg/m2×3疗程、375 mg/m2×1疗程,同时调整为甲泼尼龙联合西罗莫司抑制免疫,并输注8个疗程MSC(1×106/kg、每周输注1次),患儿血象逐渐恢复正常。CD3+CD8+T淋巴细胞绝对计数于第270日恢复正常并维持稳定(图1)。CD3+T淋巴细胞及CD3+CD4+T淋巴细胞绝对计数于第540日恢复正常(图2、3)。ACBT后18个月停用免疫抑制剂。现ACBT后27个月,骨髓增生活跃,血象正常,骨髓染色体核型46,XY(R带),未见异常染色体克隆[20]。
6.2 病例2
患儿移植后第26日中性粒细胞植入。因移植后并发Evans综合征,血小板及红细胞延迟植入,予停用环孢素,调整为吗替麦考酚酯及甲泼尼龙抑制免疫,同时使用利妥昔单抗注射液(375 mg/m2×3疗程+100 mg/m2×1疗程),血小板与红细胞分别于ACBT后第87日、第76日植入,脱离输血。在逐渐减停甲泼尼龙后,患儿红细胞及血小板再次下降,调整甲泼尼龙联合西罗莫司抑制免疫,血象逐渐好转。ACBT后粒细胞缺乏期患儿并发重症肺炎、急性心力衰竭,发展为慢性心力衰竭(心功能Ⅲ级),予口服地高辛治疗,目前已停药,评估为心功能Ⅰ级。ACBT后12个月停用激素,15个月停用西罗莫司。患儿免疫重建慢,CD3+ CD8+T淋巴细胞绝对计数于第360日恢复正常(图1)。移植后第540日CD3+T淋巴细胞及CD3+ CD4+T淋巴细胞绝对计数恢复正常(图2、3)。现ACBT后18个月,患儿骨髓增生活跃,血象正常,骨髓染色体核型46,XY(R带),未见异常染色体克隆,已返校上学[20]。
6.3 病例3
患儿ACBT后第16日中性粒细胞植入,第28日血小板植入。ACBT期间未发生感染,第33日顺利出院。移植后血象三系平稳,半年后复查骨髓象增生活跃,环孢素开始减量,移植后12个月停用。ACBT后CD3+T淋巴细胞、CD3+CD4+T淋巴细胞、CD3+CD8+T淋巴细胞绝对计数平稳增长。CD3+CD8+T淋巴细胞绝对计数于第180日恢复正常。移植后第540日CD3+T淋巴细胞、CD3+CD4+T淋巴细胞绝对计数接近正常。现ACBT后19个月,患儿骨髓增生活跃,血象正常,骨髓染色体核型46,XX(R带),未见异常染色体克隆,已返校上学[20]。
二、文献检索结果
共检索到11例接受ACBT治疗的获得性AA患儿的报道,其中8例于ACBT后使用了免疫抑制剂,10例病情完全缓解,1例首次ACBT后无使用免疫抑制剂,在接受了二次ACBT后死亡,见表1。
讨论
目前HLA全相合同胞造血干细胞移植是重型AA、极重型AA患儿一线治疗方法。对于缺乏同胞全相合供体或者IST治疗失败者,可接受替代供体移植,但GVHD发生率高。国内一项关于儿童AA接受替代供体移植结果显示,Ⅱ ~ Ⅳ度急性GVHD发生率为39.4%,慢性GVHD发生率为30.7%[17]。为尽快恢复骨髓正常造血功能,减少输血及严重感染,对存有自体脐血的AA患儿,排除先天性骨髓衰竭性疾病后,ACBT也是一种安全有效的治疗方法。本文3例获得性AA患儿缺少同胞供体,2例患儿接受环孢素治疗6个月以上效果不佳后行ACBT治疗,1例确诊2个月后首选ACBT治疗,移植后均成功获得造血重建,脱离输血。病例1 CD34+细胞数仅0.24×105/kg,中性粒细胞及血小板均在30 d内植活。可见自体脐血中少量的CD34+细胞数亦可以重建造血,获得良好的效果。病例3在确诊后未行IST治疗,很快接受ACBT治疗,造血及免疫功能均顺利获得重建,并在1年内停用IST。
ACBT预处理方案对疗效存在影响。在既往报道的ACBT治疗获得性AA病例中,多采用含ATG及环磷酰胺的预处理方案[11, 14-16]。Sun等[16]采用低剂量FCA方案:氟达拉滨(90 mg/m2)+环磷酰胺(900 mg/m2)+ATG(7.5 mg/kg)治疗4例重型AA患儿,其中3例获得缓解。本文3例患儿同样采用FCA方案,病例1预处理环磷酰胺160 mg/kg,移植后血象三系再次下降,抗中性粒细胞胞浆抗体阳性,调整免疫抑制剂后获得缓解,考虑免疫清除欠佳。因此,病例2及病例3环磷酰胺剂量加至200 mg/kg,病例2移植后并发心功能不全,可能与患儿病史长及大剂量环磷酰胺的心脏毒性相关。适当强度免疫抑制的预处理方案联合ACBT治疗获得性AA是安全有效的。在已经联用氟达拉滨及ATG情况下,环磷酰胺剂量可根据疾病病程及严重程度适当减量,减少不良反应。Liang等[14]报道1例肝炎相关AA患儿接受ATG联合环磷酰胺的预处理方案,环磷酰胺总剂量仅为80 mg/kg,移植后造血重建良好。在异基因造血干细胞移植治疗AA的研究中,针对FCA预处理方案中环磷酰胺的剂量同样存在争议。大剂量环磷酰胺可提高植入率,减少继发性植入失败,同时也增加了移植相关死亡率[18]。而减少环磷酰胺剂量需面临移植后混合嵌合及迟发性全血细胞减少等问题[19-20]。最合适的环磷酰胺剂量仍需要更多研究验证。
免疫异常因素在获得性AA中起着重要作用。ACBT后接受适当的IST,有助于调整异常免疫对骨髓造血的损伤。既往文献显示AA患者接受ACBT后再接受维持12个月的环孢素治疗有助于降低疾病复发率[15-16]。本文3例患儿移植后准备接受环孢素维持治疗1年。病例3移植后12个月停用环孢素,血象平稳。病例1及病例2移植后继发血细胞减少,免疫抑制剂分别延长至移植后15个月、18个月,停药后血象均平稳,骨髓增生活跃。ACBT联合1 ~ 1.5年的IST可以修复AA骨髓免疫紊乱,重建造血的同时免疫系统也得到调节。3例患儿停用IST后,T淋巴细胞亚群绝对计数均逐渐恢复正常。
既往研究显示MSC与造血干细胞共移植,可以促进造血干细胞植入[21-22]。为改善造血微环境,促进血象恢复,3例患儿均接受了脐血联合第三方MSC输注,未发生严重的不良反应,2例患儿中性粒细胞及血小板均在移植后30 d内顺利植入。移植后血象下降时,再次输注MSC时仍有一定的效果。因此,3例患儿应用MSC后均获益,但有效性及安全性仍需经临床大数据分析证实。
本文无法验证ACBT后造血重建来源于患儿骨髓残存造血干细胞还是自体脐血造血干细胞。但本方案的免疫清除强度大于强烈免疫抑制联合异基因脐血输注的方案[23]。本文病例1、2 环孢素治疗6个月至1年无效,病例3为极重型AA,3例患儿除免疫因素外,可能存在造血干细胞及骨髓微环境异常,单纯免疫清除难于达到理想治疗效果。经预处理免疫清除后輸注自体脐血及MSC,兼顾了3个可能的致病因素,更大程度地提高治愈机率。而强烈免疫抑制联合异基因脐血输注更多的是纠正免疫紊乱问题,脐血只是起到短期替代造血的作用。
ACBT治療3例获得性AA患儿均可以恢复造血及重建免疫功能,1 ~ 1.5年可以停用免疫抑制剂,避免了长期使用IST。因此,排除先天性骨髓衰竭因素后,ACBT是治疗获得性AA的一种安全有效方法。
参考文献
[1] 戚永磊, 许多荣, 王顺清, 邹外一, 李娟. 不同的造血干细胞移植方式对重型再生障碍性贫血治疗效果的影响. 新医学, 2012,43(4):219-222.
[2] Yoshida N, Kojima S. Updated Guidelines for the Treatment of Acquired Aplastic Anemia in Children. Curr Oncol Rep, 2018,20(9):67.
[3] Jeong DC, Chung NG, Cho B, Zou Y, Ruan M, Takahashi Y, Muramatsu H, Ohara A, Kosaka Y, Yang W, Kim HK, Zhu X, Kojima S. Long-term outcome after immunosuppressive therapy with horse or rabbit antithymocyte globulin and cyclosporine for severe aplastic anemia in children. Haematologica, 2014,99(4):664-671.
[4] Dufour C, Pillon M, Sociè G, Rovò A, Carraro E, Bacigalupo A, Oneto R, Passweg J, Risitano A, Tichelli A, Peffault de Latour R, Schrezenmeier H, Hocshmann B, Peters C, Kulasekararaj A, Van Biezen A, Samarasinghe S, Hussein AA, Ayas M, Aljurf M, Marsh J.Outcome of aplastic anaemia in children. A study by the severe aplastic anaemia and paediatric disease working parties of the European group blood and bone marrow transplan. Br J Haematol, 2015,169(4):565-573.
[5] Barone A, Lucarelli A, Onofrillo D, Verzegnassi F, Bonanomi S, Cesaro S, Fioredda F, Iori A P, Ladogana S, Locasciulli A, Longoni D, Lanciotti M, Macaluso A, Mandaglio R, Marra N, Martire B, Maruzzi M, Menna G, Notarangelo L D, Palazzi G, Pillon M, Ramenghi U, Russo G, Svahn J, Timeus F, Tucci F, Cugno C, Zecca M, Farruggia P, Dufour C, Saracco P. Diagnosis and management of acquired aplastic anemia in childhood. Guidelines from the Marrow Failure Study Group of the Pediatric Haemato-Oncology Italian Association (AIEOP). Blood Cells Mol Dis, 2015,55(1):40-47.
[6] 中华医学会儿科学分会血液学组, 编辑委员会中华儿科杂志. 儿童获得性再生障碍性贫血诊疗建议. 中华儿科杂志, 2014,52(2):103-106.
[7] Yoshida N, Kobayashi R, Yabe H, Kosaka Y, Yagasaki H, Watanabe K, Kudo K, Morimoto A, Ohga S, Muramatsu H, Takahashi Y, Kato K, Suzuki R, Ohara A, Kojima S. First-line treatment for severe aplastic anemia in children: bone marrow transplantation from a matched family donor versus immunosuppressive therapy. Haematologica, 2014,99(12):1784-1791.
[8] Cheng Y, Xu Z, Zhang Y, Wu J, Wang F, Mo X, Chen Y, Han W, Jia J, Wang Y, Zhang X, Huang X, Zhang L, Xu L. First-line choice for severe aplastic anemia in children: transplantation from a haploidentical donor vs immunosuppressive therapy. Clin Transplant, 2018,32(2):e13179.
[9] Xu LP, Wang SQ, Wu DP, Wang JM, Gao SJ, Jiang M, Wang CB, Zhang X, Liu QF, Xia LH, Wang X, Huang XJ. Haplo-identical transplantation for acquired severe aplastic anaemia in a multicentre prospective study. Br J Haematol, 2016,175(2):265-274.
[10] Zhu H, Luo RM, Luan Z, Lee V, Zhu YP, Luo CJ, Tang XF, Si YJ, Chen J. Unmanipulated haploidentical haematopoietic stem cell transplantation for children with severe aplastic anaemia. Br J Haematol, 2016,174(5):799-805.
[11] Rosenthal J, Bolotin E, Pawlowska A, Falk P, Oliver C, Forman S. 100: Hematopoietic stem cell transplantation with autologous cord blood units in two patients with severe aplastic anemia: time for reassessment? Biol Blood Marrow Tr, 2007,13(2, Supplement):39.
[12] Fruchtman S M, Hurlet A, Dracker R, Isola L, Goldman B, Schneider BL, Emre S. The successful treatment of severe aplastic anemia with autologous cord blood transplantation. Biol Blood Marrow Tr, 2004,10(11):741-742.
[13] Buchbinder D, Hsieh L, Puthenveetil G, Soni A, Stites J, Huynh V, Kirov I, Neudorf S, Rubin E, Sender L, Torno L, Margolis D, Childs R, Moore T, Nugent D. Successful autologous cord blood transplantation in a child with acquired severe aplastic anemia. Pediatr Transplant, 2013, 19(3):S180-S180.
[14] Liang C, Wei J, Jiang E, Ma Q, Pang A, Feng S, Han M. Successful treatment of a 3-year-old boy with hepatitis-associated aplastic anemia with combination of auto-umbilical cord blood transplantation and immunosuppressive therapy. Transfus Apher Sci, 2015, 52(2):211-213.
[15] Georgia A, Christina O, Aikaterini K, Elda I, Anna K, Anna P, Natalia T, Maria F, Antonios K, George V, Ioulia P, Evgenios G, Vasiliki K. Successful long-term hematological and immunological reconstitution by autologous cord blood transplantation combined with post-transplant immunosuppression in two children with severe aplastic anemia. Pediatr Transplant, 2019,23(1):e13320.
[16] Sun Y, Liu Z, Xiao J, Liu X, Jiang F, Fan S, Shen Y. Autologous cord blood transplantation in children with acquired severe aplastic anemia. Pediatr Transplant, 2018:e13325.
[17] 羅成娟, 陈静, 王坚敏, 覃霞, 张冰花, 朱华, 王希楠, 蔡娇阳, 罗长缨. 替代供者移植治疗儿童获得性再生障碍性贫血109例:单中心回顾性分析. 中华血液学杂志, 2020, 41 (2):128-129.
[18] Kang HJ, Shin HY, Park JE, Chung NG, Cho B, Kim HK, Kim SY, Lee YH, Lim YT, Yoo KH, Sung KW, Koo HH, Im HJ, Seo JJ, Park SK, Ahn HS;Korean Society of Pediatric Hematology-Oncology. Successful engraftment with fludarabine, cyclophosphamide, and thymoglobulin conditioning regimen in unrelated transplantation for severe aplastic anemia: a phase II prospective multicenter study. Biol Blood Marrow Transplant,2010,16(11):1582-1588.
[19] Kohashi S, Mori T, Hashida R, Kato J, Saburi M, Kikuchi T, Koda Y, Toyama T, Yamane Y, Yamanaka S, Okamoto S. Reduced-dose cyclophosphamide in combination with fludarabine and anti-thymocyte globulin as a conditioning regimen for allogeneic hematopoietic stem cell transplantation for aplastic anemia. Int J Hematol, 2015,101(1):102-105.
[20] Ashizawa M, Akahoshi Y, Nakano H, Ugai T, Wada H, Yamasaki R, Ishihara Y, Kawamura K, Sakamoto K, Sato M, Terasako K, Kimura S, Kikuchi M, Nakasone H, Kako S, Kanda J, Yamazaki R, Tanihara A, Nishida J, Kanda Y. A combination of fludarabine, half-dose cyclophosphamide, and anti-thymocyte globulin is an effective conditioning regimen before allogeneic stem cell transplantation for aplastic anemia. Int J Hematol,2014,99(3):311-317.
[21] Bueno C, Roldan M, Anguita E, Romero-Moya D, Martin-Antonio B, Rosu-Myles M, Canizo C D, Campos F, Garcia R, Gomez-Casares M, Fuster J L, Jurado M, Delgado M, Menendez P. Bone marrow mesenchymal stem cells from patients with aplastic anemia maintain functional and immune properties and do not contribute to the pathogenesis of the disease. Haematologica, 2014,99(7):1168-1175.
[22] Le Blanc K, Samuelsson H, Gustafsson B, Remberger M, Sundberg B, Arvidson J, Ljungman P, L?nnies H, Nava S, Ringdén O. Transplantation of mesenchymal stem cells to enhance engraftment of hematopoietic stem cells. Leukemia, 2007,21(8):1733-1738.
[23] 周芳, 葛林阜, 劉希民, 黄宁, 解琳娜, 孔凡盛, 佘拮, 陈娜. 强烈免疫抑制联合脐血输注治疗重型再生障碍性贫血25例临床观察. 中华血液学杂志, 2010,31(11):769-770.
(收稿日期:2020-12-28)
(本文编辑:洪悦民)

