miR-21在脂多糖诱导的人鼻黏膜上皮细胞中表达变化及作用机制
杜经纬?彭丽娟?吉爽?杨燕?冯俊
【摘要】目的 探討微RNA-21(miR-21)在脂多糖诱导的人鼻黏膜上皮细胞(HNEpC)中表达变化及可能的作用机制。方法 应用脂多糖诱导建立HNEpC炎症反应细胞模型,分别应用荧光定量PCR(qRT-PCR)和蛋白免疫印迹法检测炎症细胞模型建立前后miR-21和磷酸酶及张力蛋白同源物 (PTEN)蛋白的表达水平变化。取脂多糖诱导的HNEpC细胞,分为miR-21抑制物组和阴性对照组,应用脂质体转染法分别将miR-21抑制物和阴性对照物转染入2组HNEpC细胞,比较转染后2组细胞中miR-21和PTEN蛋白的表达、细胞增殖活性和凋亡率以及细胞上清液中TNF-α、IL-1β、IL-6和IL-10的水平。结果 脂多糖诱导的HNEpC细胞中miR-21表达水平增高(P < 0.05),PTEN蛋白的表达水平降低(P < 0.05)。miR-21抑制物组细胞中miR-21表达水平低于阴性对照组(P < 0.05),转染后24、48、72 h后的吸光度值均低于阴性对照组(P均 < 0.05),凋亡率高于阴性对照组(P < 0.05),并且细胞上清液中TNF-α、IL-1β及IL-6水平均低于阴性对照组(P均 < 0.05),IL-10水平高于阴性对照组(P < 0.05),细胞中PTEN蛋白的表达水平高于阴性对照组(P < 0.05)。结论 miR-21在脂多糖诱导的HNEpC炎症反应细胞模型中表达升高,抑制miR-21可显著抑制脂多糖诱导的HNEpC细胞的增殖活性和炎症反应,同时促进其凋亡,其机制可能与其对PTEN基因的调控有关。
【关键词】人鼻黏膜上皮细胞;微核糖核酸-21;细胞增殖;细胞凋亡;炎症反应;磷酸酶及张力蛋白同源物
Changes of miR-21 expression and mechanism in human nasal epithelial cells induced by lipopo-lysaccharide Du Jingwei, Peng Lijuan, Ji Shuang, Yang Yan, Feng Jun. Department of Otolaryngology-Head and Neck Surgery, the Second Clinical Medical College of North Sichuan Medical College/Nanchong Central Hospital, Nanchong 637000, China
Corresponding author, Peng Lijuan, E-mail: zbdpr9@ 163. com
【Abstract】Objective To investigate the changes of microRNA-21 (miR-21) expression in human nasal epithelial cells (HNEpC) induced by lipopolysaccharide (LPS) and unravel the potential mechanism.Methods HNEpC inflammatory cell model was induced by LPS. The changes of the expression levels of miR-21 and phosphatase and tensin homologue (PTEN) protein before and after establishment of the inflammatory cell model were detected by qRT-PCR and Western blot. HNEpC cells induced by LPS were collected and divided into the miR-21 inhibitor group and negative control group. HNEpC cells were transfected with miR-21 inhibitor and negative controls by using the liposome transfection method. After cell transfection, the expression levels of miR-21 and PTEN protein, cell proliferation activity, apoptosis rate, and the expression levels of TNF-α, IL-1β, IL-6 and IL-10 in the cell supernatant were measured and statistically compared between two groups. Results In the HNEpC cells induced by LPS, the expression level of miR-21 was significantly up-regulated (P < 0.05), whereas that of PTEN protein was significantly down-regulated (P < 0.05). Compared with the negative control group, the expression level of miR-21 was significantly lower (P < 0.05), the OD values at 24, 48 and 72 h after cell transfection were significantly lower (all P < 0.05), the apoptosis rate was significantly higher (P < 0.05), the expression levels of TNF-α, IL-1β and IL-6 in the cell supernatant were significantly lower (all P < 0.05), the expression level of IL-10 was significantly higher (P < 0.05),and the expression level of PTEN protein was significantly higher in the miR-21 inhibitor group (P < 0.05), respectively. Conclusions The expression level of miR-21 is up-regulated in the LPS-induced HNEpC inflammatory cell model. Inhibition of miR-21 expression can significantly suppress the proliferation activity and inflammatory response of HNEpC cells induced by LPS and promote the cell apoptosis. The underlying mechanism may be related to the regulation of PTEN gene.
【Key words】Human nasal epithelial cell;MicroRNA-21;Cell proliferation;Apoptosis;Inflammatory response;Phosphates and tensin homologue
慢性鼻-鼻窦炎伴鼻息肉(CRSwNP)是耳鼻喉科常见疾病之一,为鼻黏膜持续性的、过度的慢性黏膜炎症反应,常见于老年人、哮喘患者,发病率男性高于女性,患者形成鼻息肉,临床症状表现为鼻塞、脓涕、张口呼吸等。患者嗅觉减退,当中鼻甲严重压迫鼻中隔时会引发筛前神经综合征,严重影响患者的日常生活[1]。临床治疗CRSwNP手段众多,包括药物、按摩、热疗及手术切除,但患者即便是得到规范性的药物、手术治疗,其复发率仍处于较高水平,因此学者们也在积极探索CRSwNP发生发展的分子机制以期为临床治疗提供新的途径[2-3]。
在研究CRSwNP發生、发展机制的过程中,学者们越来越多地关注到微RNA(miR)所扮演的角色。miR是一类非编码的小分子RNA,可通过调控下游靶基因的表达,影响细胞的增殖、分化、凋亡等过程,在鼻咽癌、变应性鼻炎、慢性鼻-鼻窦炎等疾病中均发挥着重要的作用[4]。miR-21是miRNA家族中的一个重要成员,位于人染色体17q23.2上,具有高度的保守性。研究表明miR-21广泛参与调节机体的炎症免疫反应,在多种炎性反应中表达水平均有明显升高的现象[5-6]。近期Li等[7]在研究中发现miR-21在CRSwNP组织中表达明显升高,并且与鼻黏膜上皮细胞的炎症反应有关,但是作用机制尚不明确。因此,本研究选取人鼻黏膜上皮细胞(HNEpC)作为研究对象,观察miR-21对脂多糖诱导的HNEpC增殖、凋亡及炎症因子水平的影响,并进一步探讨其可能的作用机制。
材料与方法
一、材料与试剂
HNEpC购自上海沪震公司;脂多糖购自美国sigma公司;miR-21抑制物miR-21 inhibitor、阴性对照物inhibitor-NC及所有引物购自上海吉玛公司;TRIzol试剂、LipofectamineTM2000转染试剂盒购自美国Invitrogen公司;逆转录试剂盒和qRT-PCR试剂盒购自大连宝生物公司;CCK-8试剂盒购自上海雅吉生物公司;凋亡检测试剂盒购自上海群己生物公司;TNF-α、IL-1β、IL-6、IL-10的ELISA试剂盒均购自南京建成生物公司;一抗磷酸酶及张力蛋白同源物 (PTEN)、GAPDH抗体购自美国Santa Cruz公司;二抗购自北京中杉金桥公司。
二、方 法
1.细胞培养及转染
HNEpC按照说明书在含有10%胎牛血清的DMEM培养基中,置入37℃、5% CO2条件下的细胞培养箱中培养,待细胞融合度达70%左右时,胰酶消化、传代。应用脂多糖诱导HNEpC细胞时,按照终浓度1 mg/L脂多糖刺激细胞时间的不同分为0 h组、12 h组、24 h组、48 h组。转染操作时,取生长状态良好的对数生长期的HNEpC细胞接种到6孔细胞板,细胞分为miR-21抑制物组和阴性对照组,应用LipofectamineTM2000转染试剂盒参照说明书进行操作,分别将miR-21 inhibitor和inhibitor-NC转染至HNEpC细胞,转染后24 h再用脂多糖(1 mg/L)刺激细胞24 h后进行后续实验。
2.荧光定量-PCR(qRT-PCR)
应用TRIzol试剂提取HNEpC细胞总RNA,应用逆转录试剂盒逆转录成cDNA。以cDNA为模板,应用qRT-PCR试剂盒配置反应体系进行PCR反应。反应条件为:95℃5 min;95℃ 20 s,60℃45 s,共进行45个循环。miR-21引物:上游5-GCGGTAGCTTATCAGACTGA-3,下游5-TGCGTGTCGTGGAGTC-3;内参基因U6引物:上游5-CTCGCTTCGGCAGCACA-3,下游5-AA CGCTTCACGAATTTGCGT-3。miR-21相对表达水平应用2-△△Ct法进行计算。
3. CCK-8实验
取各组脂多糖刺激24 h后的HNEpC细胞,于检测前1 h 加入10 μl CCK-8溶液,将细胞培养板置于培养箱中继续孵育4 h,用酶标仪测得各组HNEpC细胞不同时点在450 nm波长处的吸光度值(OD450)。
4.流式细胞术
取各组脂多糖刺激24 h后的HNEpC细胞,胰蛋白酶消化后用预冷的磷酸盐缓冲液(PBS)洗涤细胞3次,Bingding Buffer液重悬细胞,分别依次加入Annexin V-FITC 5 μl和PI 5μl,充分混匀后于室温下避光反应15 min,立即采用流式细胞仪检测各组HNEpC细胞的凋亡率。
5. ELISA
取各组脂多糖刺激24 h后HNEpC细胞,收集细胞上清液,应用ELISA试剂盒检测细胞上清液中TNF-α、IL-1β、IL-6、IL-10等炎性因子的水平。
6.蛋白免疫印迹法
收集HNEpC细胞,PBS洗涤细胞后,裂解提取细胞总蛋白,BCA法行蛋白定量制备样品。各组细胞取等量蛋白上样行SDS-PAGE、半干转法转膜,应用5%脱脂奶粉室温封闭1 h,细胞洗涤后,分别加入一抗PTEN(稀释度1∶1000)和GAPDH(稀释度1∶2000)抗体,4℃孵育过夜,洗膜后加入二抗,室温孵育1 ~ 2 h,ECL显影、定影。
三、统计学处理
采用SPSS 22.0处理数据,实验均重复3次,正态分布计量资料以表示,2组间比较采用t检验,多组间比较采用单因素方差分析,多重比较采用Dunnet-t检验,P < 0.05为差异有统计学意义。
结果
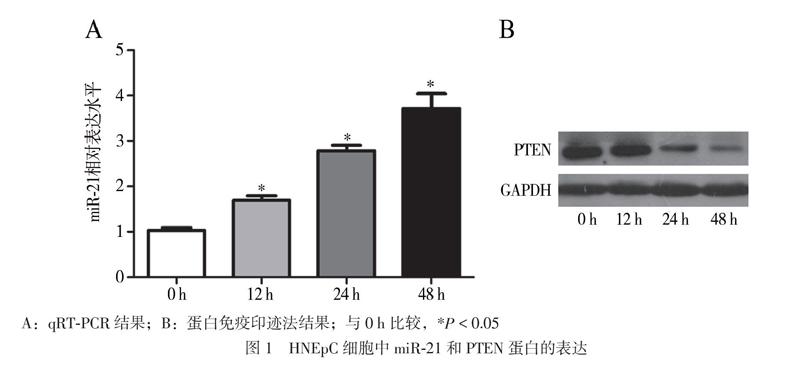
一、脂多糖诱导前、后HNEpC细胞中miR-21和PTEN蛋白的表达变化
qRT-PCR结果显示,脂多糖诱导后12、24、48 h时细胞中miR-21的相对表达水平均高于脂多糖诱导前(F = 126.623,P < 0.01,多重比较P均 < 0.05),见图1A。蛋白免疫印迹法结果显示,脂多糖诱导后12、24、48 h时细胞中PTEN蛋白的表达水平均低于脂多糖诱导前(F = 48.251,P < 0.01,多重比较P均 < 0.05),见图1B。
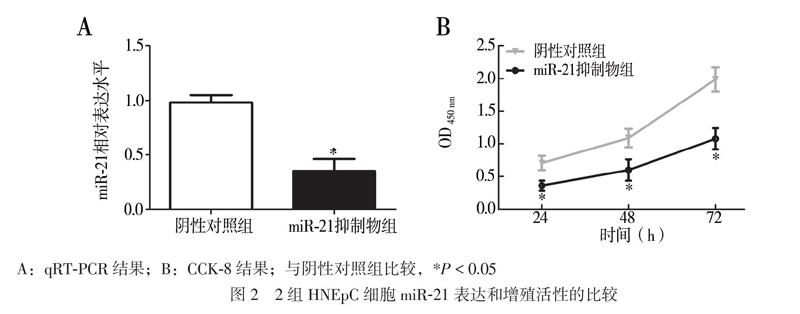
二、抑制miR-21对HNEpC细胞增殖活性的影响
qRT-PCR结果显示,miR-21抑制物组细胞中miR-21的表达水平低于阴性对照组(t = 8.369,P = 0.001),见图2A。CCK-8实验结果显示,miR-21抑制物组24、48、72 h的OD值均低于阴性對照组(t24 h = 4.493,t48 h = 5.343,t72 h = 6.251,P均 < 0.05),见图2B。
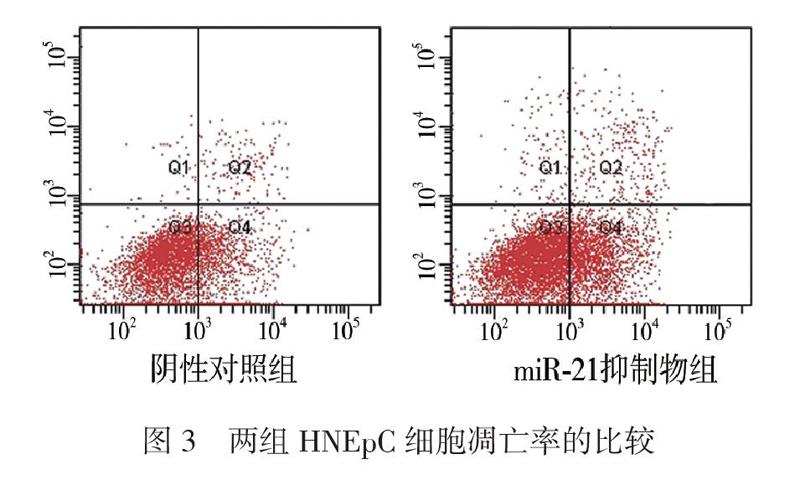
三、抑制miR-21对HNEpC细胞凋亡的影响
流式细胞术结果显示,miR-21抑制物组细胞凋亡率为(27.5±4.9)%,高于阴性对照组的(13.0±3.4)%,2组比较差异有统计学意义(t = 4.211,P = 0.014),见图3。
四、抑制miR-21对HNEpC细胞炎性因子水平的影响
ELISA检测结果显示,miR-21抑制物组细胞TNF-α、IL-1β、IL-6水平均低于阴性对照组(P均 < 0.05),而IL-10水平高于阴性对照组(P < 0.05),见表1。
五、抑制miR-21对HNEpC细胞PTEN蛋白表达水平的影响
蛋白免疫印迹法结果显示,miR-21抑制物组细胞PTEN蛋白的相对表达水平为0.89±0.21,高于阴性对照组的0.31±0.12,2组比较差异有统计学意义(t = 4.154,P = 0.014),见图4。
讨论
CRSwNP发病机制复杂,需要长期规范性的用药治疗,甚至需要行鼻内镜切除术,然而仍有相当一部分患者严格遵守治疗原则,其仍有较高的复发率[8-10]。因此探索CRSwNP炎症反应的分子机制,帮助临床医师寻求新的治疗途径,已成为当前学者的研究重点。随着miR在各疾病中作用的不断探索,近年来其在CRSwNP中的作用机制也是研究热点之一。Li等[11]发现miR-4492在CRSwNP组织中表达下调,可能通过JAK/STAT信号通路参与CRSwNP的发生进展。郑辉等[12]发现抑制miR-107表达能够抑制脂多糖诱导的HNEpC的炎症反应和增殖从而参与CRSwNP的发生进展。miR的发现为临床治疗CRSwNP提供了新的研究方向[4]。
HNEpC呼吸道防御病原物、过敏原及污染物等入侵的第一道屏障,在慢性鼻-鼻窦炎的炎症反应和鼻息肉的形成中扮演着极其重要的角色,HNEpC异常增殖、凋亡及炎症反应是鼻息肉的形成的关键[13-14]。脂多糖为糖脂化合物,为革兰阴性菌细胞壁的主要成分,能够诱导多种细胞因子的产生,可诱导HNEpC发生炎症反应而诱发CRSwNP的发生。应用脂多糖诱导HNEpC作为研究对象是研究CRSwNP常用细胞模型[15-16]。miR-21是近期发现与炎症免疫反应密切相关的miR家族成员之一,但是miR-21在CRSwNP中的作用机制尚不清楚。
本研究中我们通过观察脂多糖诱导的HNEpC细胞不同时间的miR-21表达水平发现,脂多糖诱导的HNEpC细胞中miR-21表达水平明显增高,提示异常高表达的miR-21可能参与了CRSwNP的发生发展。为了进一步探讨miR-21对脂多糖诱导的HNEpC细胞增殖、凋亡和炎症反应的影响,我们通过脂质体转染法转染miR-21抑制物至HNEpC细胞,研究发现抑制miR-21表达的HNEpC细胞,经脂多糖诱导后24、48、72 h的吸光度值均明显降低,而凋亡率明显升高,并且细胞上清液中TNF-α、IL-1β及IL-6水平均明显下降,而IL-10水平明显上升,提示抑制miR-21可显著抑制脂多糖诱导的HNEpC细胞的增殖活性和炎症反应,同时促进其凋亡,从而参与CRSwNP的发生发展。
PTEN是人第10号染色体缺失的磷酸酶及张力蛋白同源基因,是目前研究中证实与炎症反应密切相关的基因之一。PTEN基因编码双重底物特异性磷酸酶,具有脂质磷酸酶活性和蛋白磷酸酶活性,能够抑制PI3K/AKT信号通路从而起到抗炎作用[17]。既往研究者发现PTEN在CRSwNP中表达降低,PTEN能够增强HNEpC对炎症的抵抗力[18-19]。抑制PTEN的表达既能抑制上呼吸道黏膜纤毛细胞的凋亡,又能诱导上皮化生杯状细胞,从而增加黏膜上皮中黏液的分泌,降低排黏液功能[20]。国内外多个研究表明,miR-21可通过调控PTEN基因参与细胞增殖、凋亡并介导多种炎性反应[21-22]。因此我们推测miR-21在CRSwNP中的作用可能与其调控PTEN有关。在本研究中我们通过蛋白免疫印迹法发现,脂多糖诱导的HNEpC细胞中PTEN蛋白的表达水平明显降低。并且我们进一步发现,抑制miR-21表达的HNEpC细胞中PTEN蛋白的表达水平明显升高,提示miR-21能够靶向调控HNEpC细胞中PTEN蛋白的表达,miR-21对脂多糖诱导的HNEpC增殖、凋亡及炎症因子水平的影响可能与其对PTEN基因的调控有关。
综上所述,miR-21在脂多糖诱导的HNEpC炎症反应细胞模型中表达升高,抑制miR-21可显著抑制HNEpC炎症反应细胞的增殖活性和炎症反应,同时促进其凋亡,其机制可能与其对PTEN基因的调控有关,为CRSwNP的治疗提供了新的研究方向。
参考文献
[1] Wang W, Gao Y, Zhu Z, Zha Y, Wang X, Qi F, Zhou L, Pang J, Gao Z, Lv W. Changes in the clinical and histological characteristics of Chinese chronic rhinosinusitis with nasal polyps over 11 years. Int Forum Allergy Rhinol,2019,9(2):149-157.
[2] 中华耳鼻咽喉头颈外科杂志编辑委员会鼻科组, 中华医学会耳鼻咽喉头颈外科学分会鼻科学组.中国慢性鼻窦炎诊断和治疗指南(2018). 中华耳鼻咽喉头颈外科杂志, 2019, 54 (2):81-100.
[3] Khattiyawittayakun L, Seresirikachorn K, Chitsuthipakorn W, Kanjanawasee D, Snidvongs K. Effects of decongestant addition to intranasal corticosteroid for chronic rhinitis: a systematic review and meta-analysis. Int Forum Allergy Rhinol,2018,8(12):1445-1453.
[4] 叶妤, 罗庆, 余杰情,张剑. MicroRNA与慢性鼻-鼻窦炎发病机制的研究进展. 临床耳鼻咽喉头颈外科杂志,2018,32(3):237-240.
[5] Wang S, Wang J, Zhang Z, Miao H. Decreased miR-128 and increased miR-21 synergistically cause podocyte injury in sepsis. J Nephrol,2017,30(4):543-550.
[6] 李中岩,李文媛,王莹,李雪花.miR-21抑制剂对海马神经元氧糖剥夺/复氧损伤的影响.新乡医学院学报,2020,37(4):312-317.
[7] Li X, Li C, Zhu G, Yuan W, Xiao ZA. TGF-β1 induces epithelial-mesenchymal transition of chronic sinusitis with nasal polyps through microRNA-21. Int Arch Allergy Immunol,2019,179(4):304-319.
[8] 陈阳娟,柴向斌.单克隆抗体治疗慢性鼻-鼻窦炎伴或不伴鼻息肉的意见进展.临床耳鼻咽喉头颈外科杂志,2018,32(10):789-793.
[9] Chen Z, Peng Y, Ng CL, Jin P, Liu J, Li YY, Yan Y, Liu YH, Luo XL, Qiu QH, Wang DY. The clinical characteristics and histopathological features of chronic rhinosinusitis with unilateral nasal polyps in 136 patients in Southern China. Clin Otolaryngol,2018,43(5):1345-1349.
[10] 張久喜, 庄爱民, 刘刚,胡民. 慢性鼻-鼻窦炎疗效及复发性因素分析. 中国中西医结合耳鼻咽喉科杂志, 2018, 26(5):381-383,391.
[11] Li L, Feng J, Zhang D, Yong J, Wang Y, Yao J, Huang R. Differential expression of miR-4492 and IL-10 is involved in chronic rhinosinusitis with nasal polyps. Exp Ther Med,2019,18(5):3968-3976.
[12] 郑辉,吴昆,贺广湘.微小RNA-107对脂多糖诱导人鼻黏膜上皮细胞增殖、凋亡及炎症因子的影响及机制研究.中国耳鼻咽喉头颈外科,2019,26(2):74-78.
[13] Jiao J, Duan S, Meng N, Li Y, Fan E, Zhang L. Role of IFN-γ, IL-13, and IL-17 on mucociliary differentiation of nasal epithelial cells in chronic rhinosinusitis with nasal polyps. Clin Exp Allergy,2016,46(3):449-460.
[14] 李美娇,邓慧仪,王玮豪,孔维封,袁田,邱惠军,解子骁,黄雪琨,杨钦泰.维替泊芬对鼻息肉上皮细胞Yes相关蛋白的作用.新医学,2019,50(1):16-21.
[15] Wang XH, Zhang ZH, Cai XL, Ye P, Feng X, Liu TT, Li XZ. Lipopolysaccharide induces autophagy by targeting the AMPK-mTOR pathway in Human Nasal Epithelial Cells. Biomed Pharmacother,2017,96:899-904.
[16] Qing X, Zhang Y, Peng Y, He G, Liu A, Liu H. Mir-142-3p regulates inflammatory response by contributing to increased TNF-α in chronic rhinosinusitis with nasal polyposis. Ear Nose Throat J,2021,100(1):NP50-NP56.
[17] 苏强, 李浪. PTEN与炎症关系的研究进展.重庆医学,2014,43(4):494-497.
[18] Jia M, Chen X, Liu J, Chen J. PTEN promotes apoptosis of H2O2?injured rat nasal epithelial cells through PI3K/Akt and other pathways. Mol Med Rep,2018,17(1):571-579.
[19] Li M, Yang X, Wang S. PTEN enhances nasal epithelial cell resistance to TNFα?induced inflammatory injury by limiting mitophagy via repression of the TLR4-JNK-Bnip3 pathway. Mol Med Rep,2018,18(3):2973-2986.
[20] Langlois MJ, Roy SA, Auclair BA, Jones C, Boudreau F, Carrier JC, Rivard N, Perreault N. Epithelial phosphatase and tensin homolog regulates intestinal architecture and secretory cell commitment and acts as a modifier gene in neoplasia. FASEB J,2009,23(6):1835-1844.
[21] Song N, Zhang T, Xu X, Lu Z, Yu X, Fang Y, Hu J, Jia P, Teng J, Ding X. miR-21 protects against ischemia/reperfusion-induced acute kidney injury by preventing epithelial cell apoptosis and inhibiting dendritic cell maturation. Front Physiol,2018,9:790.
[22] Zhou H, Liu H, Jiang M, Zhang S, Chen J, Fan X. Targeting microRNA-21 suppresses gastric cancer cell proliferation and migration via PTEN/Akt signaling axis. Cell Transplant,2019,28(3):306-317.
(收稿日期:2021-01-05)
(本文編辑:杨江瑜)

