环烯醚萜isovaltrate acetoxyhydrin的抗流感及抗炎作用
吴加慧,蒋 娜,周 艳,刘 欢,李洪梅,李蓉涛,刘 丹
(昆明理工大学生命科学与技术学院,云南 昆明 650500)
流感是由流感病毒(influenza virus)引起的急性发热性呼吸道传染病,具有传染性强,传播速度快的特点。流感病毒属正粘病毒科,以RNA为主要遗传物质,流感病毒对全球的健康产生巨大的影响,根据世卫组织估计每年造成20万至50万人死亡[1-2]。由于流感病毒亚型多样且具有高变异性,极易通过抗原漂移和抗原转换高度变异,逃避宿主的免疫清除,并产生新的跨种属感染的病毒株,引发耐药性并迫使相应疫苗不断更新[3]。而疫苗的研发一般在流感爆发半年以后才能被研制出来,在疫苗研制出之前药物就发挥了重要的作用。因此,寻找新型抗流感药物很有必要。流感病毒复制周期包括附着、内吞、脱壳、复制、转录、包装、出芽和释放几个步骤[4-5]。阻断流感病毒的复制周期被认为是开发新型抗流感病毒药物的一种极好的策略。根据中医“温邪上受,首先犯肺”的理论,流感病毒对肺部的伤害最大,这与西医药理学的研究结果相一致。病毒感染导致的过度免疫反应,诱导炎性细胞因子如IL-1、IL-6等过度分泌,被认为是主要因素之一[6]。抑制流感病毒入侵和降低过度免疫反应引起的炎性损伤是流感治疗的两个重要方面,兼具抗流感病毒和抗炎活性的药物在流感治疗中具有前景和优势。
蜘蛛香(ValerianajatamansiJones)为败酱科缬草属植物,蜘蛛香的药用历史悠久。现代药理研究表明,蜘蛛香中的环烯醚萜类成分使其主要活性成分,具有抗肿瘤、抗病毒、抗炎和抗菌等多种生物学活性[7-8]。Isovaltrate acetoxyhydrin(IAN)是从蜘蛛香中分离获得的环烯醚萜类化合物[9],本研究通过流感病毒A/WSN/33/2009 H1N1 (WSN)感染狗肾细胞(MDCK)模型,发现其对流感病毒感染的MDCK细胞具有保护作用,阐述了环烯醚萜IAN的抗流感病毒活性和作用机制,并发现其显著的抗炎活性。
1 材料与方法
1.1 试剂与材料MDCK由昆明理工大学医学院杨帆老师惠赠;宫颈癌细胞(HeLa)购买于江苏凯基生物技术股份有限公司;奥司他韦(Ost),中国赛默飞;DMEM高糖培养基和胎牛血清(FBS),美国纽约Gibco公司;TPCK胰蛋白酶,美国Sigma-Aldrich;MTT,中国索莱宝公司;DAPI染料、神经氨酸酶测定试剂盒、化学发光试剂盒和放射免疫沉淀测定(RIPA)裂解液,碧云天生物技术公司;小鼠抗核蛋白(NP)单克隆抗体,兔早期核内体抗原(EEA1)单克隆抗体,英国Abcam公司;山羊抗小鼠、兔IgG结合FITC荧光二抗,中杉金桥生物技术公司,批号:ZF-0312、ZF-0311。
1.2 仪器多功能读板仪Spectra Max M2,美国Molecular Devices;光学倒置显微镜CKX41,德国Olympus;CO2细胞培养箱3111,美国Thermofisher;高速冷冻离心机1-14K,德国Sigma;尼康激光共聚焦显微镜A1R/A1,日本Nikon。
1.3 细胞半数感染量(TCID50)的测定将MDCK细胞以2×106·L-1每孔0.2 mL的密度接种于96孔板中培养过夜,WSN病毒液10倍浓度梯度稀释,感染单层MDCK细胞,正常细胞作为对照组,于35 ℃、5%CO2培养箱中培养,每天观察细胞状态,72 h后在倒置显微镜下观察细胞病变效应(CPE),记录病变程度和孔数,采用Reed-Muench法,计算细胞半数感染量 (TCID50)[10]。
1.4 细胞毒性实验使用MTT法测定IAN的细胞毒性。将IAN倍比稀释成5个浓度(3.125、6.25、12.5、25和50 μmol·L-1),分别加入到已长成单层细胞的96孔培养板中,设正常细胞对照组,每组设置3个复孔,于37 ℃、5%CO2培养箱中培养48 h,采用MTT法测定细胞活度[11],使用Spetra Max M2检测波长为490 nm的吸光度。
1.5 细胞病变效应(CPE)抑制实验将MDCK细胞以2×106·L-1每孔0.2 mL的密度接种于96孔板中过夜,梯度浓度的IAN(3.125、6.25、12.5、25和50 μmol·L-1)与WSN(MOI=0.01)共培养。将感染细胞在无血清DMEM中培养48 h,其中含有质量分数为1%的胎牛血清(BSA)和2.5 mg·L-1的TPCK胰酶。使用MTT法测定490 nm吸光值,使用IBM SPSS Statistics 20软件分析吸光值。
1.6 加药时间点实验MDCK细胞以3×106·L-1每孔0.2 mL接种于12孔板中,培养24 h。WSN(MOI=0.01)感染细胞2 h后移除培养基中病毒液,并以此时为作用的零时,再分别在0-2 h、0-5 h、0-8 h和0-10 h,以及2-5 h时间段进行IAN(20 μmol·L-1)处理。收集上清裂解细胞,分析NP含量变化[12]。
1.7 免疫荧光染色HeLa细胞以2×106·L-1每孔0.2 mL的密度接种于24孔板中的玻片上,培养24 h。WSN(MOI=0.1)感染细胞2 h后移除培养基中病毒液,分别在感染后的0-2 h、0-5 h、0-8 h和0-10 h四个时间段进行IAN(20 μmol·L-1)处理。PBS洗涤,多聚甲醛固定30 min,质量分数为5%的BSA室温封闭1 h,抗NP抗体检测NP在Hela细胞上的定位含量变化。
1.8 抗血凝素凝集实验将一系列浓度(0.5、5、25、50 μmo ·L-1)的化合物IAN与WSN病毒涡旋混匀后加入到V型96孔板中,之后,加入等体积使用生理盐水配置的体积分数为1%的红细胞悬液,室温静置30 min,观察并记录V型96孔板中红细胞的凝集效果。
1.9 IAN与NP分子对接从Protein Data Bank上下载NP蛋白的三维结构(PDB编号:2IQH,分辨率:3.2A);使用ChemDraw绘制IAN结构,输出3D结构;使用Schrodinger软件完成分子对接并分析。
1.10 NA活性抑制实验通过神经氨酸酶抑制筛选试剂盒检测IAN对NA酶活性的抑制活性。将70 μL神经氨酸酶缓冲液和10 μL NA溶液混合均匀,然后分别加入10 μL梯度稀释的OST和IAN(25、50、100 μmol·L-1)。加入10 μL显色底物,室温混合1 min,37 ℃孵育30 min,用spetramax M2检测激发波长322 nm和发射波长450 nm的荧光信号[13]。
1.11 ELISA检测IL-1、IL-6表达量RAW264.7细胞以密度2×109·L-1接种于12孔板中,将2.5 μmol·L-1,5 μmol·L-1两个浓度的IAN与1 mg·L-1的脂多糖(lipopolysaccharide,LPS)共同作用细胞18 h,收集细胞上清,使用ELISA试剂盒检测上清溶液中IL-1 和IL-6细胞因子的含量。

2 结果
2.1 IAN(Fig1)对流感病毒感染的MDCK细胞具有明显的保护作用通过MTT法检测IAN对MDCK细胞的细胞毒性作用,发现该化合物在6.25-25 μmol·L-1浓度范围对MDCK细胞活度几乎没有影响(Fig2A),但对流感病毒感染的MDCK细胞具有明显的保护作用(Fig2B,C),如图所示,流感病毒A/WSN/33/2009感染MDCK细胞48 h,细胞发生明显病变,当用6.25-25 μmol·L-1的IAN与病毒共同作用时,细胞病变率显著降低,表明IAN(见Fig1)对流感病毒感染的MDCK细胞具有显著的保护作用。

Fig 1 Structure of isovaltrate acetoxyhydrin (IAN)

Fig 2 The protective effect of IAN on MDCK cells infected by influenza virusA:The effect of IAN on MDCK cell viability;B:The protective effect of IAN on MDCK cells infected by influenza virus,and Oseltamivir (OST)was used as a positive control;C:Cytopathic effect of IAN on influenza virus-infected MDCK cells observed through a microscope.△△P<0.01 vs Control;**P<0.01 vs WSN
2.2 IAN对病毒生命周期的影响为了确定IAN作用于病毒感染受体细胞的哪一个阶段,我们设计了加药时间点实验,分别在流感病毒WSN感染后的0-2 h、0-5 h、0-8 h、0-10 h以及2-5 h时间段进行IAN(20 μmol·L-1)处理,药物作用时间分别覆盖了病毒吸附、入核、复制和子代病毒释放过程(Fig3A)。免疫印记实验结果(Fig3B)显示,IAN处理0-2 h,宿主细胞结合的病毒量与对照组差异不大,说明IAN几乎不干扰病毒早期的吸附。IAN处理0-5 h和2-5 h时,病毒NP蛋白的含量与对照组相比明显减少,表明IAN影响吸附后的胞质转运与入核阶段。免疫荧光实验(Fig3C)同样验证了这一结果,各处理组中流感病毒均能与宿主细胞有效吸附,而病毒处理5 h后,IAN处理组进入细胞核内的NP蛋白比例明显降低,表明IAN干扰了病毒核糖核蛋白(vRNP)的入核过程。这些结果表明IAN可能在病毒吸附后,影响了转运及入核的过程从而影响了病毒的复制。
2.3 IAN对红细胞凝集作用的影响流感病毒表面的血凝素(HA)蛋白,含有识别与结合宿主细胞表面受体的结构,能使一些特定的红细胞发生凝集现象。实验结果显示(Fig4)在无WSN病毒作用的情况下,红细胞沉降于孔底呈点状,而2-6的WSN病毒作用可使血细胞发生凝集沉于孔板底部呈网状。当加入抗HA抗体与WSN病毒共处理时,可有效抑制病毒引起的血细胞凝集,而IAN则对血细胞的凝集没有抑制作用。以上结果显示IAN不能抑制病毒引起的红细胞凝集,表明病毒表面抗原HA并不是IAV的靶点,该结果与时间点实验IAV不影响病毒的吸附过程结果相一致。
2.4 IAN能与NP功能域结合NP蛋白除了维持核糖蛋白体复合物(vRNP)的稳定性以外,还在流感病毒的入核、转录、复制等多个环节发挥重要作用。IAN与NP蛋白分子对接结果显示(Fig5),IAN能以氢键与NP蛋白395位天冬氨酸(N395)、396位苏氨酸(T396)、447位亮氨酸(L447)结合,这3个位点刚好处于核定位信号(Nuclear localization signal,NLS3)320-400残基和NP-NP结合区371-465残基的区域之中。说明IAN可通过与NP蛋白的结合干扰NP蛋白的功能从而抑制病毒vRNP的转运和之后的入核复制过程[14-15]。
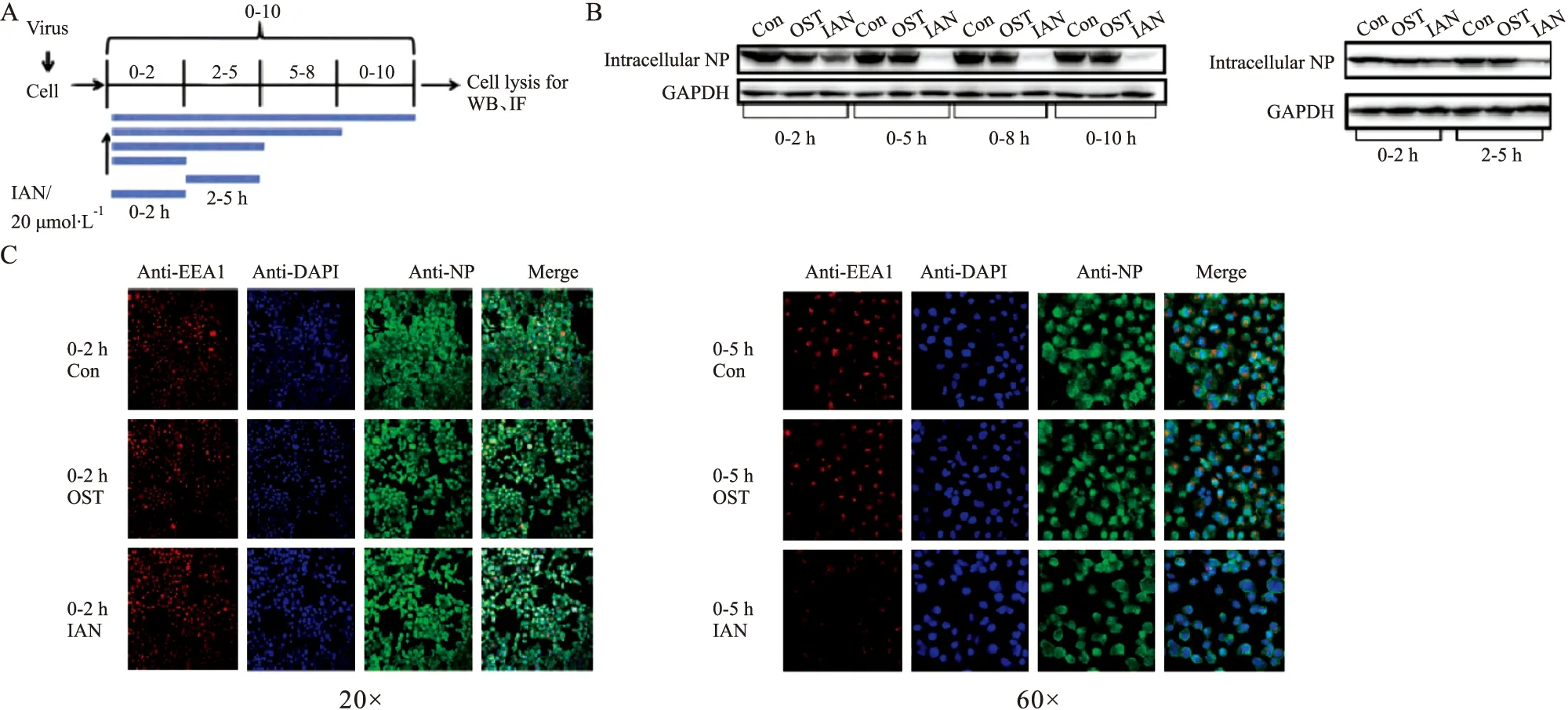
Fig 3 Effects of IAN on replication cycle of influenza virus in cellsA:Design time-of-additional experiments;B:The expression level of influenza NP protein was detected after IAN treatment for 0-2 h,0-5 h,0-8 h,0-10 h and 2-5 h;C:NP fluorescence antibody was used to track the location of the NP in HeLa cells.
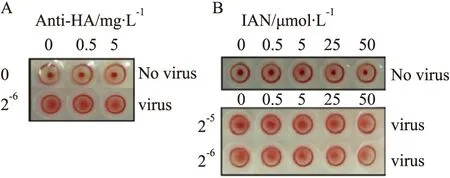
Fig 4 Effects of IAN on hemagglutination inhibition A:Anti-HA antibody was used as positive control;B:IAN had no effect on WSN-induced RBC agglutination
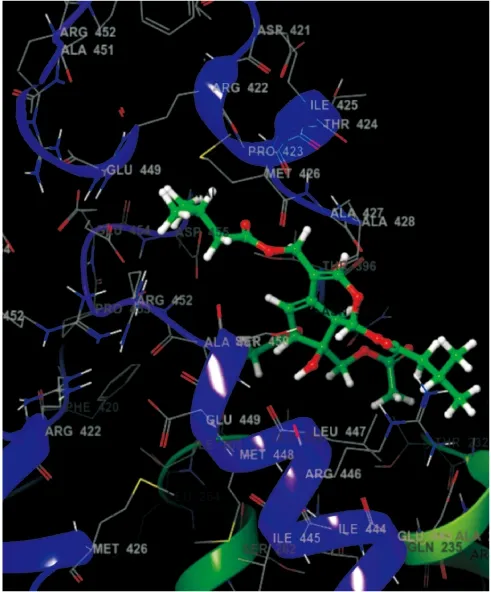
Fig 5 IAN docking with NP molecule
2.5 IAN对神经氨酸酶(NA)活性具有一定的抑制效果神经氨酸酶抑制实验结果显示(Fig6),化合物IAN具有神经氨酸酶的抑制作用,且抑制效果呈现剂量依赖关系,与NA对照组相比,IAN在大于5 μmol·L-1时,就表现出一定的抑制NA的活性。
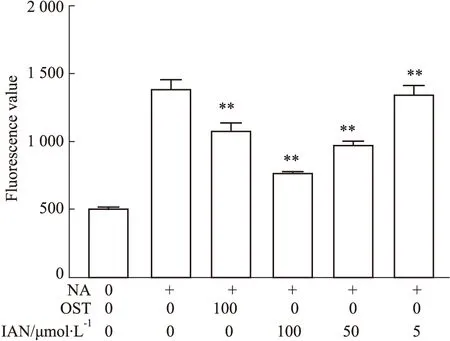
Fig 6 Effect of IAN on NA activities **P<0.01
2.6 环烯醚萜IAN抑制LPS诱导的巨噬细胞的IL-1、IL-6的产生巨噬细胞作为天然免疫的重要成员在抵抗病原体入侵过程中发挥重要作用,同时也是病原体激发过度免疫,产生大量炎症因子造成机体损伤的主要免疫细胞。在使用LPS诱导RAW264.7巨噬细胞炎症模型中,我们检测了IAN对关键炎症因子IL-1和IL-6的分泌的影响。实验结果如Fig7所示,与空白对照组相比,LPS诱导的巨噬细胞中,IL-1(A)和IL-6(B)的产生均明显升高,而与2.5-5 μmol·L-1的IAN共同作用时,炎症因子IL-1和IL-6的产生受到了明显抑制,说明IAN体外具有明显的抗炎活性。
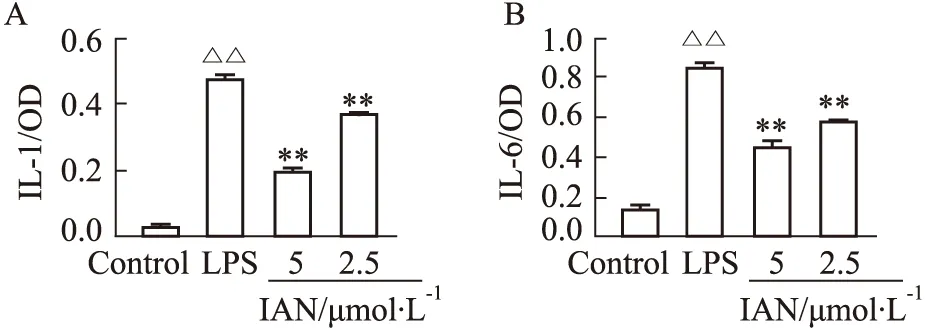
Fig 7 The inhibitory effect of IAN on IL-1 and IL-6A:The inhibitory effect of IAN on IL-1;B:The inhibitory effect of IAN on IL-6.△△P<0.01 vs control;**P<0.01 vs LPS
3 讨论
研究发现,IAN对流感病毒感染的MDCK细胞具有明显的保护作用,进一步追踪病毒的感染过程,发现病毒感染细胞0-2 h阶段IAN对病毒的影响不大,而感染细胞2-5 h时予以IAN处理,细胞内NP蛋白的量明显降低,说明IAN并不是作用于病毒吸附阶段,血凝实验也证实了这一点。IAN的抑制作用最早发生于病毒感染细胞0-5 h,与此同时免疫荧光的结果表明,与对照组相比细胞核内的NP蛋白的量明显减少,表明病毒入核过程受到了阻碍。因此,IAN发挥抗流感病毒活性作用首先发生在病毒入核阶段。流感病毒vRNP是流感病毒最基本的复制单位,是由病毒的RNA基因和碱性聚合酶1(PB1)、碱性聚合酶2(PB2)、酸性聚合酶(PA)及核蛋白(NP)组成的复合体。其中NP是vRNP构成的主要部分,具有稳定vRNP的结构的作用,NP上的核定位信号在vRNP入核阶段起到了决定性的作用[16]。经过分子对接发现IAN能以氢键与NP蛋白395位天冬氨酸(N395)、396位苏氨酸(T396)、447位亮氨酸(L447)结合,这3个位点刚好在核定位信号区域中。证实NP蛋白是IAN的有效靶点。值得注意的是,在该实验中,化合物浓度大于50 μmol·L-1时对NA的抑制效果优于OST,根据说明书,这是因为OST抗NA的活性需要在体内代谢物为奥司他韦酸,体外实验中OST的抑制效果并不十分明显。有研究发现,流感病毒本身并不是导致重症及引起致死的关键,病毒导致的肺组织损伤或更加严重的急性呼吸窘迫综合症是流感病毒尤其是高致病性流感病毒的高致病力和高致死率的主要原因[17]。流感病毒感染所致的组织损伤与过度或失控的炎性免疫反应密切相关,炎性因子迅速、大量分泌,致细胞因子风暴。因此抑制流感病毒入侵和降低过度免疫反应引起的炎性损伤是流感治疗的两个重要方面。本研究发现,环烯醚萜IAN还对LPS诱导的巨噬细胞产生的炎症因子IL-1、IL-6具有明显的抑制作用,即IAN兼具有抗流感病毒和抗炎的活性,在抗流感治疗可能具有更好的前景。
综上所述,本研究发现蜘蛛香中的环烯醚萜IAN在体外具有抗流感病毒以及抗炎活性。系统性探索IAN对流感病毒的生命周期的影响,发现其抗流感机制是通过影响病毒吸附后的入核复制过程来实现的,流感病毒NP蛋白很可能是它作用的靶点。IAN能通过与NP蛋白功能区结合,干扰vRNP的转运和核定位,同时IAN对病毒的释放也有一定的效果。本研究为蜘蛛香在抗流感中的应用提供了依据,对于开发环烯醚萜类抗流感病毒药物具有重要意义。

