RNA m5C甲基化在肿瘤发生发展中的调控作用
徐英杰,文雪倩,冯璐瑶,田 鑫
(郑州大学第一附属医院药学部,河南 郑州 450052)
RNA转录后修饰作为表观遗传领域研究的前沿和热点,近年来受到了越来越多的关注。目前发现的170多种RNA转录后修饰中,2/3为甲基化修饰,包括m1A、m6A、m5C和m7G等。RNA的5-甲基胞嘧啶(m5C)甲基化修饰是指RNA胞嘧啶上第五位碳原子上发生甲基化,于上世纪70年代在rRNA中发现,后来相继在转运RNA(tRNA),信使RNA(mRNA),和长链非编码RNA(lncRNA)上发现[1]。RNA的m5C修饰在细胞中广泛存在,且对基因的表达、RNA的稳定性等起着重要的调控作用。此外m5C甲基化和原癌基因的激活有密切联系,m5C修饰的甲基转移酶NSUN2等在肿瘤组织和癌旁组织中存在差异表达。本文综述了m5C甲基化在各种类型RNA中的分布和功能,并介绍了m5C甲基化在肿瘤发生发展中的作用。
1 m5C甲基化修饰,见Fig1。
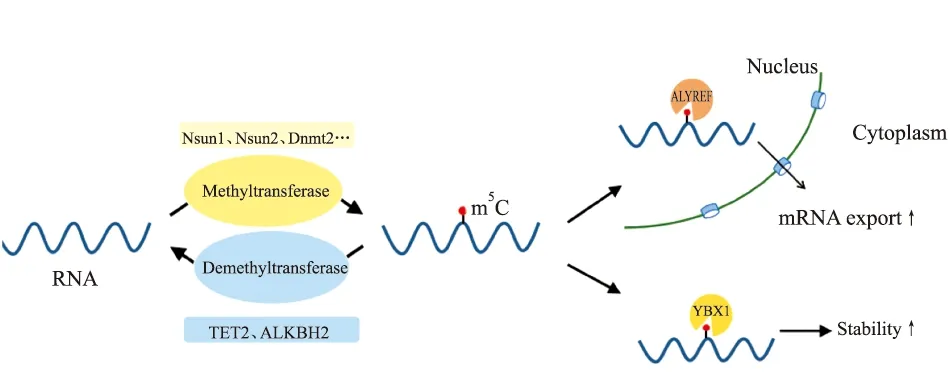
Fig 1 The dynamic regulation of m5C in RNA and function of regulating mRNA export
RNA的m5C甲基化修饰受到甲基化转移酶和去甲基化转移酶的动态调控,在甲基化转移酶的催化作用下,RNA发生m5C修饰,而后与识别蛋白相结合发挥出特定的生物学功能[1]。m5C修饰主要的甲基转移酶包括NSUN1、NSUN2、NSUN3、NSUN4、NSUN5和NSUN7,以及DNMT2,其共有的特点是结构上都具有一个保守的半胱氨酸残基,能够在甲基化供体S-腺苷-L-甲硫氨酸(SAM)的帮助下催化各种类型的RNA发生m5C甲基化修饰[2]。
1.1 甲基化转移酶NSUN家族蛋白是近年来研究较为广泛的m5C甲基转移酶。人的NSUN家族蛋白共有七个成员,都具有m5C甲基转移功能结构域,并含有两个催化甲基转移功能所必须的半胱氨酸。NSUN家族催化甲基转移的共有机制为首先在甲基化转移酶的半胱氨酸和RNA的胞嘧啶之间发生共价结合形成共价中间体,然后富电子的胞嘧啶环对SAM上的甲基发生亲核加成,最终完成甲基化。
NSUN1主要定位于细胞核中,早期研究发现NSUN1在酵母中主要催化25s rRNA的C2870位点发生m5C甲基化,并且在功能上影响60s rRNA的成熟。最近有研究表明,NSUN1可以竞争结合HIV-1病毒的Tar RNA,并催化其发生m5C甲基化最终抑制病毒DNA的转录[3]。
NSUN家族中研究最为广泛的是NSUN2,NSUN2主要定位在细胞核中,在胚胎发育细胞分化及肿瘤发生中发挥重要作用。现在已有证据表明NSUN2可以催化多种类型的RNA发生m5C甲基化,包括tRNA、mRNA和非编码RNA。在生物学功能方面也有研究表明NSUN2在小鼠胚胎的发育和细胞的分化过程也发挥着重要的调控作用,例如NSUN2在小鼠胚胎中发生缺失会导致小鼠发育迟缓和组织分化缺陷。NSUN2还可以催化HIV病毒转录本发生m5C甲基化,敲除NSUN2会影响HIV病毒转录本的可变剪切,进而抑制HIV病毒转录本的翻译,说明m5C甲基化不仅在胚胎发育中发挥着调控作用,在病毒的生命周期中也发挥着重要的调控作用[2,4]。
NSUN3主要定位于线粒体中,特异性催化线粒体tRNA的C34位胞嘧啶发生m5C甲基化。已有研究表明NSUN3缺失导致tRNA上甲基化减少,导致蛋白质的翻译过程受阻。也有证据表明小鼠胚胎干细胞中的NSUN3缺失会导致胚胎干细胞分化成为神经外胚层的能力受损。在人体中有研究表明线粒体呼吸链复合物缺陷患者中广泛存在NSUN3突变,这直接导致线粒体tRNA上的C34缺乏m5C修饰最终导致线粒体翻译功能受损[5]。
NSUN4和NSUN5均为rRNA特异性的m5C甲基转移酶,其中NSUN4定位于线粒体中,由NSUN4和NSUN5介导的rRNA上的m5C甲基化均和rRNA的组装和成熟有关。且NSUN4还可以和Mterf4形成复合物参与线粒体中核糖体大小亚基的组装过程,直接影响rRNA的成熟。NSUN5与神经系统的发育有关,有研究表明NSUN5敲除的小鼠会发生神经系统发育异常,表现为空间认知障碍[2]。
NSUN6为tRNA特异性甲基转移酶,定位于细胞质中,其功能和tRNA的剪切成熟相关。在肿瘤中,有研究报道NSUN6在睾丸癌、甲状腺癌、肝癌和卵巢癌中表达降低,低表达NSUN6往往提示预后较差。此外,还有研究报道NSUN6可以和LLGL2以及lncRNA MAYA形成复合物,催化Hippo信号通路中的核心蛋白MST1发生甲基化进而破坏其激酶活性,最终导致原癌基因YAP被激活并积聚在核内以促进与肿瘤细胞增殖和骨转移有关的靶基因表达[6]。
NSUN7在细胞中主要定位于细胞核,在维持精子的正常功能中发挥重要作用,成年雄性小鼠的NSUN7发生突变会导致精子活力受损和不育。此外,NSUN7可以催化与转录因子PGC-1α相互作用的eRNA发生m5C甲基化,敲低NSUN7会导致PGC-1α靶基因相关eRNA含量减少,进而导致靶基因表达量减少[7]。
Dnmt2是一种tRNA和mi-RNA的甲基转移酶,主要位于细胞核中。Dnmt2可以催化tRNA上C38位发生m5C修饰,在NSUN2和Dnmt2双敲除小鼠中可以观察到tRNA上缺失m5C修饰,进而导致tRNA稳定性和蛋白翻译速率的下降。在成纤维细胞中敲低Dnmt2导致细胞增殖相关的miR-28-3p、miR-34a-3p上调,会使细胞更容易受到氧化应激和DNA损伤。有研究表明Dnmt2敲除会导致斑马鱼视网膜、肝和脑分化缺陷,在小鼠中敲除Dnmt2会导致小鼠软骨内骨化、心肌肥厚和造血系统分化缺陷,表明Dnmt2介导的m5C甲基化和细胞的分化以及组织的发育过程密切相关[8]。
1.2 m5C去甲基化酶目前对于DNA的去甲基化过程和去甲基酶TET家族已经有了比较清楚的认识,主要机制为TET在α酮戊二酸和二价铁离子的的协同作用下催化DNA上的5-mC甲基发生去甲基化,同时在这个过程中还会产生5-hmC、5-ac等中间产物。最近有研究发现在小鼠胚胎干细胞中敲除TET2会导致tRNA上的hm5C水平显著降低,而过表达TET2则会导致tRNA上的hm5C水平升高,m5C水平降低,同时体外研究发现TET2催化tRNA上的m5C修饰发生氧化还会促进翻译过程[9]。
还有研究表明,m1A的去甲基酶ALKBH1可以催化线粒体tRNA上C34位的m5C修饰发生羟基化转化为hm5C,再氧化为f5C。在293T细胞中敲除ALKBH1可以导致线粒体tRNA上f5C修饰减少,进而导致线粒体翻译功能和呼吸功能受损[10]。说明ALKBH1介导的m5C去甲基化作用在维持线粒体正常功能中发挥重要作用。
1.3 m5C识别蛋白已经报道的m5C甲基化识别蛋白主要包括调控出核的ALYREF、参与DNA损伤修复的RAD52以及调控RNA稳定性的YBX1[11]。ALYREF作为m5C甲基化的识别蛋白,可以在细胞核内与具有m5C修饰的mRNA特异性结合形成mRNPs复合体促进mRNA的出核,在ALYREF敲减的细胞系中,具有m5C修饰的mRNA在细胞核内聚集,而这种聚集只能被回补野生型的ALYREF所取消,回补突变型的ALYREF则不发生改变,进一步验证了ALYREF通过识别和结合具有m5C修饰的mRNA发挥其促进mRNA出核的功能[11]。另有研究报道YBX1作为另一种m5C甲基化修饰的识别蛋白,可以在斑马鱼早期胚胎发育过程中的母源-合子转换期特异的结合具有m5C修饰的mRNA并维持其稳定性[12]。
此外有研究表明m5C甲基转移酶DNMT2可以特异性催化位于DNA损伤位点处的RNA发生m5C修饰。而RAD52作为m5C修饰的识别蛋白和DNA损伤位点的m5C修饰特异性的结合,从而参与后续的同源重组修复过程。进一步的研究发现,m5C在同源重组修复中的作用和肿瘤细胞对放射疗法和多聚腺苷二磷酸核糖聚合酶抑制剂(PARPi)疗法的敏感性有关,伴随DNMT2丢失的同源重组缺陷型肿瘤对PARP抑制剂较为敏感[13]。上述研究表明m5C修饰在RNA出核、早期胚胎发育、DNA损伤修复等多种生物学过程中发挥重要作用。
2 m5C甲基化在肿瘤发生发展中的作用
近年来越来越多的研究表明,m5C甲基化及其修饰酶在肿瘤的发生发展过程中发挥着重要的作用。由于技术的限制,早期的大多数的研究集中在和m5C甲基化相关的修饰蛋白在肿瘤的发生发展中发挥的作用。例如m5C甲基转移酶NSUN2在乳腺癌、结直肠癌等多种肿瘤中高表达,且和预后有密切联系。而近年来的研究则更多的集中在特定位点的m5C修饰在肿瘤发生过程中发挥的作用。
2.1 m5C甲基化在膀胱癌发生发展中的作用在膀胱癌中,相较于癌旁组织,癌组织中m5C甲基转移酶NSUN2和m5C识别蛋白YBX1高表达,使得癌基因HDGF上m5C甲基化修饰水平升高,而YBX1可以特异性识别HDGF mRNA上具有m5C修饰的位点并招募ELAVL1发挥其维持mRNA稳定性的功能,最终使得原癌基因HDGF稳定高表达。临床数据也证明了NSUN2、YBX1和HDGF高表达的患者具有较差的预后,说明了由NSUN2介导的m5C甲基化在膀胱癌中起到了促进肿瘤发生和进展的作用[4]。
2.2 m5C甲基化在皮肤鳞状细胞癌起始细胞中的作用
在皮肤鳞状细胞癌中,NSUN2被发现在肿瘤起始细胞(tumour-initiating cells)中相较于高分化肿瘤细胞低表达,此外还发现在肿瘤起始细胞中,蛋白合成速率较低,这与之前关于肿瘤干细胞的报道是一致的。进一步研究发现蛋白合成速率的降低可能是由NSUN2低表达导致tRNA上的m5C甲基化发生缺失,最终使肿瘤起始细胞具有一定的干细胞特性,说明m5C甲基化对维持肿瘤细胞的干细胞特性发挥着重要作用[14-15]。
2.3 m5C甲基化在神经胶质瘤发生发展中的作用有研究表明NSUN1、NSUN4、NSUN5,NSUN6和NSUN7在正常脑组织和神经胶质瘤中存在差异表达,结合病理分级信息后发现NSUN1和NSUN4在较高级别的神经胶质瘤组织中表达显著高于低级别神经胶质瘤,且m5C甲基转移酶表达谱和神经胶质瘤的临床病理特征以及预后密切相关,表明m5C甲基转移酶的表达可以作为判断神经胶质瘤预后的标志[16]。另有研究报道神经胶质瘤中存在由于NSUN5基因启动子区域的CpG岛区域高甲基化而导致的转录沉默,且这种转录沉默和胶质瘤患者的预后呈现一定相关性。进一步研究发现NSUN5作为28s rRNA上C3782位点的的m5C甲基转移酶,其转录沉默会导致该位点的m5C甲基化发生缺失,进而导致rRNA的构象发生改变,最终使得整体蛋白翻译水平的下调,氧化应激相关的醌氧化还原酶1(Nqo1)翻译水平上调,说明m5C甲基化和肿瘤细胞在压力应激条件下的生存密切相关[17]。
2.4 m5C甲基化在肝癌发生发展中的作用在肝癌中发现包括mRNA、microRNA、lncRNA等多种类型RNA上的m5C修饰在肿瘤的发生发展中发挥重要的调控作用,m5C甲基转移酶NSUN4,识别蛋白ALYREF等和肝癌的预后密切相关[18]。研究发现相较于癌旁组织,癌组织中H19 lncRNA的表达水平明显升高,进一步研究发现这是由于NSUN2介导的H19 lncRNA上的m5C修饰可以使H19 lncRNA的稳定性升高。具有m5C修饰的H19 lncRNA可以特异性结合G3BP1蛋白,进一步导致癌蛋白Myc的积累,促进肝癌的发生及发展[19]。
2.5 m5C甲基化在肺癌中的作用在肺腺癌中,有研究报道NSUN1存在高表达,且可以用作判断预后的标志物[20]。还有研究报道,m5C识别蛋白YBX1的表达量和肺癌细胞对顺铂的敏感性有关,在非小细胞肺癌细胞中敲减YBX1可以通过抑制自噬进而增加细胞对顺铂的敏感性[21]。
2.6 m5C甲基化在胃癌、大肠癌和结直肠癌中的作用有多项研究表明,在胃癌和结直肠癌中,NSUN2存在异常高表达,且和患者的不良预后密切相关[22]。NSUN2的过表达促进了肿瘤细胞的增殖和迁移,而敲减NSUN2则可以抑制这些过程[23]。进一步的研究发现,抑癌基因p57作为NSUN2的下游靶点影响了肿瘤细胞的增殖能力。在细胞中,p57的表达和NSUN2的表达呈负相关,高表达的NSUN2通过催化p57 mRNA的3 ′UTR区域发生 m5C甲基化降低了mRNA的稳定性,抑制了p57的表达,促进肿瘤细胞的增殖[24]。另有研究表明在HeLa细胞系中敲除NSUN2会影响细胞对5-氟尿嘧啶的敏感性,说明NSUN2可能与肿瘤对药物的敏感性以及耐药有关。此外,NSUN5在大肠癌中明显高表达,研究表明在大肠癌细胞系中敲除NSUN5后会通过抑制细胞周期蛋白依赖激酶(CDKs)信号传导造成细胞周期阻滞,显著抑制细胞增殖[25]。
2.7 m5C甲基化在血液肿瘤中的作用m5C去甲基化酶TET是血液系统恶性肿瘤中的高频突变基因之一,TET2突变会导致B细胞的发育以及正常的造血功能受损[26]。已有多项研究表明,TET2作为抑癌基因起到肿瘤抑制的作用,TET2敲除的小鼠会出现慢性粒单核细胞白血病和骨髓增生性肿瘤,表明TET2抑制肿瘤中发挥关键作用[27]。另有研究报道,在白血病中m5C甲基转移酶NSUN1通过和BRD4相互作用改变染色质结构从而影响肿瘤细胞对化疗药物5-氮杂胞苷的敏感性[28]。
2.8 小结综上所述,m5C甲基化及其相关的修饰酶和识别蛋白在肿瘤发生发展过程的多个环节均发挥着重要的调控作用,且一种甲基化转移酶在不同的肿瘤类型可能发挥着不同的作用。例如,虽然大多数m5C甲基转移酶在肿瘤中高表达,发挥促进肿瘤细胞增殖的作用[4,20]。但也有m5C修饰酶在肿瘤中低表达,同时伴随着较差的预后[29]。因此特定位点m5C修饰以及不同的m5C修饰酶在肿瘤中发挥的具体作用仍有待深入研究。
3 展望
目前,对于m5C甲基化在各种RNA中的分布特征以及m5C修饰的生物学功能已经有了初步的认识。因此未来的研究任务主要集中在特定m5C甲基化位点的功能和发现新的识别蛋白,以及m5C修饰在肿瘤等疾病中发挥的具体作用。目前对一些m5C甲基化修饰酶和识别蛋白的蛋白晶体结构以及其与RNA结合的结构域已经有了较为清晰的研究[4],以m5C甲基化相关修饰酶作为靶点的抑制剂研究已成为关注热点。此外,已有多项研究表明,m5C相关修饰酶可以作为肿瘤的诊断标志物[18,20,22],而特定位点的m5C修饰作为肿瘤标志物尚需进一步探索。总之,m5C甲基化在肿瘤发生发展中的调控作用逐渐被揭示,将为肿瘤的诊断和个体化治疗提供新的思路。

