抗HBV天然化合物作用机制的研究进展
相佳瑶,许 敏,冯 阳
(昆明理工大学生命科学与技术学院,云南 昆明 650000)
乙型肝炎病毒(hepatitis B virus,HBV)为嗜肝DNA病毒,HBV感染会引发乙型病毒性肝炎,如果缺乏及时有效的治疗,会导致肝纤维化、肝硬化和肝细胞癌(hepatocellular carcinoma,HCC)等严重后果,甚至危及患者生命[1]。尽管疫苗能有效预防HBV的感染,但是疫苗对已经感染HBV的患者无效。目前仍存在大量HBV感染患者,据世界卫生组织估计,全世界约有2.57亿人为慢性乙肝病毒感染者[2]。现在临床上使用的抗HBV药物主要有干扰素(interferon,IFN)与核苷(酸)类药物两大类,分别通过调节免疫和干扰乙肝病毒的复制过程来发挥作用,但是核苷(酸)类药物产生的耐药性问题和IFN的副作用一直是当前治疗HBV的局限所在,临床仍缺乏能治愈HBV感染的有效药物。因此,继续研究和开发新颖且有效的抗HBV药物,寻找干预HBV感染和复制的新靶点和新方法仍是非常有必要也非常有意义的研究工作。
天然化合物因其结构的多样性和复杂性是发现新药或新的药物先导分子的重要源泉[3]。中国传统医学记载了将一些中草药用于乙型病毒性肝炎的治疗[4-6];在现代药学的相关研究中,有很多研究报道了天然化合物具有抑制HBV活性,并对其作用机制进行了深入研究。本文从天然化合物调控HBV自身因子和调控宿主相关因子两方面,对近年来关于天然化合物抗HBV作用机制研究的情况进行总结,以期为抗HBV新药的研发提供一定的参考。
1 HBV的形态及感染过程
HBV属于嗜肝DNA病毒科(hepadnavividae),是一种DNA包膜病毒,基因组为3.2 kb的部分双链环状DNA(relaxed circular DNA,rcDNA)。其感染宿主的过程大概为:HBV与细胞表面受体结合后进入细胞,在核孔处核衣壳分解释放出rcDNA进入宿主细胞核;在DNA聚合酶等的作用下[7],rcDNA的缺口被补齐,形成共价闭合环状DNA (eovalently closed circular DNA,cccDNA)。随后,宿主细胞内的RNA聚合酶II以cccDNA为模板转录出4种mRNA,其中最长的转录物为前基因组RNA(pgRNA),除了作为翻译的模板外,还作为病毒反转录模板合成新的rcDNA。新形成的rcDNA与核心蛋白形成成熟的核心颗粒,再裹上包膜蛋白成为成熟的病毒颗粒分泌到细胞外。另外一小部分核心颗粒脱去核衣壳回到细胞核,再次转化为cccDNA储存在肝细胞核中[8]。
概括来说,HBV的生命周期主要包括感染、脱壳、转录复制、装配和释放(Fig1)。从理论上讲,上述病毒周期的每个步骤均可作为抗肝炎药物筛选的靶标。然而,由于HBV的独特性,直接作用于HBV生命周期的分子总会被耐药性和毒性困扰。随着分子生物学的发展,发现了间接干扰HBV生命周期的靶点或是诱导宿主积极应对的机制[9-13]。例如,钠离子-牛磺胆酸共转运多肽(NTCP),HBV衣壳蛋白的装配(核心蛋白二聚化基序及装配结构域的N-端149个氨基酸残基没有人体蛋白质同源序列),HBV生命周期息息相关的宿主蛋白Hsp70,与机体免疫相关的Toll-like受体等,为抗HBV提供了新的靶点。
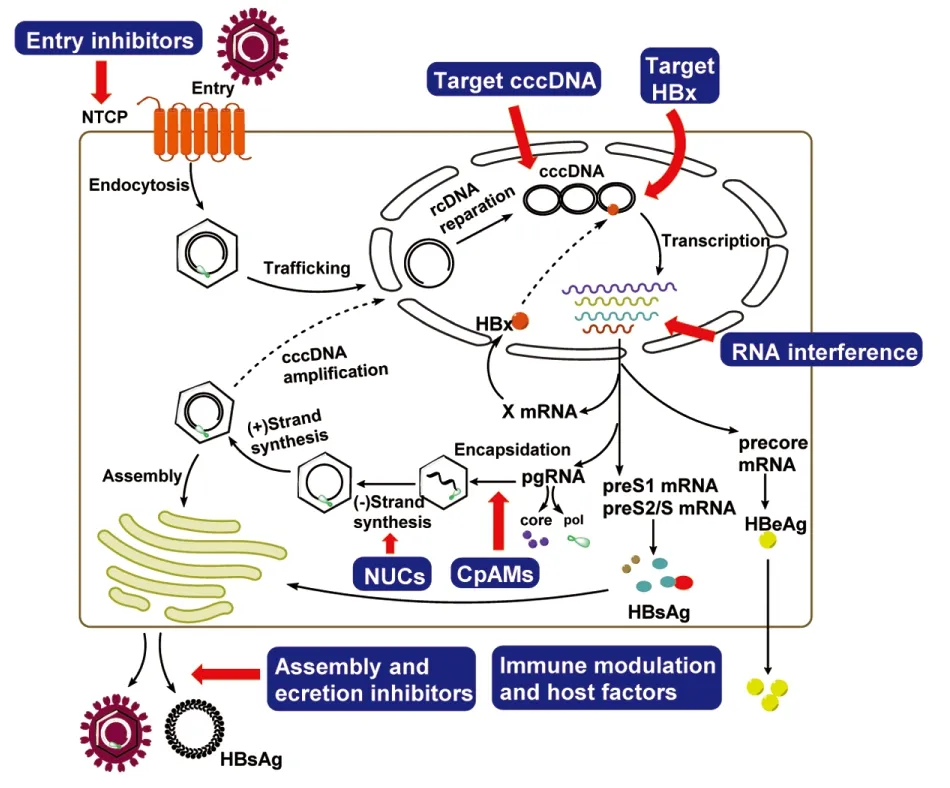
Fig 1 The hepatitis B virus life cycle and therapeutic interventions
2 天然化合物抗HBV作用机制研究进展
自然界中天然产物的结构丰富,生物多样性丰富。迄今为止,发现了许多的抗HBV活性的天然分子,骨架类型涉及萜类、木脂素类、生物碱类、酚酸类和黄酮类等[14]。但是,开展了系统作用机制研究的天然分子不多,也未见综述系统讨论天然分子抗HBV作用机制的研究进展。因此,本文将从靶向HBV自身生命周期和宿主细胞相关蛋白两方面,总结天然产物抗HBV的活性和作用机制。
2.1 通过调节HBV自身的生命周期而发挥抗HBV活性Huang等[15]从天胡荽(Hydrocotylesibthorpioides)中发现积雪草苷(asiaticoside)能显著抑制HBsAg、HBeAg、HBV DNA和cccDNA的形成,且呈剂量依赖性。通过对其作用机制的初步探索发现,积雪草苷可能通过抑制C、S和X基因启动子的活性来影响相应基因的转录和病毒的复制。此外,当使用感染乙肝病毒的鸭来评估积雪草苷的抗HBV活性时,发现积雪草苷可以有效抑制DHBV在鸭体内的复制。有趣的是,终止药物治疗3 d后的结果表明,积雪草苷在鸭体内的抗HBV作用在抑制HBV DNA、HBsAg和HBeAg反弹方面比拉米夫定更有效。这一发现表明积雪草苷的长时间活性可能具有重要的临床意义。
Wang等[16]发现从白首乌(Cynanchumauriculatum)中分离出来的告达亭苷元(caudatin)有抑制HBsAg分泌和HBV DNA复制的活性,在告达亭苷元基础上做了化学修饰合成了一系列新的化合物,发现化合物3-O-(3,4,5-三甲基)肉桂酰基告达亭苷元(3-O-(3,4,5-trimethoxy)cinnamoyl caudatin)对HBsAg、HBeAg的分泌和HBV DNA复制具有显着抑制活性,IC50分别为5.52、5.52、2.44 μmol·L-1。初步的机制探索发现,3-O-(3,4,5-三甲基)肉桂酰基告达亭苷元可能是通过干扰HBV X启动子和增强子I来影响X基因的转录从而发挥抗病毒作用。考虑到最小X启动子序列与增强子I的3'端有大约20个核苷酸重叠,推测3-O-(3,4,5-三甲基)肉桂酰基告达亭苷元同时影响了重叠区域的X启动子和增强子I。
从台湾杉中(Taiwaniacryptomerioides)分离出的HE-145(helioxanthin)及其类似物曾被报道能降低HBV DNA和RNA的水平,并且减少了核心蛋白的表达[17-18]。进一步探索HE-145抗HBV的作用机制,利用荧光素酶报告基因系统研究HE-145对4种病毒启动子活性的影响。结果表明,HE-145选择性抑制了S基因启动子II (SPII)和C基因启动子(CP),但对S基因启动子I (SPI)和X基因启动子(Xp)无影响。在非肝细胞如293T细胞和HeLa细胞中未观察到HE-145对SPII或CP启动子的抑制,这表明HE-145对SPII和CP的抑制作用可能是肝特异性的。HBV preC/C启动子/Enh II区域包含许多转录因子结合位点,其中许多顺式元件已被证明在病毒基因表达中发挥关键作用。电泳迁移率试验(EMSA)表明,HE-145降低了HepA2 细胞核提取物与CP上几个顺式作用元件的DNA结合活性,包括α-甲胎蛋白转录因子结合位点、过氧化物酶体增殖剂激活受体(peroxisome proliferators-activated receptors,PPAR)结合位点和转录因子Sp1结合位点;过表达PPAR和肝细胞核因子4α(hepatocyte nuclear factor 4 alpha,HNF4α)可缓解HE-145对CP的抑制。这些结果表明,HE-145具有独特的抗HBV机制,可能成为一类新型的潜在抗HBV药物。
2.2 通过调节宿主细胞相关因子而发挥抗HBV活性Pang等[19]发现绿茶中的表没食子儿茶素没食子酸酯(epigallocatechin-3-gallate,EGCG)能显著抑制HepG2.2.15细胞分泌HBsAg和HBeAg,并且呈剂量和时间依赖性;同时EGCG还显著降低了细胞外HBV DNA的表达水平。此外Huang等[20]研究发现EGCG(50 μmol·L-1)能抑制80%以上的HBV进入永生化人原代肝细胞,并能显著抑制HBV对表达HA-NTCP的Huh7细胞和HuS-E/2细胞的感染。用EGCG处理表达HA-NTCP的Huh7细胞,导致其中HA-NTCP蛋白的表达降低,进一步对细胞膜上的HA-NTCP表达情况进行分析发现,EGCG处理显著诱导了NTCP从细胞这膜向细胞质的转运,表明EGCG可能诱发了NTCP的内吞和降解。
Yao等[21]研究发现从白头翁(Pulsatillachinensis)中提取的桦木酸(betulinicacid,BetA)有抑制HBV DNA复制的作用。在来自HBV转基因小鼠的肝细胞中,桦木酸通过下调超氧化物歧化酶(superoxide dismutase 2,SOD2)的表达来显著抑制HBV的复制,并导致活性氧自由基生成和线粒体功能障碍。进一步的研究发现,BetA是通过使cAMP反应元件结合蛋白(cAMP response element binding protein,CREB)的Ser133去磷酸化来抑制SOD2的表达,因为CREB的Ser133处于磷酸化状态时才能激活SOD2转录。过表达SOD2消除了BetA对HBV复制的抑制作用,而抑制SOD2表达则消除了这种作用,这些结果表明桦木酸介导的HBV清除是由于对线粒体氧化还原平衡的调节。在HBV转基因小鼠中的研究发现,BetA和白头翁粗提物均显著抑制了SOD2的表达、增强了肝组织中活性氧的产生,随后大量清除了HBV,这为上述关于BetA调节线粒体氧化还原平衡的推论提供了进一步的证据。
Huang等[22]在HepG2.2.15细胞和HBV感染的Huh7细胞中的研究发现,从阔叶山麦冬(Liriopeplatyphylla)根部提取出的化合物3-(4'-羟基苄基)-5,7-二羟基-6-甲基苯并吡喃-4-酮(LPRP-Et-97543)具有潜在的抗HBV活性,对pgRNA和preS/S RNA的表达水平有明显的抑制,并能显著降低C、S、preS等基因启动子活性,但对X基因启动子无影响。进一步的转录调控分析发现,LPRP-Et-97543特异性抑制了NF-κB的启动子活性,降低了p65/p50的蛋白表达水平,同时增加了NF-κB抑制物IκBα的蛋白水平。NF-κB活性被抑制从而影响了其对HBV相关基因转录的激活作用。总的来说,该研究发现LPRP-Et-97543可能通过干扰宿主细胞NF-κB信号通路进而抑制HBV基因表达来发挥抗HBV的作用。
Wu等[23]从六棱菊[Laggeraalata(D.Don)Sch.-BipexOlivier]中分离出的化合物3,4-O-二咖啡酰奎尼酸(3,4-O-dicaffeoylquinic acid)和化合物3,5-O-二咖啡酰奎尼酸(3,5-O-dicaffeoylquinic acid)[24]能显著抑制HBV HBsAg和HBeAg的生成。在HepG2.2.15细胞和HBV转基因小鼠中,3,4-O-二咖啡酰奎尼酸和3,5-O-二咖啡酰奎尼酸能显著降低HBV cccDNA的含量,并显著诱导血红素氧合酶-1 (heme oxygenase-1,HO-1)的表达。在肝细胞中,过表达HO-1能显著降低HBV核心蛋白的稳定性,并在转录后阶段有效抑制HBV的复制,阻断细胞核中HBV cccDNA的重新填充,从而导致cccDNA含量减少;运用RNAi技术降低细胞中HO-1基因表达后这种效应被逆转,这些研究结果表明HO-1确实介导了3,4-O-二咖啡酰奎尼酸和3,5-O-二咖啡酰奎尼酸的抗HBV作用[25]。
天然酚类化合物姜黄素(curcumin)被发现可以抑制HBV基因的表达和复制。Rechtman等[26]研究发现这种抑制作用是通过下调过氧化物酶体增殖物激活受体γ共激活因子-1α(peroxisome proliferator activated receptorγcoactivator-1α,PGC-1α)来介导的。PGC-1α是一种饥饿诱导蛋白,可以启动糖异生级联反应,并被证明可以有效地协同激活HBV转录。实验表明姜黄素在蛋白水平影响了PGC-1α,通过促进PGC-1α蛋白的降解来抑制HBV。此外研究还发现姜黄素可以与抗HBV核苷酸/核苷类似物协同工作,增强对HBV基因表达的抑制。姜黄素作为宿主靶向治疗HBV感染,可以补充目前的病毒特异性治疗。
来自于苦参植物(Sophorajaponica)的氧化苦参碱(oxymatrine,OMTR))在中国用于治疗乙型肝炎患者已有数十年,其安全性已得到证实。热激同源蛋白70(Hsc70)是HBV复制所必须的一种宿主蛋白。研究发现OMTR可通过破坏Hsc70 mRNA的稳定,在转录后水平显著下调宿主Hsc70 mRNA的表达,进而在逆转录阶段抑制HBV从pgRNA到DNA的从头合成,从而表现出抗HBV的效果。由于这个靶点不是病毒蛋白,OMTR对野生型HBV或耐逆转录酶(RT)抑制剂的菌株都有活性。此外,敲除Hsc70基因的小鼠未显示异常,该表明抑制Hsc70后安全性良好[27-28],这也为OMTR进一步作为抗HBV药物开发提供了一个很好的依据。
盐酸千金藤碱(Cepharanthine hydrochloride,CH)是一种天然生物碱衍生物。Zhou等[29]研究发现该化合物能以剂量依赖的方式抑制野生型或拉米夫定耐药型HBV临床分离株的DNA复制和HBeAg的分泌,这表明该化合物可能是治疗拉米夫定耐药的慢性乙型肝炎患者的一种新的替代药物。进一步研究发现,CH抑制宿主Hsc70 mRNA表达与抑制细胞内HBV复制的作用是平行的,说明CH可能是通过下调宿主Hsc70表达来抑制HBV的复制。
Huang等[30]发现从青蒿(Artemisiamorrisonensis)中分离得到的化合物对羟基苯乙酮(p-hydroxyacetophenone,PHAP)能显著抑制HBsAg的分泌和HBV DNA的表达水平。在转染了HBV的Huh7细胞中,PHAP处理后病毒表面基因的2.4kb preS RNA相对于2.1kb S RNA明显增加。启动子活性分析结果表明,PHAP可以增强病毒preS启动子的活性,HBV的大表面蛋白的表达随之增加并引发内质网应激(ERS)。PHAP特异性降低了Huh7细胞中内质网应激相关的GRP 78的基因和蛋白水平,同时还导致病毒在细胞内的明显积累。此外,用毒胡萝卜素(ER伴侣诱导剂)处理减轻了PHAP对细胞上清液中HBV DNA水平的抑制作用。根据以上结果推测,PHAP的抗HBV机制可能是通过干扰内质网应激信号通路,调控病毒表面基因表达和阻断病毒粒子分泌。
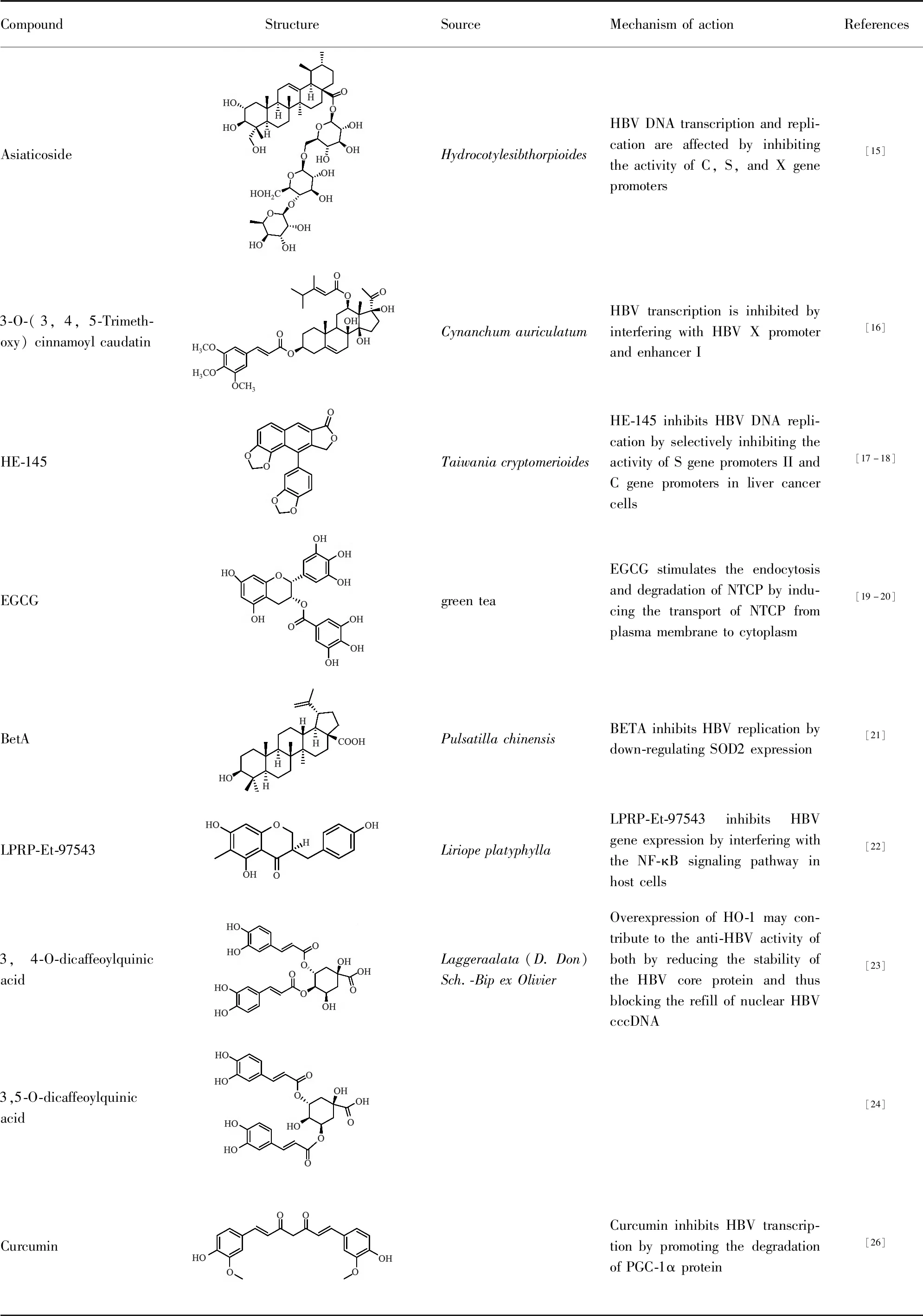
Tab 1 Summary of mechanism of action of anti-HBV natural products
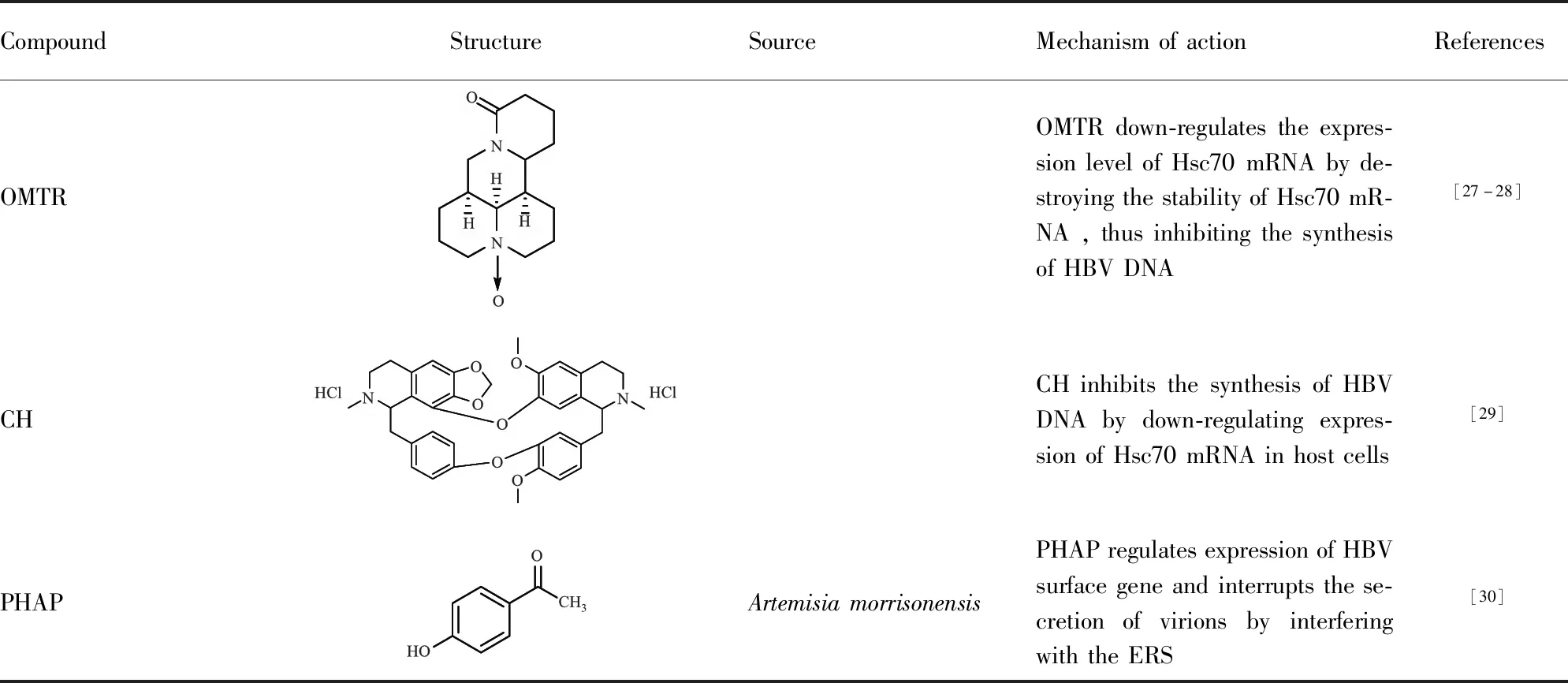
CompoundStructureSourceMechanismofactionReferencesOMTROMTRdown-regulatestheexpres-sionlevelofHsc70mRNAbyde-stroyingthestabilityofHsc70mR-NA,thusinhibitingthesynthesisofHBVDNA[27-28]CHCHinhibitsthesynthesisofHBVDNAbydown-regulatingexpres-sionofHsc70mRNAinhostcells[29]PHAPArtemisiamorrisonensisPHAPregulatesexpressionofHBVsurfacegeneandinterruptsthese-cretionofvirionsbyinterferingwiththeERS[30]
3 结语
到目前为止,临床上还没有有效的药物或方法可以治愈乙肝病毒感染性疾病。因此,抗乙肝病毒药物的研发仍然是当务之急。从目前研究发现的天然化合物抗HBV作用机制来看,大部分活性化合物是通过作用于宿主相关因子来抑制病毒在细胞中的复制,或是通过调控病毒S、C和X基因启动子的活性来调控病毒自身因子而影响病毒的复制。但是发现抗HBV活性化合物直接作用靶点的报道还非常少,而且专注于发现抑制病毒某个生命周期阶段的研究也比较缺乏。比如,cccDNA在细胞中的持续存在是HBV形成慢性感染的一个重要原因,如果专注以筛选抑制rcDNA到cccDNA形成阶段或者抑制rcDNA的再形成再补充cccDNA的阶段的活性化合物为目标,可能会在抗HBV新药研发方面有新的突破。
综上所述,关于天然产物抗HBV的新作用机制或新靶点的报道并不多。许多天然产物被报道显示出显著的抗HBV作用,但它们仅限于基于细胞或转基因小鼠的研究,但具体的作用机制并不清楚,靶标蛋白不明确。此外,也有很多文章报道了天然化合物的潜在抗乙肝病毒的活性,但没有开展构效关系讨论或是进一步的结构修饰和改造,很难为后续的靶点和作用机制的系统深入研究提供支撑。因此,非常有必要通过化学生物学等学科交叉的手段,深入系统开展活性天然产物的靶点和作用机制的深入研究,推进天然抗HBV新先导分子的发现或是乙肝病毒新靶点的发现。

