感染性胰腺坏死的诊治进展
申鼎成,黄耿文
(中南大学湘雅医院胰腺外科,湖南长沙410008)
急性胰腺炎(acute pancreatitis,AP)是最常见的消化系统疾病之一。最新统计显示,全世界每10 万人群中新发病例数为5~30 例,且近年来发病率有逐年上升的趋势[1]。约10%~20%的AP 患者将发展成坏死性胰腺炎,这其中又有近1/3 的患者会继发感染性胰腺坏死(infected pancreatic necrosis,IPN)。随着重症医学水平的提高,AP 患者早期死于器官功能衰竭的比例逐渐下降,而后期胰腺坏死积液继发感染正成为威胁患者生命最主要的原因。IPN 的总体病死率高达8%~39%,是AP 最严重的并发症之一[2]。随着治疗理念和技术的不断更新,IPN 的并发症和病死率虽有所下降,但其诊断和治疗仍极具挑战。近年来,针对IPN 的诊断、病原学特点及治疗,国内外各大中心陆续发表一批高质量临床研究论文,本文结合笔者单位的临床实践经验对这些进展做一概述。
1 IPN的诊断进展
IPN 主要包括病程早期的急性坏死物积聚(acute necrotic collection,ANC)合并感染和后期的包裹性坏死(walled-off necrosis,WON)合并感染。及时准确地诊断IPN 将为后续采取针对性的治疗提供重要依据。坏死性胰腺炎患者在病程后期(起病3~4 周之后)出现反复发热、腹痛腹胀加重等临床症状或出现全身情况恶化,如器官功能不全等,是诊断IPN 的间接证据。动态监测白细胞计数、C 反应蛋白、白介素6(IL-6)以及降钙素原等炎症指标的进行性升高对IPN 的诊断具有较强的提示作用。然而,目前临床上尚无统一的评分系统或标志物能对IPN 进行早期诊断。既往,胰周坏死积液细针穿刺抽吸做病原学检查是诊断IPN 的金标准,但因其属有创性操作且假阴性率较高,故而近年来指南均不推荐常规使用。现阶段,影像学检查对判断感染范围、评估严重程度以及选择后续干预措施具有至关重要的作用,CT 检查出现“气泡征”是诊断IPN 的直接证据(图1)。而外科或内镜干预时获取引流液或坏死组织进行病原学检查则成为诊断IPN 的金标准。
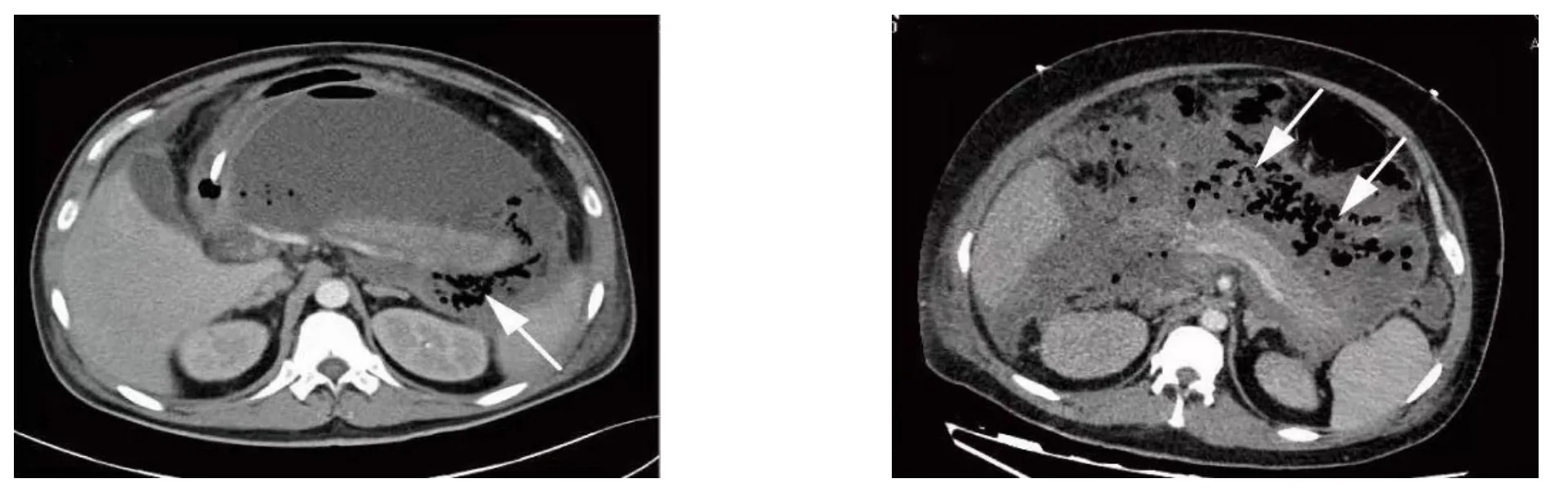
图1 典型的“气泡征”影像学表现Figure 1 Imaging manifestations of typical gas bubble sign
鉴于目前大多数指南及共识均推荐对IPN 进行延迟性干预的治疗策略,早期获取胰腺周围积液或坏死物进行病原学检查存在较大困难。因此,对于临床疑似IPN 的患者行外周血病原学检查成为早期诊断IPN 的必然途径。然而,胰周感染继发血流感染率低,抗生素的使用等因素还会对血培养结果有较大的影响,因此,外周血培养在早期诊断IPN 中的作用并不显著。近年来,宏基因组二代测序技术(metagenomic next-generation sequencing,mNGS)作为一种新型的病原学诊断方法逐渐在临床上得到应用,其通过测序的原理将待测外周血样本序列信息与微生物基因库进行对比,理论上能无偏倚的检测出血样本中的所有病原体,尤其适用于复杂、罕见、危重的感染性疾病的病因诊断[3]。mNGS 在中枢神经系统、呼吸系统以及循环系统感染性疾病的诊断中已表现出了重要的临床价值,然而其在IPN 诊断中的应用价值仍有待进一步研究。笔者单位正在进行的一项单中心前瞻性临床研究,前期纳入35 例临床疑似IPN 的病例,其中21 例通过胰周引流液病原学结果最终确诊IPN。初步研究结果显示血mNGS 诊断IPN 的敏感度明显高于血培养(95.2%vs. 23.8%,P<0.001),两者诊断IPN 的特异度无统计学差异。与血培养相比,血mNGS 诊断IPN 病原学相符率高、检测时间缩短近2/3、检测费用仅占患者总治疗费用的1.3%左右,具有较大的临床应用前景[4]。因此,有学者[5]推测,mNGS 因其快速、敏感、不易受外界干扰等优势,有望部分取代常规病原学培养成为早期诊断感染性疾病的常规手段。
2 IPN的病原学变化
既往的临床研究显示,IPN 的病原菌主要包括各种敏感的革兰氏阴性和阳性细菌,尤其以肠源性细菌比例最高。近年来,随着广谱抗菌药物的广泛使用所造成的选择性压力、全胃肠外营养、长时间住院、留置静脉导管针以及各种侵入性操作的增加等因素,在全世界范围内,坏死性胰腺炎合并多重耐药菌(multi-drug resistant organisms,MDRO),尤其是耐碳青霉烯肠杆菌(carbapenemresistant enterobacteriaceae,CRE)感染以及真菌感染的比例正在逐年升高,给IPN 患者的治疗带来严峻的挑战。笔者单位通过历时近10年的前瞻性队列研究,对IPN 的病原学变化和耐药现象及其对IPN 患者预后的影响进行了系统分析。研究[6]结果发现,MDRO 感染病例占全部IPN 病例的57.4%(108/188),分离出的病原菌株中,MDRO 比例为27.4%(138/504)。而这一现象在危重型胰腺炎(critical acute pancreatitis,CAP) 患者中愈发严峻,CAP 患者中高达52.4% (109/208) 的病原 菌株为MDRO[7]。由于近年来碳青霉烯类抗生素作为一线的经验性药物使用越来越普遍,CRE 的出现和流行使得IPN 患者的治疗面临越来越多的困难。笔者所在单位的数据表明,CRE 已成为IPN 患者的主流病原菌,占比达26.3%,且CRE 感染病例的比例从10年前的11.7%逐年升高至近2年的35.8%,其危害和影响应引起临床高度重视[8]。除此之外,IPN 中的真菌感染也值得重视。近期,一项前瞻性队列研究[9]发现,高达29.4%的IPN 患者合并腹膜后真菌感染,且5.5% 的患者合并念珠菌血流感染。最近一项纳入22 项研究的荟萃分析[10]也发现近似的结果,IPN 患者合并胰周真菌感染的比例达到26.6%(572/2 151)。由此可见,IPN 患者合并真菌感染的机会不低。
病原学的不断变化对IPN 患者的治疗和预后带来极大的影响。合并MDRO 和CRE 感染的患者往往病情更严重、外科干预次数增多、ICU 住院时间和总的住院时间明显延长、住院费用增加,且总体并发症发生率和病死率明显升高[6,8,11]。对于耐药菌感染的IPN,抗生素的应用策略尤为重要。建议优先考虑根据药敏结果选用敏感抗生素。在未获得药敏结果之前,碳青霉烯类抗生素可作为治疗MDRO 感染的一线经验性用药。一旦感染源得到有效控制,抗生素宜短程使用[12]。一味延长抗生素使用时间,不仅无效,反而徒增费用和不良反应。而合并真菌感染虽然并不增加IPN 患者的病死率,但与肠瘘等并发症的发生、住院时间延长等密切相关。尤其是当合并真菌血症时,患者的病死率会明显升高[9-10]。上述研究结果提示,病原学的变化将是长期的、动态的。医疗机构应该规范和严格管理诊疗行为,尽最大可能避免或减少抗生素的不合理使用,遏制耐药菌的产生。
3 IPN的内镜治疗
自1996年美国学者Baron 等[13]首次报道内镜下治疗胰腺坏死后,随着内镜技术和设备的不断改进和发展,内镜下升阶梯胰周清创引流术在IPN 的治疗中发挥着越来越重要的作用。近年来,多项高质量临床随机对照研究对内镜升阶梯和外科微创升阶梯的疗效进行了比较。来自荷兰的一项多中心研究[14]报道,尽管内镜升阶梯和外科微创升阶梯在病死率和主要并发症发生率等方面无明显统计学差异(43%vs. 45%),但内镜升阶梯组住院时间明显缩短(53 dvs. 69 d)、胰瘘发生率显著降低(5%vs. 53%)。此外,美国的一项单中心随机对照研究[15]也证实,虽然内镜升阶梯相较于外科微创升阶梯在病死率(8.8%vs. 6.3%)和新发器官功能不全(5.9%vs. 9.4%)、新发糖尿病(27.3%vs.36.0%)和胰腺外分泌功能不全(85.3%vs. 87.5%)的发生率无明显差别,但在总体并发症发生率(11.8%vs. 40.6%)、胰瘘发生率(0vs. 28.1%)、治疗费用以及整体生活质量方面,内镜升阶梯更具有优势[15]。这些试验研究结果可能会促进内镜升阶梯疗法成为治疗IPN 的首选方案。
内镜技术和材料的发展也日新月异。大多数专家推荐,超声内镜引导下经胃肠壁胰周引流更为安全,尤其是对于预防出血等并发症优势明显[16]。内镜下放置塑料支架引流在临床上应用广泛,其操作简便,且能有效地预防胰管断裂综合征所引起的持久性囊肿形成或长期胰瘘。近年来,大口径(>15 mm)自膨胀金属支架越来越受到内镜医生的青睐。通过自膨胀金属支架,坏死组织排出更顺畅,内镜医生可以通过支架通道进行反复的内镜清创。因此,最新指南推荐经内镜透壁引流中,自膨式金属支架效果优于塑料支架[2]。然而,自膨胀金属支架可能引起的并发症也不容忽视,如延迟性消化道出血、消化道瘘等,而且该支架需再次内镜手术取出等弊端也不容忽视[17]。经内镜下抗生素和过氧化氢溶液灌洗等用于控制感染和促进引流的方式也有尝试,但因缺乏与安慰剂相对照的临床研究,故暂时不予临床推荐。随着内镜治疗IPN 的不断应用,未来需要更多基于循证医学的证据来使内镜治疗的方案更加标准化。
内镜治疗IPN 的最佳适应证是中央型包裹性胰腺坏死积液。内镜治疗的主要优势在于能降低胰瘘、出血和切口疝等并发症的发生率,避免经皮穿刺或清创手术后需要长期携带引流管造成的生活不便。但内镜清创术往往需要多次操作,且对于液化不彻底、坏死组织较多的病例清创效率往往不高,因而并不适用于所有的IPN 患者。对于双侧结肠后间隙以及盆腔腹膜后间隙的处理,外科经皮引流或清创的优势更为明显。同时,考虑到内镜治疗的学习曲线长、操作难度大,往往需要有经验的内镜医生且需要使用大量的高值耗材等不足,限制了其在临床上的广泛推广。现阶段外科引流或清创术仍是大多数医疗中心治疗IPN 的首选策略。笔者认为,在大多数医疗中心,内镜治疗可作为外科干预的有效补充,而在高水平的内镜治疗中心,内镜治疗可以成为治疗IPN 的主流方式。
4 IPN的外科治疗
IPN 的外科治疗策略、方式以及时机一直都是胰腺外科研究的热点。既往,以开腹胰腺坏死组织清除术(open pancreatic necrosectomy,OPN) 和规则性胰腺切除术为代表的传统外科手术是治疗IPN 的金标准。然而,OPN 往往伴随着较高的并发症率(30%~98%) 和病死率(20%~40%)。近年来,随着外科治疗理念和技术的不断进步,包括经皮穿刺置管引流(PCD)[18]、微创入路腹膜后胰腺坏死组织清除术(MARPN)[19-20]、视频辅助下腹膜后清创引流术(VARD)[21]以及腹腔镜下经胃胰周清创引流术(LTN)[22]等在内的各种微创外科方法应用于临床,使IPN 的治疗策略发生了重大转变,升阶梯策略成为目前治疗IPN 的主流。2010年,来自荷兰的一项具有里程碑意义的多中心PANTER 临床随机试验[23]表明,与OPN 相比,微创升阶梯治疗策略可显著降低IPN 患者的病死率和主要并发症率,减少新发多器官衰竭、切口疝以及胰腺内外分泌功能不全的发生率。通过对上述病例近7年的长期随访,后续研究进一步证实微创升阶梯组患者具有更优的远期预后[24]。其它多项多中心大样本临床研究也证实,微创升阶梯治疗策略较OPN在治疗重症或高危IPN 患者中具有明显的优势,能显著改善此类IPN 患者的临床预后[25-26]。然而,值得一提的是,并非所有的IPN 患者均应采取升阶梯治疗策略。在微创的时代背景下,OPN 在IPN 的治疗中仍占据着不可替代的地位。对部分全身状态较好的IPN 患者,微创治疗策略反而延长治疗周期、增加外科干预频次。因此,新版指南推荐可考虑行“一步法”或“跨域式”OPN 干预理念。只不过在现阶段,作为升阶梯治疗模式的终极手段,OPN 地位仍至关重要。外科医生在选择OPN手术时应该把握好手术指征[27],当出现无PCD 穿刺路径、虽经积极的微创手术仍无法控制的严重感染、合并严重腹腔内并发症(如大出血和肠瘘等)以及出现广泛胰周坏死,OPN 几乎是最有效的选择。同时,也更应注意把握手术时机,充分利用影像学的精准指导选择手术路径。并且,在手术操作过程中,应充分运用损伤控制的理念,避免过大范围的清创造成不可控制的大出血或肠瘘,手术目的在于通畅引流和适度清创,OPN 手术残留的坏死组织可以后续通过各种微创手术方法来进一步解决[28]。
外科干预时机是IPN 治疗领域的关键争议点之一。有时候,手术时机比手术技术更为重要。既往的研究表明,早期干预的病死率可以高达40%以上,而延迟手术可显著降低主要并发症发生率和病死率[29]。鉴于此,国内外指南均明确指出IPN外科干预时机应尽量延迟到发病4 周以后[2,30]。但是,IPN 延迟干预的策略是基于以往OPN 仍然占据主流地位的报道和实践。在以微创技术为核心的升阶梯策略下,IPN 外科干预的时机是否需要调整仍有待高质量临床研究的证实[31]。Trikudanathan等[32]前瞻性队列研究发现,早期内镜下“升阶梯”策略不仅不会增加坏死性胰腺炎患者的并发症率,反而能有效降低患者的总体病死率。近期,由中国急性胰腺炎临床试验团队(CAPCTG)发起的一项多中心、前瞻性临床随机对照研究,对合并早期持续性器官功能障碍的坏死性胰腺炎患者按照早期按需PCD 与延迟性干预两种策略进行对比,初步的结果显示,早期按需PCD 能带来一定的潜在临床获益[33-34]。后续完整的研究结果值得期待。
5 结 语
目前,IPN 的诊治已经走向多学科协作诊疗的模式。包括胰腺外科、消化内科、重症医学科、感染科等在内的多学科紧密合作和技术交融必将为IPN 的诊疗带来全新的面貌。在此基础上,广泛开展高质量的、多中心临床研究,用循证医学的数据来指导临床实践,不断提高IPN 的诊治水平,从而进一步改善IPN 患者的预后。

