sEH抑制剂激活EPCs促进梗死心肌Ⅷ因子生成的研究*
王振河,姜德谦,许丹焰△
(1.厦门大学附属第一医院心内科,福建厦门 361003;2.中南大学湘雅二医院心内科,长沙 410011)
环氧二十碳三烯酸(epoxyeicosatrienoic acids,EETs)可促进缺血组织生成新生血管[1],可溶性环氧化物水解酶(soluble epoxide hydrolase,sEH)可导致细胞内EETs被迅速降解[2]。因此,使用sEH抑制剂可抑制EETs迅速降解,有效增加EETs在细胞内浓度和效用[3-4]。内皮祖细胞(endothelial progenitor cells,EPCs)表达过氧化物酶增殖体激活受体-γ(peroxisome proliferator activated receptor-γ,PPAR-γ)[5],且EETs是PPAR-γ内源性激动剂[6]。所以,sEH抑制剂t-AUCB可降低EPCs的EETs降解,增强EPCs的PPAR-γ表达水平及活性,促进EPCs对梗死心肌血管生成作用的影响。本研究通过检测t-AUCB干预的EPCs移植后不同时间点梗死心肌边缘区Ⅷ因子的表达情况,验证t-AUCB对EPCs促进梗死心肌血管生成功能的影响,现报道如下。
1 材料与方法
1.1 材料
80只清洁级实验雄性小鼠,6周龄,由中南大学湘雅二医院实验动物中心提供。EPCs表面分化抗原购自英国Beckmancoulte公司;免疫组织化学试剂购自美国Sigma-Aldrich公司,分析纯试剂;Ⅷ因子购自英国Beckmancoulte公司。
1.2 方法
1.2.1实验分组
直接注射不同浓度(0、1、10、50、100 μmol/L)t-AUCB的小鼠作为t-AUCB组。PPAR-γ阻断剂GW9662(5 μmol/L)预干预30 min后,再加入100 μmol/L t-AUCB干预的小鼠作为GW9662+t-AUCB组。
1.2.2EPCs的分离、培养
75%乙醇溶液处死小鼠,消毒,无菌条件下去除小鼠胫骨及股骨肌肉及皮毛,1 mL注射器抽取无菌生理盐水,冲出小鼠四肢长骨骨髓,密度梯度离心5 min,吸取中间单个核细胞,按5×105/mL密度转移至包被有大鼠Fibronectin 的细胞培养皿中,加入含5%胎牛血清和生长因子的EBM-2培养基,4 d后全量换液,隔天半量换液,倒置相差显微镜下观察不同时间点细胞形态。
1.2.3EPCs的鉴定
细胞培养7 d后,加入Dil-ac-LDL(10 mg/L)染色,观察细胞摄取Dil-ac-LDL结果;流式细胞仪检测EPCs表面分化抗原CD34、CD133、CD31、Flk-1表达情况。
1.2.4心肌梗死模型制作
小鼠用1%戊巴比妥钠腹腔注射麻醉,固定,气管插管,小鼠呼吸机辅助呼吸,行术前心电图检查;75%乙醇溶液消毒,沿着胸骨左缘5~6肋间隙剪开皮毛及肌肉、心包,暴露心脏,沿左心耳与肺动脉圆锥交界处下方2~3 mm处进针,深度为1~2 mm,7-0尼龙线结扎左前降支,缝合,观察小鼠心肌搏动及颜色是否发生变化,复查心电图,肌内注射青霉素2万单位,日光灯照下饲养。
1.2.5免疫组织化学
心肌梗死模型制作后1 h,尾静脉注射200 μL外周培养7 d的1×106/mL EPCs细胞悬液,于注射后1、3、7、14、28 d处死小鼠,开胸,取出心脏,洗净心腔血液,甲醛固定,切片,行免疫组织化学检测心肌梗死后各组梗死心肌边缘区Ⅷ因子表达情况。
1.3 统计学处理
2 结 果
2.1 小鼠EPCs的生长情况
离心分离至培养瓶时,培养瓶内的细胞呈悬浮状,种类繁多,少量可聚集;培养24~48 h,悬浮的细胞开始贴壁;培养4 d后倒去培养瓶内液体,倒置显微镜下观察,可见贴壁生长的细胞开始形成菊花状集落,集落形态表现为外周梭形细胞包围中央圆形细胞;培养7 d后中央圆形细胞逐渐向梭形细胞转化;培养8 d后开始出现索状细胞;培养10 d EPCs在培养板上逐渐融合,并向类圆形和多角形铺路石样细胞转化,见图1。
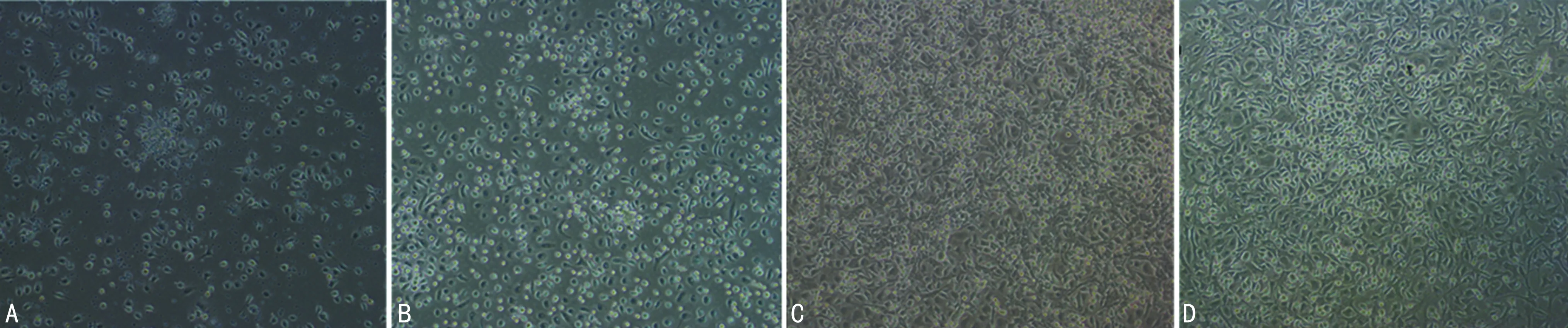
A:培养4 d;B:培养7 d;C:培养8 d;D:培养10 d。
2.2 小鼠EPCs摄取Dil-ac-LDL能力
培养的EPCs加入Dil-ac-LDL干预后,将细胞置于荧光显微镜下,EPCs摄取Dil-ac-LDL后显示红色荧光,结果显示Dil-ac-LDL细胞摄取率达95%以上,见图2。
2.3 小鼠EPCs表面分化抗原流式细胞仪鉴定结果
流式细胞仪检测小鼠EPCs细胞表面分化抗原表达情况,CD34为(53.89±0.34)%,CD133为(52.79±0.67)%,CD31为(36.67±0.93)%,Flk-1为(43.88±0.49)%。
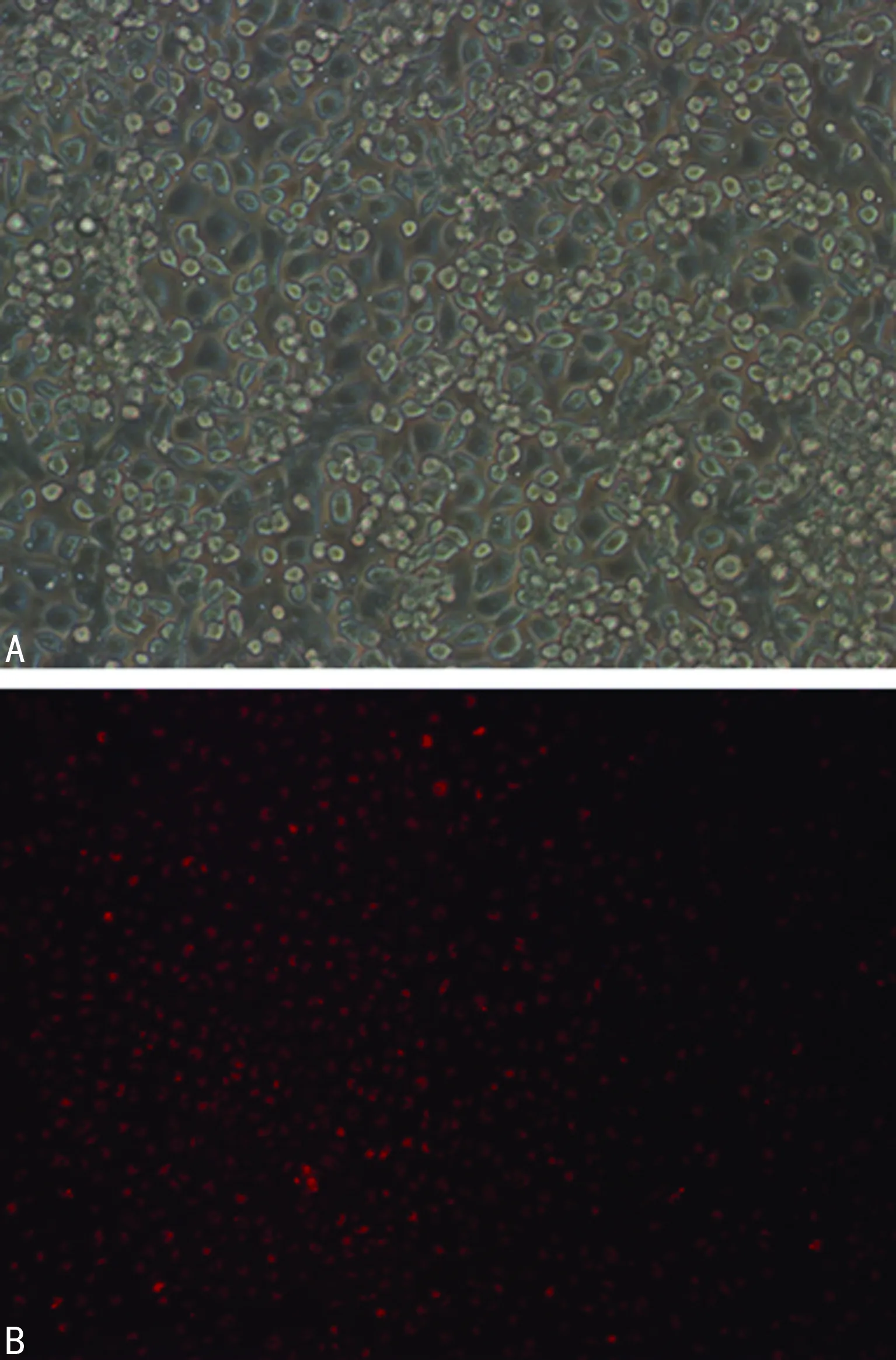
A:培养8 d未行Dil-ac-LDL干预细胞;B:干预后摄取Dil-acLDL阳性细胞,显示红色荧光。
2.4 制作小鼠心肌梗死模型及心肌梗死前后心电图变化
消毒麻醉及暴露心脏,结扎冠状动脉左前降支制作心肌梗死模型,结扎瞬间可见结扎部位以下心肌变白,活动幅度明显减弱。结扎冠状动脉左前降支前,前壁导联的ST段位于等电位线,结扎左前降支后复查心电图可见前壁导联的ST段抬高,损伤电流产生,表明心肌梗死模型制作成功,见图3。
2.5 不同浓度t-AUCB干预的EPCs注射后不同时间梗死心肌边缘区Ⅷ因子表达情况
2.5.1不同浓度t-AUCB干预的EPCs注射后1 d梗死心肌边缘区Ⅷ因子表达情况
0 μmol/L t-AUCB组可检测到少量Ⅷ因子表达,随着浓度增加,梗死心肌边缘区Ⅷ因子表达水平逐渐增加,GW9662+t-AUCB组较100 μmol/L t-AUCB组Ⅷ因子表达水平明显减少。与0 μmol/L t-AUCB组比较,1、10、50、100 μmol/L t-AUCB组Ⅷ因子表达水平明显增多(P<0.05);GW9662+t-AUCB组与0、100 μmol/L t-AUCB组比较,差异有统计学意义(P<0.05),见图4、表1。
2.5.2不同浓度t-AUCB干预的EPCs注射后3 d梗死心肌边缘区Ⅷ因子表达情况
0 μmol/L t-AUCB组3 d Ⅷ因子表达较干预1 d有所增加,但总体表达水平仍较少,随着浓度增加,梗死心肌边缘区Ⅷ因子表达水平逐渐增加,GW9662+t-AUCB组较100 μmol/L t-AUCB组,Ⅷ因子表达水平明显减少。与0 μmol/L t-AUCB组比较,1、10、50、100 μmol/L t-AUCB组Ⅷ因子表达水平明显增多(P<0.05);GW9662+t-AUCB组与0、100 μmol/L t-AUCB组比较,差异有统计学意义(P<0.05),见图5、表1。
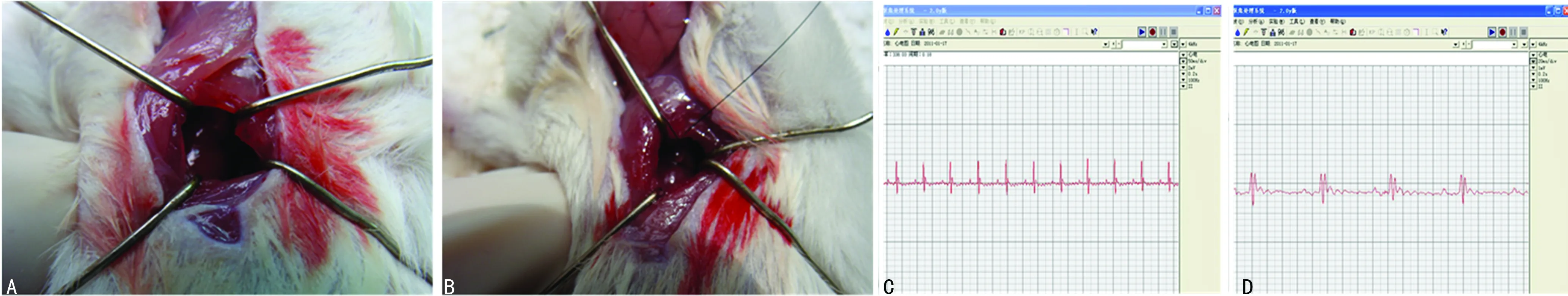
A:开胸,撑开心包,暴露左心耳;B:左心耳下1~2 mm处结扎冠状动脉左前降支;C:结扎前心电图;D:结扎血管后心电图。

表1 不同浓度t-AUCB干预的EPCs注射后不同时间点梗死心肌边缘区Ⅷ因子表达情况
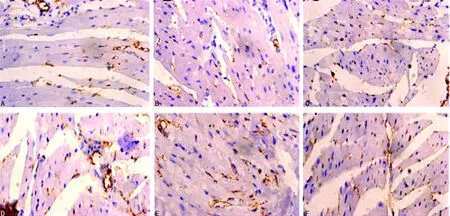
A:0 μmol/L t-AUCB组;B:1 μmol/L t-AUCB组;C:10 μmol/L t-AUCB组;D:50 μmol/L t-AUCB组;E:100 μmol/L t-AUCB组;F:GW9662+t-AUCB组。
2.5.3不同浓度t-AUCB干预的EPCs注射后7 d梗死心肌边缘区Ⅷ因子表达情况
0 μmol/L t-AUCB组7 d Ⅷ因子表达较前增多,但量仍较少,随着浓度增加,梗死心肌边缘区Ⅷ因子表达水平开始大幅度增加,10、50 μmol/L t-AUCB组间跨越幅度最大;GW9662+t-AUCB组较100 μmol/L t-AUCB组,Ⅷ因子表达水平明显减少,为0~1 μmol/L。与0 μmol/L t-AUCB组比较,1、10、50、100 μmol/L t-AUCB组Ⅷ因子表达水平明显增多(P<0.05);GW9662+t-AUCB组与0、100 μmol/L t-AUCB组比较,差异有统计学意义(P<0.05),见图6、表1。
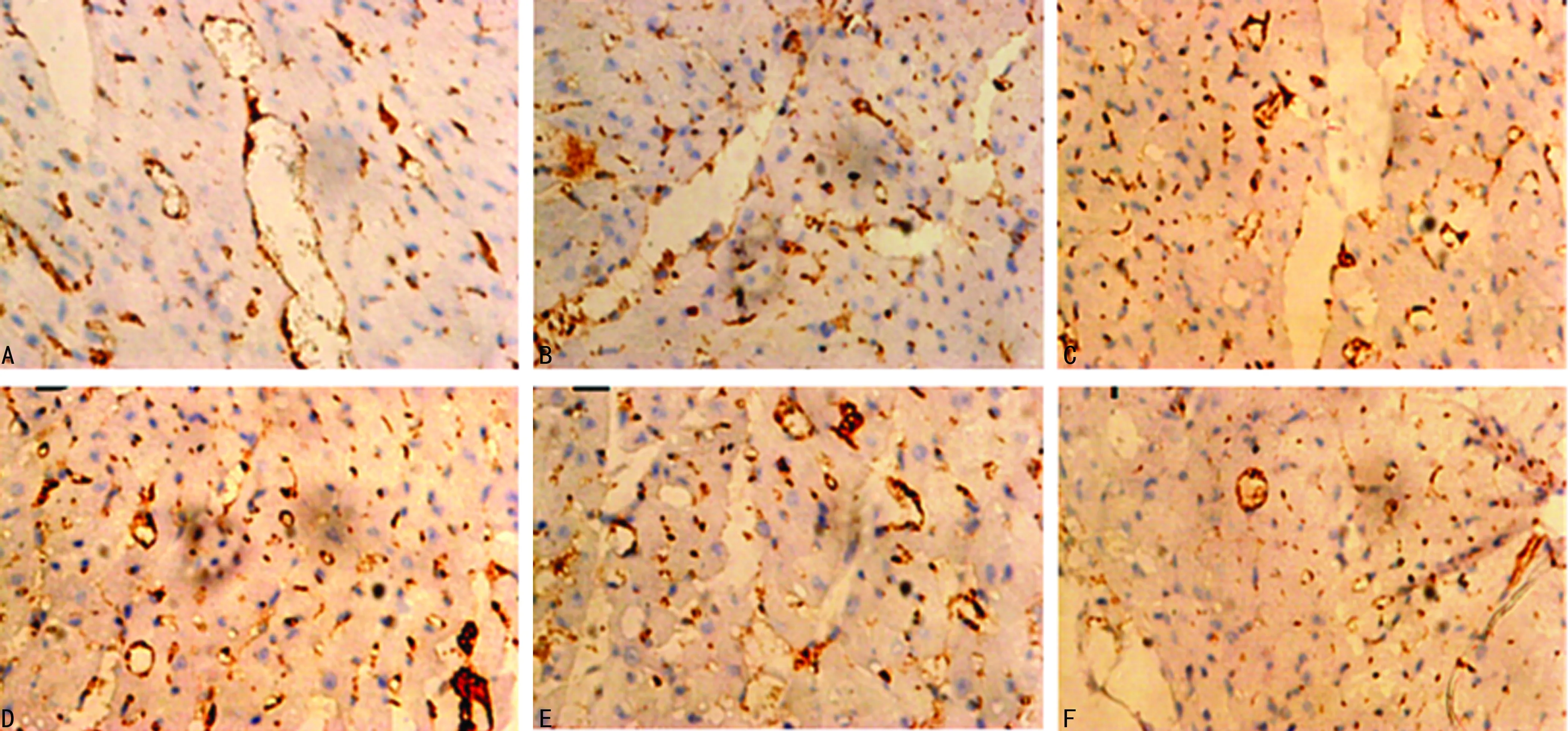
A:0 μmol/L t-AUCB组;B:1 μmol/L t-AUCB组;C:10 μmol/L t-AUCB组;D:50 μmol/L t-AUCB组;E:100 μmol/L t-AUCB组;F:GW9662+t-AUCB组。
2.5.4不同浓度t-AUCB干预的EPCs注射后14 d梗死心肌边缘区Ⅷ因子表达情况
0 μmol/L t-AUCB组14 d Ⅷ因子表达缓慢增加,随着浓度增加,梗死心肌边缘区Ⅷ因子表达水平大幅度增加,增加幅度较3、7 d更大,GW9662+t-AUCB组较100 μmol/L t-AUCB组Ⅷ因子表达水平明显减少。与0 μmol/L t-AUCB组比较,1、10、50、100 μmol/L t-AUCB组Ⅷ因子表达水平明显增多(P<0.05);GW9662+t-AUCB组与0、100 μmol/L t-AUCB组比较,差异有统计学意义(P<0.05),见图7、表1。
2.5.5不同浓度t-AUCB干预的EPCs注射后28 d梗死心肌边缘区Ⅷ因子表达情况
0 μmol/L t-AUCB组28 d Ⅷ因子表达仍缓慢增加,随着浓度增加,梗死心肌边缘区Ⅷ因子表达水平增加,增加幅度较7、14 d有所放缓,GW9662+t-AUCB组较100 μmol/L t-AUCB组Ⅷ因子表达水平明显减少。与0 μmol/L t-AUCB组比较,1、10、50、100 μmol/L t-AUCB组Ⅷ因子表达水平明显增多(P<0.05);GW9662+t-AUCB组与0、100 μmol/L t-AUCB组比较,差异有统计学意义(P<0.05),见图8、表1。
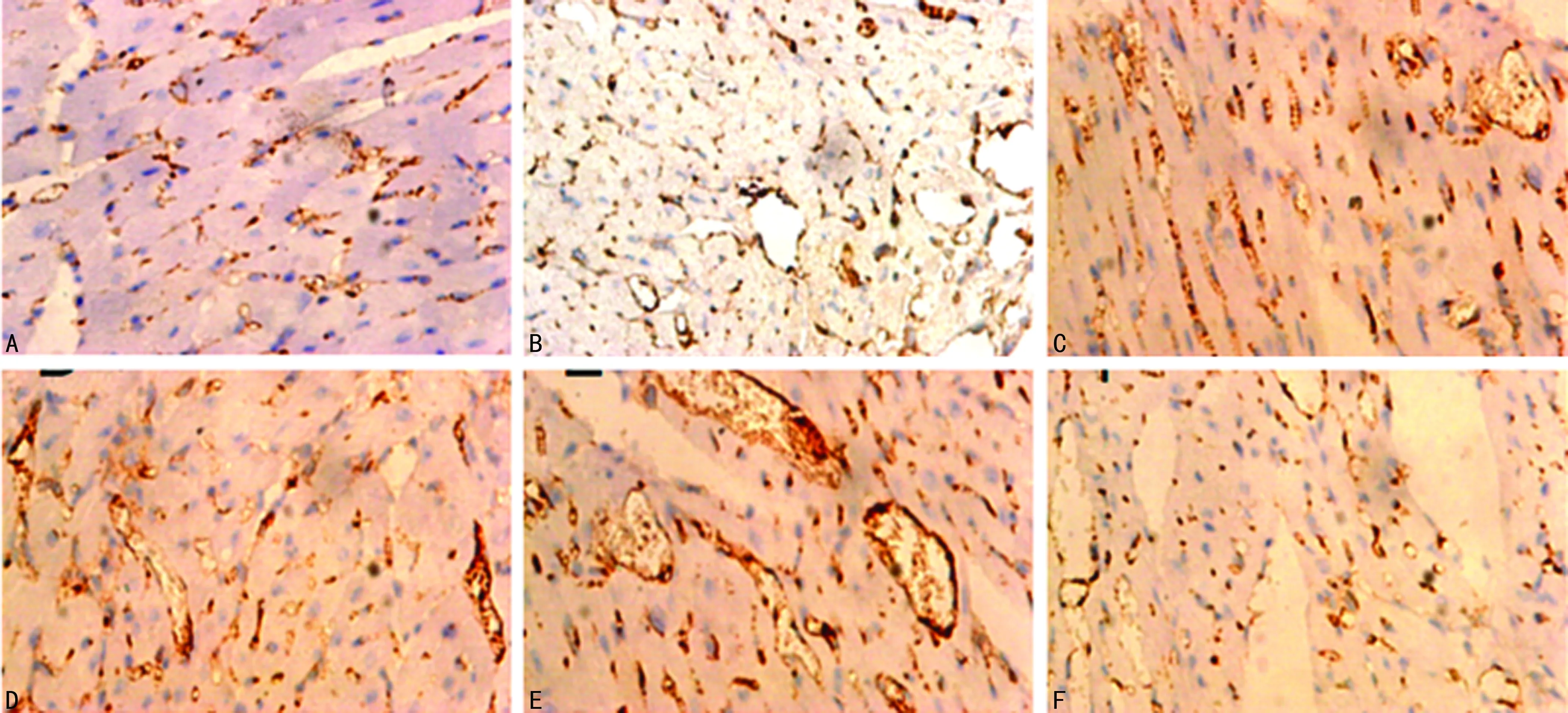
A:0 μmol/L t-AUCB组;B:1 μmol/L t-AUCB组;C:10 μmol/L t-AUCB组;D:50 μmol/L t-AUCB组;E:100 μmol/L t-AUCB组;F:GW9662+t-AUCB组。
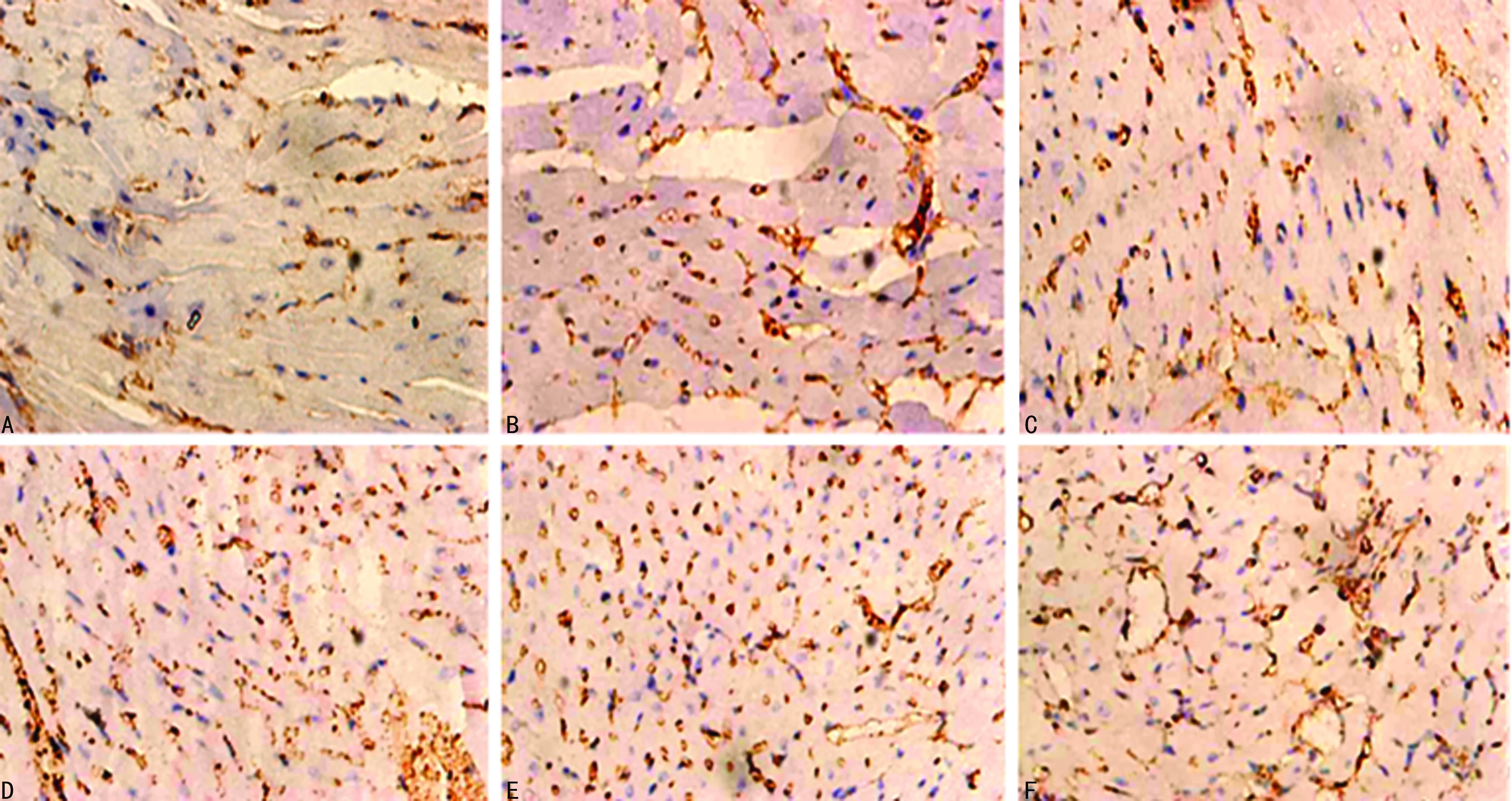
A:0 μmol/L t-AUCB组;B:1 μmol/L t-AUCB组;C:10 μmol/L t-AUCB组;D:50 μmol/L t-AUCB组;E:100 μmol/L t-AUCB组;F:GW9662+t-AUCB组。
3 讨 论
骨髓来源单个核细胞贴壁后,贴壁生长的细胞由圆形细胞逐渐向梭形细胞,再逐渐变为类圆形及多角形细胞改变,Dil-ac-LDL细胞摄取率达95%以上,与同型分化抗原比较,培养的EPCs细胞表面分化抗原流式细胞仪检测结果为符合EPCs表型,提示培养的细胞为高纯度EPCs。沿左心耳与肺动脉圆锥交界处下方2~3 mm处进针,深度为1~2 mm,7-0尼龙线结扎左前降支,制作心肌梗死模型,结扎后结扎位点以下心肌变白,活动幅度减弱,之前位于等电位线的ST段明显抬高,提示心肌梗死模型制作成功。
血管生成为心肌梗死后梗死心肌修复的重要指标,有多个研究发现体外移植的EPCs可通过多种机制促进梗死心肌修复,例如移植的EPCs持续分泌囊泡促进梗死心肌血管生成[7],通过抑制心肌梗死后炎性反应及氧化应激促进梗死心肌修复[8-9],而sEH可增强EPCs功能[5-6],所以本研究检测sEH抑制剂干预的EPCs移植后不同时间点小鼠梗死心肌边缘区Ⅷ因子表达情况,检测移植的EPCs对梗死心肌血管生成的影响,同时检测sEH抑制剂t-AUCB对EPCs增强梗死心肌血管生成功能的促进作用。
对0 μmol/L t-AUCB组Ⅷ因子表达情况分析发现,即使未干预sEH,随着时间延长,移植的EPCs仍可促进梗死心肌血管生成[10-12],只是程度较小,相同时间内血管生成数较少,给予t-AUCB干预后,EPCs促进梗死心肌血管生成作用得到明显增强[13-18],且t-AUCB干预浓度越大,EPCs对梗死心肌血管生成促进作用越强;而在注射EPCs后早期,即注射后1 d,就可观察到梗死心肌边缘血管生成,提示t-AUCB及EPCs在注射后早期即可发挥作用,或许在注射前的体外干预过程中,t-AUCB已明显增强EPCs活性。而GW9662+t-AUCB组梗死心肌边缘区Ⅷ因子表达水平明显下降,甚至低于1 μmol/L t-AUCB组。上述结果提示在注射EPCs后1 d,注射的EPCs即可促进梗死心肌血管生成;给予t-AUCB后,EPCs对梗死心肌血管生成作用得到极大加强,一旦阻断PPAR-γ通路,EPCs对梗死心肌血管生成作用则被大大抑制,但不能完全被抑制。
综上所述,t-AUCB可通过减少EETs降解激活EPCs上PPAR-γ从而促进EPCs发挥作用,且t-AUCB可呈浓度正相关发挥其对EPCs激活作用。当阻断PPAR-γ后,t-AUCB对EPCs的激活作用被明显抑制,提示PPAR-γ通路在t-AUCB激活EPCs过程中发挥重要作用。但阻断PPAR-γ通路后,t-AUCB对EPCs的激活作用尚未被完全阻断,提示除了PPAR-γ通路外,t-AUCB可通过其他通路激活EPCs,从而发挥其在心血管领域中的作用。

