大豆菌核病研究进展
杨淼泠,张 维,韦秋合,施李鸣,国 圆,张克诚,葛蓓孛
(1中国农业科学院植物保护研究所,植物病虫害生物学国家重点实验室,北京100193;2中国农业出版社有限公司,北京100125)
0 引言
大豆是中国最重要的油料作物之一,被广泛应用于豆制产品和动物饲料油的生产。2019年,中国大豆种植面积达到933万hm2,产量增长至1810万t,平均产量为1939.5 kg/hm2[1],大豆生产直接影响中国国民经济发展和人民生活,而病害则是影响大豆生产的关键因素之一,每年因病害造成大豆减产15%~ 40%。中国已报道的大豆病害有大豆胞囊线虫病、疫霉病等50多种[2],其中大豆菌核病(sclerotinia stem rot of soybean,又名大豆白腐病)是一种危害严重且难防治的世界性病害,其分布地域广,不仅普遍发生于中国东北、华北、华东、西南等各大豆产区,也在巴西、加拿大、美国、南非等大豆生产区造成了严重的危害。在大豆菌核病流行年份能够造成大豆产量骤减20%~ 30%,严重地块可达50%以上,甚至绝产[3]。同时,感染大豆菌核病后大豆中粗脂肪含量、粗蛋白含量甚至氨基酸总量均有下降趋势,进而影响了大豆的品质[4]。随着国家大豆振兴计划的实施,建立一项针对大豆病害的绿色防控技术是至关重要的。因此,笔者在国家大豆发展计划和国家重点研发项目的支持下,对大豆菌核病病原致病机理、病害侵染循环以及抗病育种等方面研究进行总结,以期为后续大豆菌核病的深入研究和防治提供参考。
1 大豆菌核病的病原菌
大豆菌核病的病原为核盘菌[Sclerotinia sclerotiorum(Lib.)de Bary],在 1837 年Libert[5]首次发现,并命名为Peziza sclerotiorum,后于1979年Purdy[6]将其重新改名为Sclerotinia sclerotiorum(Lib.)de Bary,得到国际一致认可并沿用至今。1945年,Whetzel等[7]根据在寄主内形成菌核和产生有柄子囊盘的特征将其归为子囊菌科,后又经过多次修改[8-9],现将其分类为真菌门(Eumycota)子囊菌亚门(Ascomycotina)盘菌纲(Discomycetes)柔膜菌目(Helotiales)核盘菌属(Sclerotinia)。该病原是一种死体营养型植物病原真菌,寄主范围广,能够侵染菊科、豆科、芸苔科、伞形科等400多种植物。核盘菌危害大豆植株地上的各个部位,造成苗枯、叶腐、茎腐、荚腐等症状,受侵染的部位初呈水渍状病斑,随后进一步扩展形成浅褐色或深褐色病斑,其典型病征是在高湿环境下呈现棉絮状白色菌丝,并形成鼠粪状或不规则形的黑色菌核[10]。
1.1 菌核
菌核作为一种休眠和存活结构在核盘菌的生命周期和病害循环中发挥着重要的作用。菌核由外壳、皮层组织和髓三部分组成,Williams等[11]发现外壳是由一至多层增厚的细胞组成,并且外壳和皮层组织的细胞都有色素的沉淀,但后者结构上更为紧密,髓是由大量无隔膜、不分枝的菌丝交联形成[12]。在关于菌核形成过程的报道中,有些研究者将其划分为6个阶段(S0~ S6),分别为菌丝营养生长期、起始发育期、菌核积聚期、菌核增大期、菌核合并期、色素沉积期、菌核成熟期[13],也有些将其划分为3个阶段,即初始阶段、发育阶段、成熟阶段[14-16],初期菌丝集结成白色的菌核原基;中期菌核原基迅速生长,体积明显增大,菌核表面分泌清澈透明的小液珠;后期菌核进入成熟阶段,菌核黑化即色素沉淀[17-19]。
影响菌核形成的因素分为外部因素和内部因素。外部因素包括温度、pH等,菌丝在4~ 30℃范围内都能形成菌核,最适温度是15~ 22℃。pH对菌核发育也有显著的影响,在中性或者碱性条件下能够抑制菌核的发育。另一方面,核盘菌对菌核发育存在复杂的调控机制,依靠pH-cAMP调控的MAPK信号通路在调控菌核发育过程中发挥着重要的作用,并认为cAMP依靠蛋白激酶(PKA)可能参与MAPK信号通路控制菌核形成[19-20],但Dickman等[21]和Wayne等[22]利用PKA抑制剂进一步研究发现cAMP对菌核的抑制与PKA无关,而Ras作为MAKP信号通路的上游激活因子是菌核发育所必需的。此外,还有很多蛋白质或酶类以特有的方式参与菌核的发育,Erental等[23]发现当核盘菌中2A型Ser/Thr磷酸酶(PP2A)受到干扰时,形成菌核的数量变少、体积变小。Rollins[24]发现在核盘菌中一个调节pH敏感基因的转录因子pac1也参与菌核的发育和成熟。Liang等[25]指出黑色素合成相关基因SCD1和THR1基因的缺失导致核盘菌菌核发育受损。Qu等[26]和Fan等[27]通过RNAi分别证明了核盘菌转录因子SsFKH1和SsMADS是菌核发育所必需的。
1.2 子囊盘
子囊盘是核盘菌的另一重要特征。核盘菌菌核萌发主要有两种方式:子囊盘型萌发和菌丝型萌发[28-29]。其中,菌核萌发产生子囊孢子是核盘菌生活史中有性生殖阶段,主要经过菌核萌发初期、子囊盘柄形成期以及展盘期3个阶段,一个菌核上可长出多个子囊盘柄,每个子囊盘柄上只形成一个子囊盘,成熟的子囊盘呈淡黄色,上生栅状排列的子囊。
营养、湿度、光照是影响菌核子囊盘型萌发的主要因素。只有在营养适中的条件下培养出来的菌核才能正常萌发产生子囊盘,当营养不足或者营养过剩时,菌核会发育形成不正常的子囊孢子或者完全不能产生子囊盘,PDA培养基属于营养过剩型,所以菌核完全无法发育形成子囊盘,仅能萌发产生菌丝。湿度也是一个重要的环境因素[30],Nepal等[31]指出,砂质土壤含水率越接近饱和菌核萌发率越高,同时产生的子囊盘数量越多。此外,Huang和Kozub[32]强调只有在光照条件下才能形成正常的子囊盘柄并膨大产生子囊盘。一直以来,低温处理是否是菌核萌发产生子囊盘的必须条件存在很大争议,但现有研究表明,不同的地理区域形成的不同菌株对低温反应可能是不同的,所以低温处理并非子囊盘萌发的必要条件。此外,Kruger等[33]发现菌核在不同深度的土壤中子囊盘萌发率也受影响,随着土壤深度的增加其萌发率呈下降趋势。
2 大豆菌核病的侵染循环
在土壤、病残体及混杂在大豆种子间越冬的菌核是翌年大豆菌核病的初侵染来源[6,34-35]。菌核在合适的环境条件下萌发产生子囊盘,子囊盘释放大量的子囊孢子通过风雨进行传播扩散是大豆菌核病流行的主要途径[36]。菌核萌发产生的菌丝也具有侵染性,可直接接触侵染健康寄主植物[37]。研究表明,虽然子囊孢子可以萌发产生芽管,但只有外源营养物质和水共同存在时才能侵染寄主植物[38]。衰老的花器官能给病原菌充足的营养物质,因此,大豆开花期是病害流行的高峰期[39]。带菌花瓣和发病组织还可以通过接触健康植株进行再侵染[40-41],构成完整的侵染循环(图1[12])。
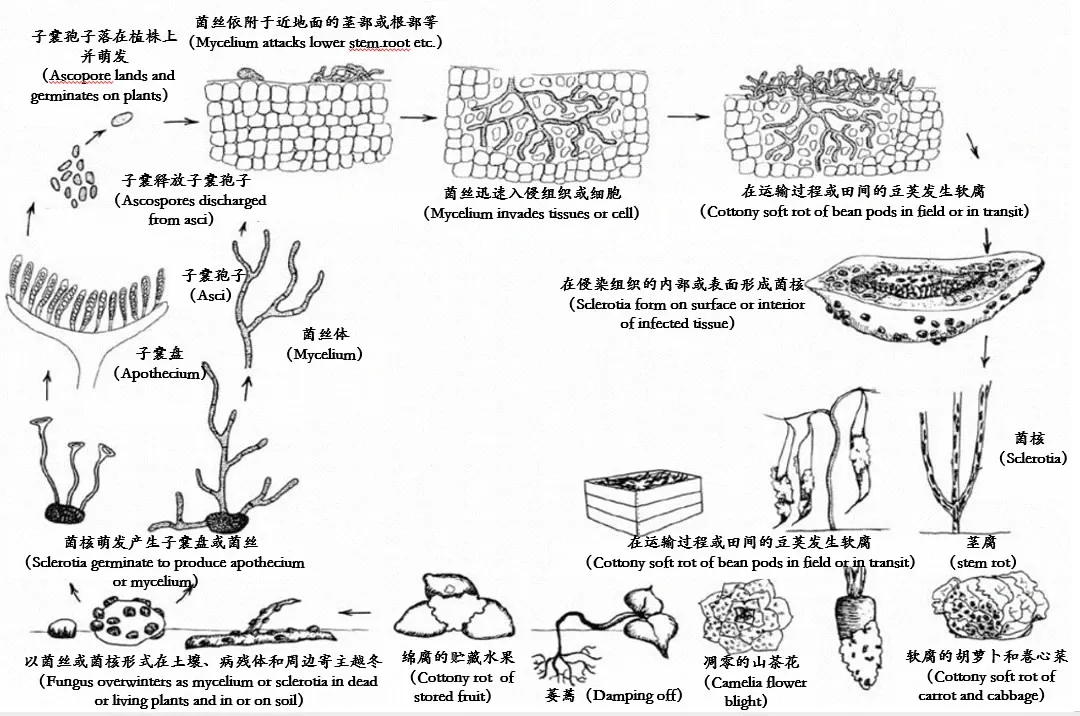
图1 核盘菌侵染循环及发病症状示意图
栽培管理、气候条件、大豆品种等因素都能影响大豆菌核病发生和流行。花期过早、种植密度过大有利于该病的发生[31,42],当温度为10~ 20℃,相对湿度保持在70%~ 80%时,菌核易萌发且萌发率高,极易形成子囊盘,空气的相对湿度保持在85%以上时,子囊孢子的弹射效果好,侵染成功率高,而当大豆种植密度过大,并且地势低洼排水不畅时,极易造成通风透光度差,湿度增加,给核盘菌菌核萌发创造有利的条件,从而导致大豆菌核病的发生流行。此外,不同地理区域来源的菌核对病害发生也有影响,Bardin等[43]研究表明,来自寒冷气候地区(10℃)的菌核比在温热地区(25~ 30℃)更容易萌发,而来源于热带的菌核不需经过低温处理,土壤中的水分含量达到100 kPa时1~ 2周即可萌发。
3 大豆菌核病的致病机理
核盘菌与大豆的叶片或茎秆等部位接触后,形成侵染垫,通过机械压力或分泌角质酶侵入寄主,并分泌草酸、细胞壁降解酶(CWDEs)等在寄主体内定殖、扩展,直到危害寄主出现相应的病理症状,造成菌核病的发生。
3.1 侵染垫
植物病原真菌在侵染植物时,首先接触并附着在植物细胞表面,继而形成相应的侵染结构,通过机械压力直接侵入表皮细胞内。Liang和Rollins[44]总结了先前关于核盘菌侵染和定殖过程的组织学和细胞学研究,提出了核盘菌两阶段侵染模型,第一阶段:菌丝接触植物表皮,菌丝尖端通过分化形成侵染垫,之后形成侵染钉,并通过产生机械压力及分泌角质酶等穿透寄主表皮的角质层,随后形成球根状皮下菌丝。第二阶段:皮下菌丝在植物角质层下不断扩张,之后分化形成皮下侵染菌丝,侵染菌丝通过分泌草酸、毒素以及CWDEs等降解寄主细胞壁,杀死寄主细胞,造成植物组织坏死并引起寄主植物死亡。
侵染垫的形成受多种机制和多个基因调控。2012年Li等[45]发现编码γ-谷氨酰转肽酶的Ss_Ggt1基因影响核盘菌侵染垫的形成,在没有伤口的叶片上形成病斑的时间推迟,而在而在有伤口的叶片上没有区别,因此,推测该基因和核盘菌侵染早期有关。Xiao等[46]在探究Ss_Caf1基因的功能时发现该基因在形成侵染结构过程中发挥着重要作用。2015年Liang等[47]发现分别编码草酸脱羧酶的Ss_oah2和草酸乙酸乙酰水解酶的Ss_oab1基因也能影响侵染垫的形成。Yu等[48]研究发现由Ss_Rhs1基因编码的含有Rhs重复结构的分泌蛋白是影响侵染垫形成的重要蛋白之一。近年来,还发现GATA转录因子在核盘菌的生长发育和致病过程中扮演着重要的角色,比如,SsAREA和SsSRE通过参与MAPK信号调控影响侵染垫的形成[49]。
3.2 胞外酶
植物病原菌在侵染寄主植物的过程中,为了获取营养和与寄主建立营养寄生关系,产生多种与致病性相关的胞外酶,主要有角质酶、细胞壁降解酶、蛋白酶、淀粉酶等,这些酶类的产生有的是在寄主细胞壁上发挥作用,有的是在降解细胞内含物上起作用,其中分泌的一系列细胞壁降解酶可以打破寄主植物的物理屏障,进而破坏植物组织干扰内部正常的生理代谢过程。核盘菌在侵染过程中分泌包括果胶酶、纤维素酶、半纤维素酶以及木聚糖酶等,其中多聚半乳糖醛酸酶(Polygalacturonase,PGs)作为一种重要的果胶酶一直是近些年的研究热点。PGs能够降解未酯化的果胶酯聚合物,即存在于在高等植物初生细胞壁和胞间层的结构性多糖。根据PGs中不同的功能将其分为多聚半乳糖醛酸内切酶(endoPGs)和多聚半乳糖醛酸外切酶(exoPGs),其中内切酶能够催化多聚半乳糖醛酸的水解过程,引起植物过敏反应,而外切酶可以分解果胶细胞壁多糖的单体或二聚体糖基,以便从寄主植物体内攫取所需营养物质[50-52]。利用RT-PCR进一步研究发现,多聚半乳糖醛酸内切酶在接种发病后不同的时间内表现出不同的释放情况,其中pg1、pg2和pg3在接种36 h后表达量最大,而在96 h后则不表达,pg6和pg7在24~ 96 h内都能检测到,而pg5仅能在后期检测到[53]。寄主植物为了与病菌分泌的多聚半乳糖醛酸酶相对抗,产生多聚半乳糖醛酸酶抑制蛋白(PGIPs)。Oliveira等[54]认为核盘菌的蛋白酶也是重要的致病因子,像天冬氨酸蛋白酶家族,如aspS、acp1在核盘菌侵染早期基因的表达水平显著提高。同时,Bashi等[55]发现,角质酶所编码的基因在侵染过程中其表达量显著提升,因此推断角质酶在核盘菌侵染的过程中也发挥着一定程度的作用。
3.3 草酸
草酸(Oxalic acid)在核盘菌致病过程中扮演着重要角色。1964年Bateman[56]在侵染寄主组织中发现草酸的积累。Liang等[57]通过构建的草酸基因(OAH)敲除体发现其致病力显著下降,而且抗菌核病的品种普遍能抑制草酸的吸收及运输。在核盘菌的致病过程中,草酸主要在以下几方面发挥作用:(1)核盘菌在侵染寄主时,草酸的积累可以降低病变部位的pH,低pH环境下,核盘菌分泌的致病相关酶活性增强。核盘菌的细胞壁降解酶的最佳pH低于5.0,因此随着分泌草酸量的不断积累,pH降低能够有效增强细胞壁降解酶的活性。同时,依赖pH调节的基因能够影响核盘菌的致病性或生活周期,Chen等[58]研究表明,Smki作为菌核发育的必要因子在酸性环境下表达量最大。其实,酸性环境不仅对寄主植物会产生毒害作用,而且有利于核盘菌抑制寄主植物一系列的防卫反应,比如草酸能够通过抑制寄主体内氧化爆发[59],甚至草酸可以降低过氧化氢酶、超氧化物歧化酶、过氧化物酶等活性[60],从而阻碍早期植物防御反应,减少寄主对自身的伤害。(2)草酸盐二价阳离子可以与钙二价阴离子发生螯合反应,降低了Ca+浓度,继而促进瓦解植物细胞壁进程[61]。(3)草酸还可以通过形成草酸晶体堵塞寄主维管束和抑制脱落酸诱导的气孔关闭过程,从而造成植物萎蔫[30-31]。(4)核盘菌可以通过草酸的分泌诱导启动寄主植物的程序性细胞坏死[32]。(5)草酸能够增强光抑制作用和造成光化学功能障碍,降解光合色素造成无法捕获或者收集能量,继而影响寄主的光合作用[62]。但随着进一步研究发现,未能形成草酸的突变株通过积累富马酸仍然能够形成菌核并引起发病,综上所述,引起菌核病发生的必要条件是酸性pH,而不仅仅是草酸[63]。
3.4 分泌蛋白
近年来,分泌蛋白与核盘菌的致病相关性是研究热点。核盘菌一直被认为是典型的死体营养型植物病原真菌,但随着进一步研究发现,核盘菌也存在短暂的活体营养阶段,并且也会分泌相应的效应子促进核盘菌的侵染[64]。目前,核盘菌中很多分泌蛋白的作用机制被阐述,比如,SsITL蛋白参与了核盘菌抑制寄主JA/ET信号途径介导的局部和系统性抗反应,而SsCP1可以与寄主中的PR1互作,降低PR1对自身抑制作用,从而有利于核盘菌的侵染发病。
4 大豆菌核病抗病鉴定和育种
选育抗性品种是防治大豆菌核病最经济、最有效的手段之一。现大豆菌核病在遗传育种方面已初步开展研究,包括抗病种质资源的筛选、抗性遗传规律和QTL定位以及基因工程育种等相关研究工作[78]。
4.1 大豆抗菌核病种质资源
由于复杂的抗性遗传规律和自然环境因素的叠加,增大了选育真正的抗性品种的难度[79-80],因此,国内外对于选育免疫或高抗菌核病的大豆品种方面研究进展缓慢。目前,研究主要集中在筛选对菌核病部分抗性的种质资源,对于耐病型和避病型品种的农艺特性研究已经相对明朗。耐病品种一般具有开花期早,株型紧凑、叶片上举,不易倒伏等特性[79]。现评价大豆对于菌核病的抗性主要采用人工接种鉴定和病田自然诱发鉴定,而普遍应用的鉴定方法是在室内或温室环境下的小面积人工接种,包括离体组织菌丝块接种、活体植株菌丝块接种、草酸鉴定法、菌核埋土法、菌液喷雾法、茎中可溶性色素水平鉴定法等[78]。Maple Arrow是世界上公认的耐病品种,除此之外,国外现已鉴定出Asgrow A2506、NKS 19-90、Colfax、Corsoy、FC 030233、PI5325等十余种部分抗性种质[81]。国内在大豆抗菌核种质资源鉴定方面也有一些进展。苗保河[82]在鉴定东北某些推广品种时发现开紫色花的品种抗性相对较好,宋淑云等[78]对112个大豆品种进行鉴定,筛选出了一个高抗品种‘吉育35’,除此以外,还筛选得到了‘宝交05-5318’、‘九三04-89’、‘牡05-742’、‘合丰24’、‘大天鹅蛋’、‘倪丁花眉豆’等多种具有中抗菌核病的大豆品种[83]。

表1 核盘菌中与致病性相关的分泌蛋白的基因及其功能
4.2 抗性遗传与QTL定位
大豆对菌核病的抗性为数量性状,由多基因控制,抗病遗传规律较为复杂。通过分子标记定位抗病主效基因在基因组中的位置,即进行QTL(quantitative trait locus)定位,从而辅助选育抗病品种,加速抗病品种选育的进程。用大豆的抗、感菌核病F2群体进行RAPD标记作图,找到了1个对抗性贡献率为18%的位点。Arahana、Kim、Guo、Vuong、Huynh等也定位出了多个大豆抗菌核病的QTLs,并发现叶形、生育期和开花期等农艺性状与QTL定位相关[81,84]。Li等[85]和Zhao等[86]在探究QTL与可溶性色素含量的关系中发现了多个可溶性色素含量与抗菌核病相关的QTLs。宋伟等[87]通过复合区间作图法结合表型鉴定也定位到7个抗大豆菌核病相关的QTL位点,并发掘了3个可能参与大豆抗菌核病的基因。张羽等[88]通过对大豆抗菌核病的全基因组进行SNP-phenotype和Haplotype-phenotype关联分析表明,基于单个SNP-Trait的最大关联在3号染色体上,其候选基因有pyrroline-5-carboxylate(P5C)reductase和cytochrome P450等,其中P5CR是一种催化脯氨酸生物合成的管家蛋白,脯氨酸在植物的抗逆过程中发挥着重要的作用。Haplotype-Traits的最大关联在17号染色体上,其中纤维素合酶基被列为关联基因。Sun等[89]也通过全基因组关联研究确定3个主效基因的6个SNPs和微效基因的8个SNPs,其中Glyma_18G012200被认为在抗病性方面发挥重要的作用。
4.3 基因工程育种
目前,国内外学者在大豆抗菌核病的基因工程育种方面已初步开展研究。将小麦中分离得到的具有降解草酸功能的草酸氧化酶基因转入大豆植物中,使得大豆对菌核病表现出显著的抗性[90]。张宇航等[91]从耐菌核病大豆品种Maple Arrow中克隆得到Gm_GLP10基因并发现该基因可能作为生长素结合蛋白参与调控大豆的生长发育与抗病防御应答反应。杨静等[92]利用从盾壳霉属中的几丁质基因CmCH1转入大豆植株并过表达,接种后发现大豆体内防御相关酶活性增强,比如过氧化物酶、超氧化物歧化酶、苯丙氨酸解氨酶等,同时也能诱导下游防御反应,即相关防御基因表达量增高,更重要的是,对基因的转入对大豆植物的生长发育并无有害影响。
5 大豆菌核病的防治技术
根据大豆菌核病病原菌及其侵染循环和发病机制,大豆菌核病的防治策略应以减少初侵染源为主,选用耐病品种栽培种植,加强田间管理,辅之必要的药剂防治。
5.1 减少初侵染源
通过建立合理的种植制度、选用无病繁殖材料、保持田园卫生和增加土壤有益微生物等措施减少初侵染源。菌核在土壤内的存活时间较长,常发病区应实行轮作机制,可与禾本科作物轮作,避免与油菜、向日葵、烟草等作物之间轮作。选无病株留种,采用筛选法除去种子中混杂的菌核,然后通过温汤浸种或者药剂浸种等进行种子处理。每年大豆秋收后,应及时清理农田病残体和落地花盘籽粒,集中深埋或烧毁病残体。春种时,适时的进行土壤深翻,将土壤中越冬菌核埋入深土中,并在大豆封垄前及时中耕培土,可降低菌核的萌发。增加土壤中有益微生物菌群,比如利用植物根际促生菌(PGPR)或利用盾壳霉(Coniothyrium minitans)对菌核的重寄生作用,施用盾壳霉生物防治菌剂于土壤中,可减轻发病程度[93]。
5.2 选用耐病品种
选育抗性品种是防治大豆菌核病最经济、最有效的手段之一。由于对大豆菌核病高抗或是免疫的大豆品种较少,可选用‘吉育35’、‘合丰24’、‘合丰35’、‘垦农4号’、‘垦农5号’等具有中抗菌核病品种进行合理布局。未有中抗种质资源,可选择株型较为紧凑,通风透光性能好,植株叶面稍尖或叶片上举的大豆品种。
5.3 加强田间管理
调整播期、合理调节环境因子、优化水肥管理,创造有利于植物生长发育而不利于病害发生的生态环境条件。调整播期,适时迟播,使开花期与降雨期错开。保持田间排水良好,通风透光,减少易积水和低洼地的种植。重施基肥、苗肥,施足磷钾肥,特别是喷施磷酸盐对控制大豆菌核病的发生有一定程度的作用[94-95],在冬小麦-夏大豆模式中,免耕覆秸播种技术能增产增效的同时也实现了麦茬大豆田间病虫草害的防治[96]。
5.4 药剂防治
化学药剂是防治大豆菌核病的主要手段,而早期及时喷施药剂对预防菌核病发生是至关重要的[97],菌核病的最佳防治时期是子囊盘发生期与大豆开花期的重叠期,菌核一般在大豆封垄后开始萌发,7月中下旬是子囊盘萌发的高峰期。现主要有苯甲基咪唑类、琥珀酸脱氢酶类、三唑类、甲氧基丙烯酸酯类、二硝基苯胺类杀菌剂,通过不同的作用机制能够有效的降低大豆菌核病的发病率[98-102]。虽化学防治对菌核病的防效十分明显,但由于长时间的大量喷施化学药剂,导致核盘菌抗药性产生[103]、环境污染,大豆食品安全隐患等问题。
相比于化学药剂,生物制剂具有对环境相容性好、农业可持续发展性强等优点[104-105]。除上述利用盾壳霉对菌核的重寄生作用外,还可利用木霉(Trichoderma viride)和 (Trichoderma harzianum)[106]、枯 草 芽 杆 菌(Bacillus subtilis)[107]、链霉菌(Streptomyces avermitilis和Streptomyces hygroscopicus)[108]对核盘菌的拮抗作用,达到较好的防治效果。此外,施用核盘菌SsHADV-1病毒粒子后,不仅能够减轻病害发生程度,还能缩小病原菌寄主范围、提高作物产量[109]。
6 展望
目前,基于核盘菌的致病机理及侵染特性,利用基因工程技术在大豆抗菌核病育种方面取得了一定的成效,同时,化学防治作为防治大豆菌核病的主要手段能有效的预防及阻止菌核病的发生危害。但仍然存在一些重要问题需要解决:(1)大豆-核盘菌之间互作机制还未阐述清楚。大豆是如何响应核盘菌分泌的毒素或分泌蛋白,抗病信号是如何启动并转导,是否也像疫霉菌一样存在“诱饵模式”[110],这些问题阻碍了抗病基因的挖掘和分子育种的进程。(2)大豆中缺乏可利用的优良抗源。虽已定位到很多的QTL,但重复性差,缺少稳定的主效QTL,这导致大豆抗菌核病遗传育种的研究进展缓慢。(3)研究手段尚需改进。当前对抗病基因的鉴定研究多采用QTL定位或通过检验少数基因对核盘菌的响应情况来推测其与抗性的关系,难以准确鉴定出抗病基因,更无法了解寄主的抗病机制。(4)缺少一种绿色、安全且高效的防治大豆菌核病的技术手段。目前虽然化学方法能很快地抑制病原体发展并具有一定的预防作用,但是存在环境污染、抗药性产生以及食品安全等问题。
针对以上问题,今后可从以下几个方面开展后续研究:(1)集中筛选抗病品种,通过杂交将抗病成分转入大豆,并利用其进行抗病位点鉴定,从而提高抗病位点的准确性。(2)通过全基因组水平、转录组水平和代谢组水平等现代生物信息学的分析手段,加快核盘菌-大豆互作机制的研究,挖掘抗病基因,为大豆抗菌核病分子育种奠定基础。(3)积极研究生物防治方法对大豆菌核病的防控效果及机理,推进生物防治策略与化学或农业防治方法综合联用,为建立良好的综合防治管理技术奠定基础。
致谢:感谢国家重点研发计划“主要经济作物重要及新成灾病害绿色综合防控技术”(2019YD1002000)的资助和中国农业科学院植物保护研究所植物病虫害生物学国家重点实验室提供的良好实验平台。

