凋亡抑制蛋白c-FLIP(L)调控肺纤维化过程的机制
李 昊,张林凯,张 晶
南京大学生命科学学院,江苏 南京 210023
特发性肺纤维化(idiopathic pulmonary fibrosis,IPF)是困扰人类的一种顽症,被定义为一种病因不明、发病机制不清的弥散性肺间质疾病[1]。近年来,肺纤维化在国内外的发病率呈显著上升趋势,已成为全球范围内关注的健康问题。IPF预后差,患者5年存活率仅为20%,目前尚无治愈方法[2]。目前认为肺纤维化的发展主要分为2 个阶段:①早期肺泡炎症阶段,肺部浸润细胞和间质细胞会分泌一系列细胞因子,如肿瘤坏死因子(tumor necrosis factor,TNF)-α、趋化因子CXC 等,促进炎性细胞进一步聚集;②后期纤维化阶段,活化的间质细胞(成纤维细胞和成肌纤维细胞)及炎症细胞会分泌生长因子[如转化生长因子-β(transforming growth factor-β,TGF-β)]和白细胞介素(interleukin,IL)等参与肺组织重构,导致肺纤维化的发生。
TGF-β被认为是肺纤维化进程中最重要的细胞因子,作为关键性的致纤维化因子参与肺纤维化的损伤和修复过程,并且它能诱导肺泡上皮细胞向间质细胞转化。研究发现,上皮-间质转化(epithelialmesenchymal transition,EMT)是肺纤维化发病机制中的一个关键步骤,肺上皮细胞发生EMT转化为成纤维样细胞是导致肺纤维化的重要原因[3]。文献报道在IPF 患者的肺组织中检测到c-FLIP(L)蛋白的异常表达[4-5]。c-FLIP(L)具有caspase-8 类似结构,由DED 结构域和caspase 样结构域组成,是一个无活性的蛋白酶样蛋白质。c-FLIP(L)作为caspase-8的抑制因子,能有效抑制死亡受体家族(death receptor,DR)介导的细胞凋亡[6]。除了抗凋亡功能外,c-FLIP(L)还被报道参与了EMT介导的肿瘤细胞迁移与转移,如在人非小细胞肺癌细胞中,TNF-α和TGF-β信号能够上调c-FLIP(L)表达,与细胞迁移密切相关[7],黑色素瘤B16F10 细胞中c-FLIP(L)高表达促进EMT 关键分子Snail 表达,增强细胞运动[8],以及环状RNAcircPVT1 调控c-FLIP 表达,能增强EMT诱导骨肉瘤的侵袭转移[9]。
在肺纤维化过程中,c-FLIP(L)表达水平的变化影响了肺泡上皮细胞对凋亡的敏感性,那么它的表达是否还会影响肺上皮细胞发生EMT,成为肺纤维化发展的一个诱因呢?这是探究肺纤维化可能发病机制的新切入点,为靶向EMT的肺纤维化治疗提供新的潜在靶点。本研究通过建立博来霉素(bleomycin,BLM)诱导的肺纤维化模型,探讨c-FLIP(L)表达与EMT发生及肺纤维化的相关性。
1 材料和方法
1.1 材料
C57BL/6 小鼠,8 周龄,雄性(体重18~20 g),健康SPF级,购于南京大学模式动物研究所。人源肺癌上皮细胞株A549购自美国ATCC。FLIP-A549稳定表达细胞株为实验室保存。
戊巴比妥钠(上海生工公司),BLM(化药株氏会社,日本),Masson 染色试剂盒(福州迈新生物科技有限公司);FLIP 抗体(3210s,C Signaling TechnologyTM)、Vimentin 抗体(BD 550513,BD PharmingenTM)和E-Cadherin 抗体(#610181,BD PharmingenTM)(上海优宁维生物科技股份有限公司);Smad-luc报告基因(上海吉满生物科技公司);FLIP siRNA(5′-GCAGUCUGUUCAAGGAGCATT-3′)(上海吉玛制药技术有限公司)。
1.2 方法
1.2.1 BLM诱导小鼠肺纤维化模型的建立及鉴定
C57BL/6小鼠采用随机法分为对照组、BLM组,每组6 只。各组小鼠腹腔注射50 μL 的3%戊巴比妥钠进行麻醉,仰卧固定在实验台上,将颈部皮肤钝性分离暴露出气管。注射针头沿气管轻轻注入0.1 mL BLM(2.5 mg/kg),对照组注入等量生理盐水,注射完成后采用医用缝合线进行气管及周围皮肤的缝合。造模后28 d 处死小鼠,取肺组织置于4%多聚甲醛固定,石蜡包埋后切片,按试剂盒说明进行Masson染色及HE染色,显微镜观察肺组织结构。
1.2.2 免疫组化染色
肺组织石蜡切片经60 ℃烤片、常规脱蜡,抗原修复,3%H2O2室温孵育15 min 等操作后进行封闭,3%山羊血清室温封闭30 min后,每张切片滴加适当浓度的一抗溶液50 μL,4 ℃过夜。次日,将切片PBST 漂洗5 min×3 次,滴加50 μL 聚合物增强剂(A剂),室温30 min后PBST漂洗5 min×3次。然后,滴加预备好的显色剂DAB 工作液50 μL 观察显色,用流水冲洗终止显色。最后,切片进行分化、脱水、透明等一系列处理后,滴入中性树脂进行固定封片,光学观察拍照。
1.2.3 Western blot分析
收集细胞样品收集细胞用预冷PBS 洗两次,加入RIPA 液(P0013,上海碧云天生物技术公司)裂解细胞,冰上放置20 min 后12 000 r/min离心10 min,收集上清。蛋白质定量后加入上样缓冲液煮沸5 min。取适量点样进行10% SDS-PAGE 凝胶电泳及转膜。样品膜进行5%脱脂奶粉溶液室温封闭1 h,包被一抗溶液4 ℃过夜。次日PBST 洗膜5 min×4 次,包被二抗溶液室温1 h,PBST 洗涤后滴加化学发光反应液,采用蛋白分析仪拍摄后进行结果分析。
1.2.4 Q-PCR分析
收取细胞,采用TRIzol法提取RNA,使用TaKaRa逆转录试剂盒(北京宝日医生物技术公司)获得DNA。根据实验需要,取适量上述逆转录后的cDNA 配制20 μL 体系,使用Real-time PCR 仪进行PCR 扩增,采用Quantitation-comparative CT(Livak)法即ΔΔCT法测定进行数据分析。所有Q-PCR 引物购于南京金斯瑞公司。E-cadherin引物:上游5′-TGCACCAACCCTCATGAGTG-3′和下游5′-GTCAGTATCAGCCGCTTTCAG-3′;N-cadherin引物:上游5′-GTCAGTATCAGCCGCTTTCAG-3′和 下 游5′-ATTGATGCTGACGATCCCAATGCC-3′;Vimentin 引物:上游5′-TCAAGTCCAGCTGCCACTGTGATCA-3′和下游5′-TGCAGGCTCAGATTCAGGA-3′;GAPDH 引物:上游5′-GAGCAGGTCTTGGTATTCACG-3′和下游5′-CACCATCTTCCAGGAGCGAG-3′。
1.2.5 Smad报告基因检测
A549 细胞接种于24 孔板,次日转染质粒DNA(含Smad-luc 报告基因质粒和pRL 质粒),24 h 后采用TGF-β1(10 ng/mL)处理12 h,吸弃培养液,PBS漂洗1次,然后每孔加入50 μL passive lysis buffer 裂解20 min,细胞裂解液转入EP管4 ℃下12 000 r/min离心10 min,取上清,采用双荧光素酶试剂盒(E1910,Promega 公司,美国),按说明书操作,上样测定荧光素酶的活性。
1.3 统计学方法
采用SPSS20.0 软件进行结果分析,数据用均数±标准差()表示。多组间比较采用单因素方差分析,组间两两比较用SNK法,P<0.05为差异有统计学意义。
2 结果
2.1 c-FLIP(L)在肺纤维化中高表达与EMT相关
采用BLM构建小鼠肺纤维化模型,造模28 d后处死小鼠,制备肺组织切片进行HE 染色和Masson染色(图1)。HE 染色显示对照组肺泡结构呈现网孔状分布,而BLM 组中肺泡结构遭到严重破坏,肺泡数量减少,形态不规则。Masson染色显示胶原沉积,它是成纤维细胞增生的指标。对照组Masson染色肺组织结构清晰,肺泡间隔未见增厚和纤维化表现,BLM 组肺组织中可见大量胶原沉积,肺纤维化严重,说明造模成功。
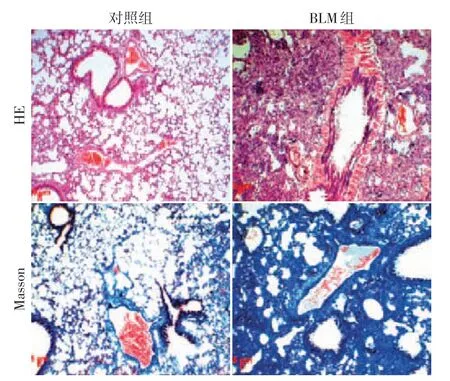
图1 BLM构建肺纤维化模型的鉴定(×200)Figure 1 Identification of pulmonary fibrosis model constructed by BLM(×200)
E-Cadherin 是EMT 的特异性上皮标志物,主要表达在肺泡上皮细胞表面。采用免疫组化染色来验证c-FLIP(L)表达是否参与纤维化病程中EMT的发生。免疫组化染色结果显示,E-Cadherin 在正常肺泡上皮细胞和柱状气管上皮细胞中大量表达,BLM 组纤维化的肺组织中E-cadherin 表达下调,而c-FLIP(L)染色结果与E-cadhesin变化相反,肺纤维化组织中c-FLIP(L)表达升高,并且在其相应深染位置上E-cadherin表现为低表达(图2A)。定量分析显示,BLM组与对照组比较,E-cadherin下调以及c-FLIP(L)上调,差异都有统计学意义(P<0.01,n=3,图2B),这些关联提示c-FLIP(L)高表达参与肺纤维化过程中EMT的发生。
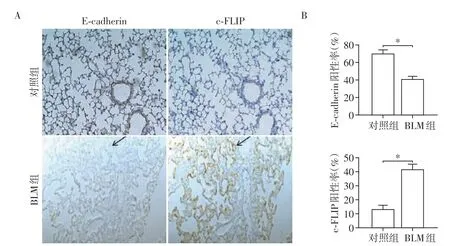
图2 免疫组化染色观察E-Cadherin及c-FLIP的表达分布Figure 2 Expression and distribution of E-Cadherin and c-FLIP observed by immunohistochemical staining
2.2 C-FLIP(L)高表达促进细胞EMT表型
为了确定c-FLIP(L)表达参与肺上皮细胞EMT的发生,在细胞水平上采用肺癌上皮细胞株A549为背景构建c-FLIP-A549 稳定表达株,对其细胞形态学进行观察。与空载质粒构建的对照组相比,c-FLIP-A549稳定株#1和#2细胞偏长梭形,细胞间黏附减少,显示出类EMT 现象(图3A),其c-FLIP(L)表达水平升高(图3B)。进一步对EMT 标志分子E-cadherin、N-cadherin、Vimentin 进行qRT-PCR 检测,结果显示c-FLIP-A549 稳定株中E-cadherin mRNA 表达下调而N-cadherin mRNA 表达上调(P<0.001,n=3),Vimentin mRNA 相应升高(P<0.05,n=3,图3C)。这些标志物的变化说明c-FLIP(L)高表达能促进EMT发生。
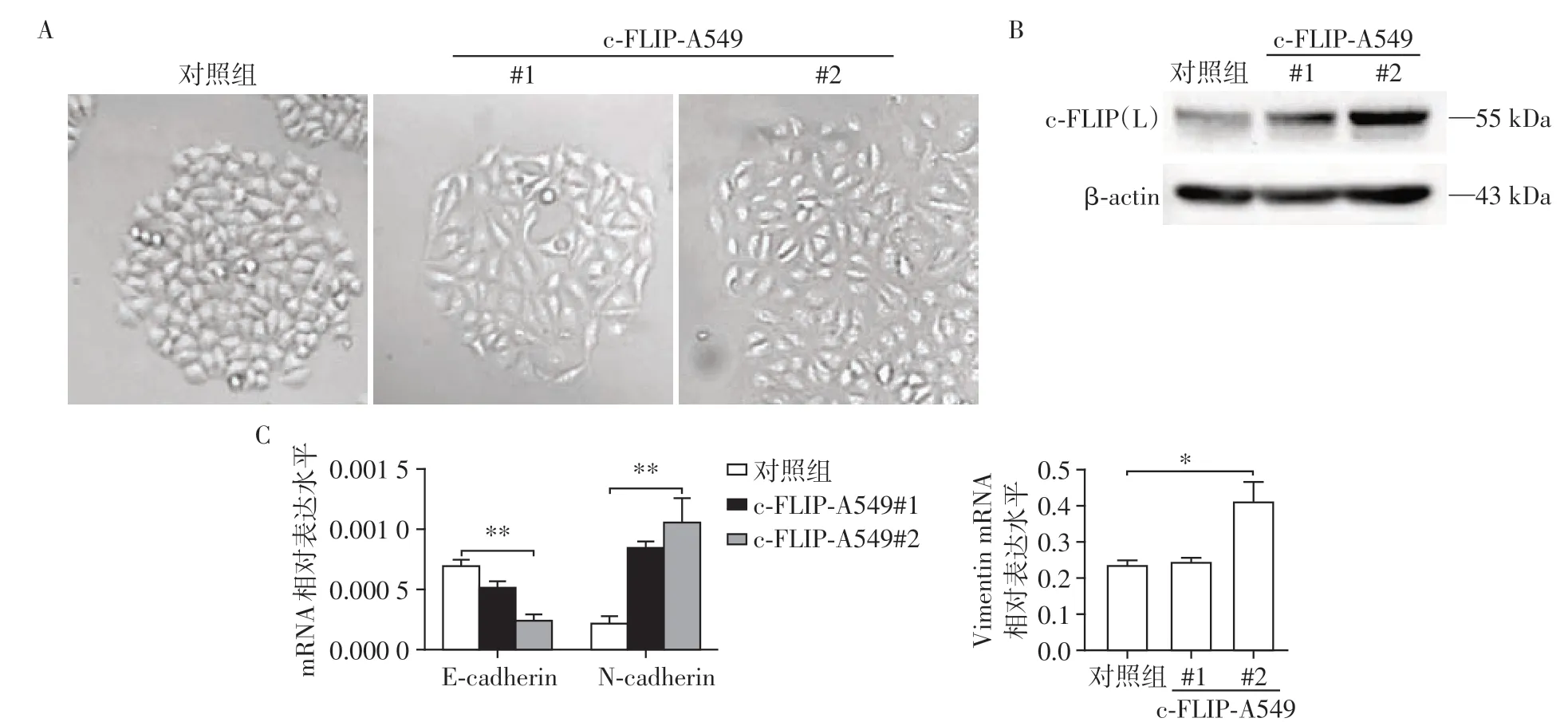
图3 c-FLIP(L)高表达能促进细胞发生EMT现象Figure 3 Overexpresion of c-FLIP(L)promotes EMT-like phenotype
2.3 c-FLIP(L)调控TGF-β1诱导的EMT
采用TGF-β1 诱导A549 细胞EMT 发生,检测c-FLIP(L)高表达对TGF-β1 诱导EMT 过程的影响。Smads 是细胞内重要的TGF-β1 信号转导和调节分子,报告质粒Smad-luc 的luciferase 活性反映Smad 通路的激活状态。在TGF-β1 刺激下,c-FLIP(L)过表达细胞表现出更强的luciferase 活性(P<0.05,n=3,图4),说明Smad通路的激活程度高,表明c-FLIP表达能促进TGF-β1诱导的Smad信号通路的激活。
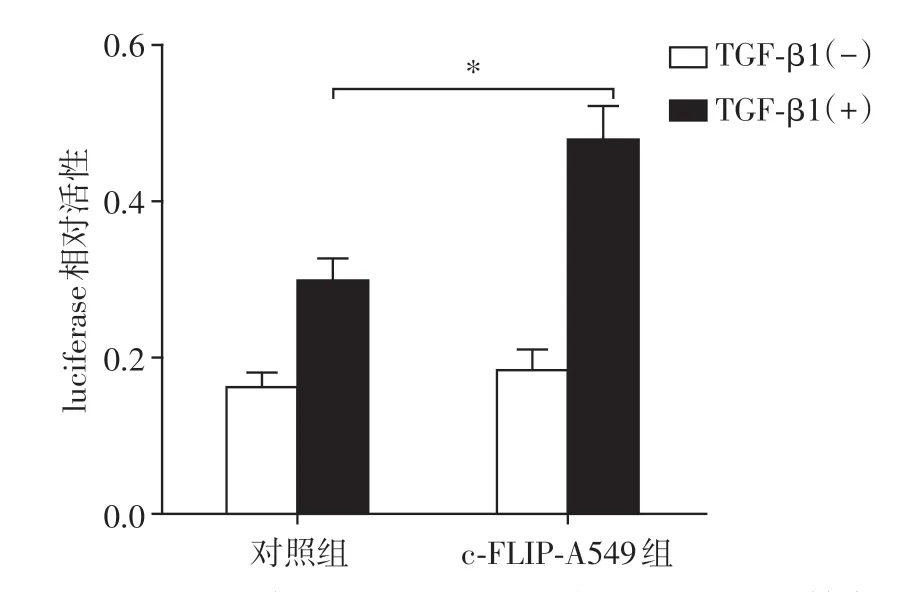
图4 c-FLIP(L)过表达增强TGF-β1诱导Smad通路的激活Figure 4 c-FLIP(L)enhances the activation of Smad pathway induced by TGF-β1
为了进一步验证c-FLIP(L)调控EMT 发生,采用c-FLIP siRNA 干扰片段敲减内源性c-FLIP(L)的表达,结果显示FLIP-2 siRNA 干扰片段能有效敲减内源性c-FLIP(L)的表达水平(图5A)。接着,采用FLIP-2 siRNA 转染A549 细胞培养24 h 后,加入20 ng/mL TGF-β1 诱导细胞EMT 发生,Western blot检测EMT 标志蛋白表达变化。对照组NC siRNA中TGF-β1诱导的E-cadherin表达显著下调及Vimentin表达水平上升(P<0.001,n=3,图5B),而FLIP-2 siRNA 有效抑制了TGF-β1 诱导的EMT 现象,抑制了E-cadherin 蛋白水平的下调,也减弱了Vimentin表达水平的上调,说明下调c-FLIP(L)表达水平能阻滞EMT的进程。
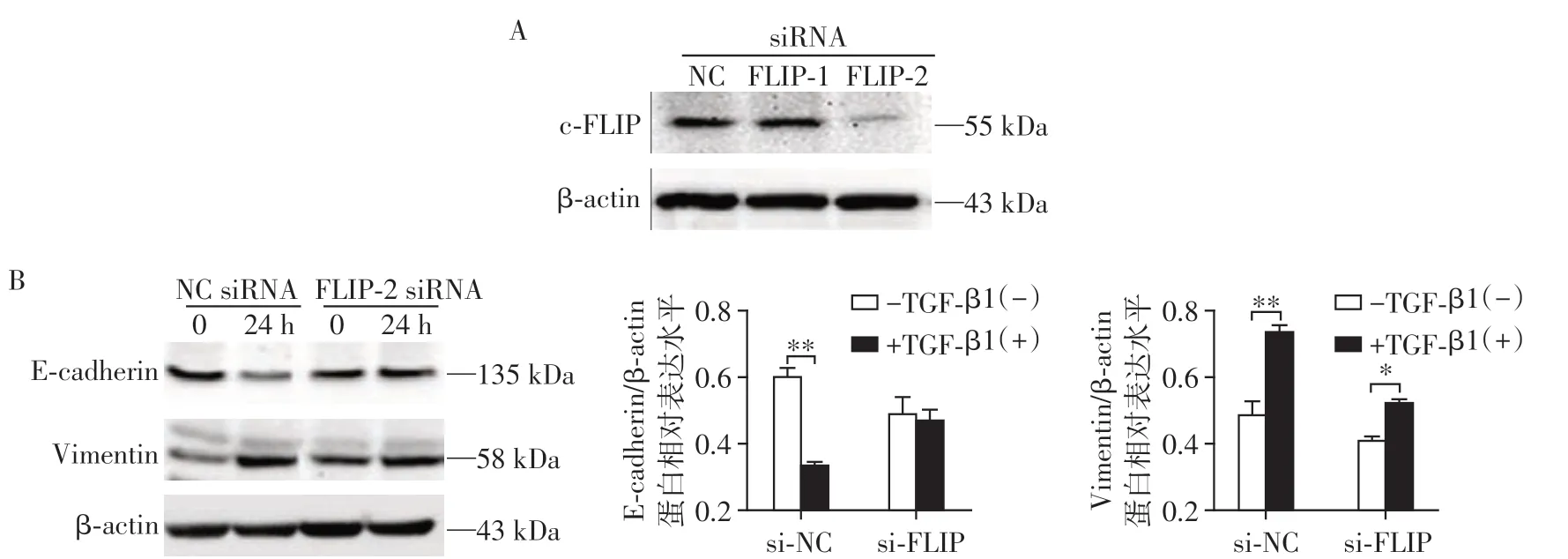
图5 敲减c-FLIP(L)能够阻滞TGF-β1诱导的EMT发生Figure 5 Knockdown of c-FLIP(L)inhibits the process of EMT induced by TGF-β1
3 讨论
越来越多的数据表明,在肺纤维化发展中,EMT是成纤维细胞/肌成纤维细胞的一个重要来源[2]。来源于肺组织的上皮细胞进行体外培养时,在促纤维化因子TGF-β1的诱导下能够转化成间质细胞[10]。肺纤维化组织中TGF-β1高表达不仅能促进EMT发生,还能促进成纤维细胞过度增殖和分化,因此,TGF-β1是肺纤维化发生的关键因子。另有研究表明,炎性因子TNF-α能够促进TGF-β1诱导的EMT发展[11],但其作用机制并不清楚。本研究发现c-FLIP(L)能够促进TGF-β1诱导的EMT 发生,而c-FLIP(L)是NF-κB 的靶基因,能被TNF-α诱导上调,这一发现为TNF-α促TGF-β1 诱导EMT 发生提供了可能的分子机制。肺纤维化发展的早期是肺泡炎症,肺部浸润细胞和间质细胞分泌的主要细胞因子是TNF-α,在IPF患者的肺组织中检测到c-FLIP(L)蛋白的异常表达[4-5],综合这些报道,推测在肺纤维化过程中c-FLIP 高表达与EMT发生密切相关,是调控肺纤维化发展的重要诱因之一。
虽然C-FLIP(L)是重要的一种抗凋亡蛋白,但具有多种生物学功能。我们前期研究报道了c-FLIP(L)能够进入细胞核参与AP-1 转录活性调控[13]。而文献报道AP-1家庭成员c-Jun可以导致上皮细胞极性缺失,c-Fos 可降低细胞间的粘连,JunD 活性影响MMP 表达,这些都与EMT 关系密切[14]。此外,我们还发现c-FLIP(L)能进入胞核参与catenin/TCF 转录复合物调控β-catenin下游靶基因的表达[15],而TGFβ1 信号能激活Wnt/catenin 通路与Smad 通路产生crosstalk促进EMT转化[16]。这些发现都为c-FLIP参与EMT发生提供了有力依据。
在BLM诱导的小鼠肺纤维化模型中,肺组织切片的免疫组化分析显示c-FLIP(L)高表达与E-cadherin 低表达呈负相关,提示c-FLIP(L)参与了肺纤维化过程中的EMT发生。在细胞水平,进一步实验证明c-FLIP(L)高表达能够增强TGF-β1 诱导的EMT进程。尽管c-FLIP(L)调控EMT的作用机制以及参与肺纤维化的作用机制还有待阐明,但本研究提出了肺纤维化中c-FLIP(L)的异常表达可能是IPF 治疗的潜在靶点,从新的角度探究肺纤维化的发病机制,靶向EMT调控为缓解肺纤维化疾病进展提供新的可能途径。

