法舒地尔二氯乙酸盐对低氧性肺动脉高压大鼠的治疗作用及机制
刘 萍,周 宏,伍雪橙,黄张建,孔 辉,解卫平*
1南京医科大学第一附属医院呼吸与危重症医学科,江苏 南京 210029;2中国药科大学新药研究中心天然药物活性组分与药效国家重点实验室,江苏 南京 210009
肺动脉高压(pulmonary hypertension,PH)是一类由多种病因引起的,以肺动脉压力异常升高,同时合并不同程度右心功能衰竭为特征的肺血管疾病[1]。PH 在大于65 岁人群中的患病率高达10%,其中低氧性肺动脉高压(hypoxic pulmonary hypertension,HPH)是最为常见的PH类型之一,常见于慢性缺氧(chronic hypoxia,CH)性肺病患者[2]。目前HPH的治疗以原发病的治疗为主,尚无推荐的靶向药物[3],无法逆转慢性缺氧导致的肺血管重构和肺血管阻力进行性升高,HPH患者预后仍然较差,因此探索治疗HPH的潜在靶点势在必行。
研究表明,针对多靶点联合用药已成为治疗PH的重要方向。ROCK 信号通路是目前研究PH 发病机制的热点之一。ROCK选择性抑制剂法舒地尔是一种细胞内钙离子拮抗剂,可阻断肌球蛋白轻链磷酸化,抑制血管收缩、痉挛,被用于治疗蛛网膜下腔出血后脑血管痉挛、冠状动脉疾病等[4],在不同PH实验动物模型中均有降低肺动脉压力、抑制肺动脉重塑的功能[5-6],近期一项临床研究表明,法舒地尔在重度PH患者中也具有良好的治疗效果[7]。此外,丙酮酸脱氢酶激酶(pyruvate dehydrogenase kinase,PDK)信号通路也是PH研究的关注重点。PDK抑制剂二氯乙酸盐(dichloroacetate,DCA)可活化细胞表面Kv1.5 通道,减少钙离子内流,抑制细胞收缩、增殖,同时可抑制PDK 恢复丙酮酸脱氢酶活性,改善线粒体能量代谢,维持细胞正常生理功能[8],临床上主要用于治疗乳酸性酸中毒和代谢性疾病,也可用于抑制野百合碱诱导的大鼠肺血管重构[9],目前已进入临床研究阶段[10]。基于法舒地尔和DCA在PH动物模型及患者中的治疗作用,我们发现法舒地尔盐酸盐解离出的游离胺基可以和二氯乙酸结合形成一种新型水溶性口服盐类化合物——法舒地尔二氯乙酸盐(fasudil dichloroacetate,FDCA)[11]。本研究主要目的在于探讨FDCA 对慢性缺氧诱导的PH大鼠的治疗作用并揭示其潜在机制,为HPH治疗提供新的策略。
1 材料和方法
1.1 材料
清洁级成年健康雄性SD大鼠24只,体重(230±20)g,由南京医科大学动物中心提供。本研究所有实验操作经由南京医科大学实验动物福利伦理审查委员会许可(IACUC-2005021)。
FDCA(中国药科大学天然药物国家重点实验室制备),实验动物缺氧箱(杭州艾普仪器设备有限公司),RIPA 裂解液、BCA 检测试剂盒(上海碧云天生物技术有限公司),大鼠白介素(interleukin,IL)-1β、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)ELISA 试剂盒(武汉华美生物工程有限公司),肌球蛋白轻链激酶(myosin light chain kinase,MLCK)ELISA试剂盒、肌球蛋白轻链磷酸化酶(myosin light chain phosphorylase,MLCP)ELISA 试剂盒(南京翼飞雪生物科技有限公司),β-actin、ROCK1、ROCK2抗体(Proteintech公司,美国)。
1.2 方法
1.2.1 HPH动物模型的建立及给药方案
SD大鼠随机分为4组:对照组(CON组)、CON+FDCA组、CH组、CH+FDCA组,每组6只。将CH组及CH+FDCA组大鼠置于常压低氧箱中,舱内氧气浓度维持在(10.0±0.1)%,同时放置钠石灰吸收CO2,变色硅胶吸收水蒸气。每天开箱1 h 更换饮用水、饲料、垫料、钠石灰与变色硅胶,其余时间均保持低氧环境。CON 组与CON+FDCA 组置于正常环境中。缺氧第15 天开始,CON+FDCA 组及CH+FDCA 组予FDCA(43.3 mg/kg)灌胃治疗,CON 及CH 组予等体积生理盐水,每天1次,于开箱1 h内完成,持续14 d。总缺氧时间为28 d。
1.2.2 右心导管检查及右心室肥厚程度测定
所有大鼠称重后予以2%戊巴比妥钠溶液(60mg/kg)腹腔注射麻醉。将麻醉后大鼠仰卧固定于动物操作台上,分离右颈总静脉并做一“V”型切口,插入充盈肝素钠溶液的聚乙烯导管。导管弯头端经上腔静脉、右心房至右心室,另一端连接压力换能器,应用Powerlab 生物信号采集系统测定右心室收缩压(right ventricular systolic pressure,RVSP)。RVSP 测定结束后处死大鼠,收集大鼠心脏。沿室间隔边缘游离出右心室(right ventricle,RV)及左心室+室间隔(left ventricle+septum,LV+S)。滤纸吸干水分后分别称量RV 和LV+S 的重量,计算RV/(LV+S)比值,即为右心室肥厚指数(right ventricular hypertrophy index,RVHI)。
1.2.3 肺小动脉形态学分析
宝玉爹说,这本来是岳舞台老生泰斗丁爱田老先生的绝活,一次偶然的机会,我找他的徒弟偷学了一点,也只不过学了一点皮毛而已。
分离左肺上叶,在4%多聚甲醛中固定24 h,石蜡包埋后制成5 μm 厚度切片并进行苏木素-伊红(hematoxylin-eosin,HE)染色、α-SMA 免疫组织化学染色及Masson染色,于光学显微镜下观察肺小动脉病理变化。每张切片随机拍摄至少20 张直径30~100 μm 肺小动脉,计算肺小动脉中膜层肥厚程度(pulmonary artery medial thickness,PAMT)=(血管外径-血管内径)/血管外径×100%。根据肺小动脉α-SMA阳性表达部分占血管周径的比例,将肺小动脉分为非肌化(<25%)、部分肌化(25%~75%)和完全肌化(>75%)3种类型,分别统计各类型血管所占百分比。使用Image Pro Plus 6.0软件统计Masson染色图片中蓝色区域胶原蛋白沉积面积与总面积的比值,评估肺小动脉外膜纤维化程度。
1.2.4 右心室形态学分析
分离右心室组织,在4%多聚甲醛中固定24 h,石蜡包埋后制成5 μm 厚度切片并进行HE 染色。在光学显微镜下观察右心室心肌细胞病理变化。使用Image J 软件统计右心室心肌细胞横截面积(cross-sectional area,CSA)。
1.2.5 ELISA法检测肺组织中IL-1β、IL-6、TNF-α以及MLCK、MLCP水平
称取100 mg 肺组织,剪碎加入1 mL PBS,匀浆后3次冻融使细胞破坏释放出细胞内成分,4 ℃离心机,3 000 r/min 离心20 min,收集上清。按照ELISA试剂盒说明书进行分析。肺组织中IL-1β、IL-6、TNF-α含量最终以pg/mL计算,MLCK、MLCP水平最终以U/L计算。
1.2.6 Western blot 检测肺组织中ROCK1、ROCK2表达水平
称取30 mg 大鼠肺组织,加入含蛋白酶抑制剂的RIPA 裂解液,剪碎、匀浆,提取肺组织总蛋白。BCA 法测定蛋白含量。蛋白经电泳分离后转移至PVDF 膜上,5%脱脂奶粉溶液室温封闭1 h,加入抗ROCK1、ROCK2抗体(稀释比例1∶1 000),4 ℃孵育过夜。TBST洗涤3次后加入二抗(稀释比例1∶5 000),室温孵育1 h。TBST 洗涤3 次后加入ECL 化学发光液,置于化学发光仪中合适条件下曝光并保存图像,结果用Image Lab软件进行分析。
1.3 统计学方法
采用SPSS 22.0软件对数据进行统计学处理,所有数据以均数±标准差()表示。多组样本间数据分析采用单因素方差分析,组间比较使用LSD-t检验法。P<0.05为差异有统计学意义。
2 结果
2.1 FDCA对HPH大鼠RVSP和RVHI的影响

图1 FDCA对HPH大鼠RVSP和RVHI的影响Figure 1 Effects of FDCA on RVSP and RVHI in rats with HPH
2.2 FDCA对HPH大鼠右心室心肌细胞肥大的影响
HE 染色结果显示:CON 组与CON+FDCA 组右心室心肌细胞结构正常,CSA 较小;CH 组右心室心肌细胞肥大;CH+FDCA 组心肌细胞较CH 组变小(图2A)。右心室CSA 统计结果显示:与CON 组及CON+FDCA 组相比,CH 组右心室心肌细胞CSA 显著增加;CH+FDCA 组右心室心肌细胞CSA较CH组显著降低,差异有统计学意义(P<0.01,图2B)。

图2 FDCA对HPH鼠右心室心肌细胞肥大的影响Figure 2 Effects of FDCA on right ventricular cardiomyocyte hypertrophy in rats with HPH
2.3 FDCA 对HPH 大鼠肺小动脉中膜肥厚及炎症浸润的影响
HE 染色结果显示:CON 组与CON+FDCA 组肺小动脉结构正常,血管壁薄,血管周围无明显炎症细胞浸润;CH组肺小动脉中膜层增厚,血管周围有大量炎症细胞浸润;CH+FDCA组肺小动脉中膜层较CH 组变薄,炎症细胞浸润程度较CH 组减轻(图3A)。PAMT统计结果显示:与CON组及CON+FDCA组相比,CH组PAMT显著增加;CH+FDCA组PAMT较CH组显著降低,差异有统计学意义(P<0.01,图3B)。

图3 FDCA对HPH大鼠肺小动脉中膜肥厚的影响Figure 3 Effects of FDCA on pulmonary arterial medial thickness in rats with HPH
2.4 FDCA对HPH大鼠肺小动脉肌化程度的影响
α-SMA免疫组织化学染色结果显示:CON组及CON+FDCA 组肺小动脉壁α-SMA 阳性区域较少;CH组肺小动脉壁α-SMA阳性区域增加;FDCA治疗可以减少血管周围α-SMA 阳性沉积(图4A)。肌化血管类型统计结果显示:CON组及CON+FDCA组肺小动脉以非肌化血管为主,CH组完全肌化血管比例显著增加,差异有统计学意义(P<0.01)。与CH组相比,CH+FDCA可以显著减少完全肌化血管比例,肌化程度以非肌化和部分肌化为主(P<0.01,图4B)。

图4 FDCA对HPH大鼠肺小动脉肌化程度的影响Figure 4 Effects of FDCA on muscularization of pulmonary artery in rats with HPH
2.5 FDCA对HPH大鼠肺小动脉外膜纤维化的影响
Masson染色结果显示:CON组与CON+FDCA组肺小动脉外膜层仅有少量蓝色胶原沉积,CH 组肺小动脉外膜层蓝色胶原沉积区域增加,CH+FDCA组蓝染区域较CH组减轻(图5A)。肺小动脉外膜纤维化程度统计结果显示:与CON组及CON+FDCA组相比,CH 组肺小动脉外膜纤维化程度显著增加;CH+FDCA 组肺小动脉外膜纤维化程度较CH 组显著降低,差异有统计学意义(P<0.01,图5B)。
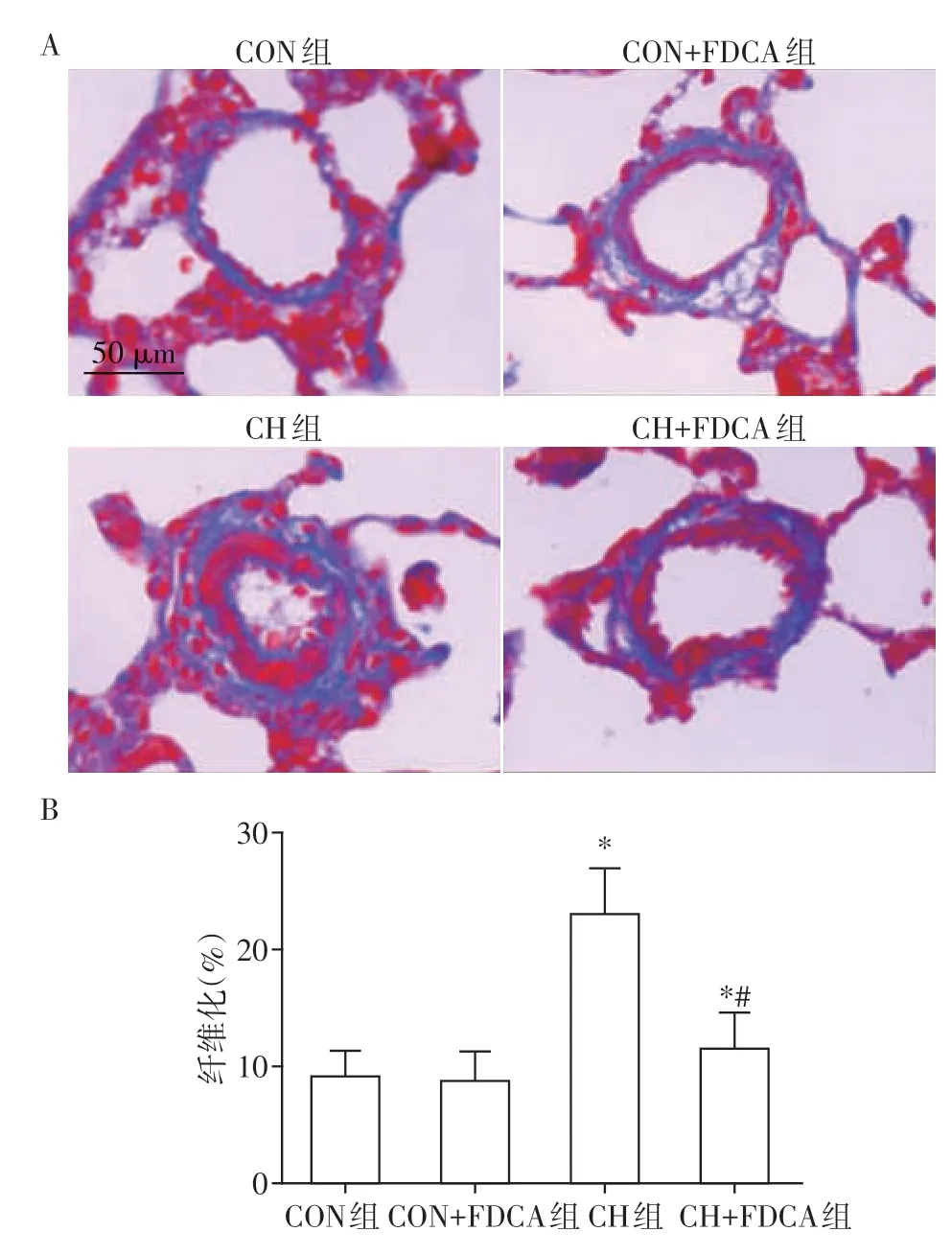
图5 FDCA对HPH大鼠肺小动脉外膜纤维化的影响Figure 5 Effects of FDCA on fibrosis of pulmonary arteriolar adventitia in rats with HPH
2.6 FDCA 对HPH 大鼠肺组织中炎症因子水平的影响
ELISA法检测肺组织匀浆中IL-1β、IL-6、TNF-α的含量。统计结果显示:CON 组及CON+FDCA 组IL-1β、IL-6、TNF-α的表达均无明显差异(P>0.05,图6)。与CON 组相比,CH 组肺组织IL-1β、IL-6、TNF-α的表达均明显增加;CH+FDCA 组肺组织IL-1β、IL-6、TNF-α的表达较CH组显著降低,差异有统计学意义(P<0.01,图6)。CH+FDCA组TNF-α的表达水平与CON组相比差异无统计学意义(P>0.05,图6C)。

图6 FDCA对HPH大鼠肺组织中IL-1β、IL-6、TNF-α表达的影响Figure 6 Effects of FDCA on expression of IL-1β,IL-6 and TNF-α in pulmonary tissues of rats with HPH
2.7 FDCA对HPH大鼠肺组织中MLCK和MLCP表达水平的影响
ELISA 法检测肺组织匀浆中MLCK 和MLCP 的水平。统计结果显示:CON 组及CON+FDCA 组MLCK、MLCP的表达水平均无明显差异(P>0.05)。与CON 组相比,CH 组肺组织匀浆中MLCK表达水平明显增加,MLCP 表达水平明显降低;CH+FDCA 组与CH 组相比,肺组织中MLCK 表达水平降低,MLCP 表达水平升高,差异有统计学意义(P<0.01,图7)。CH+FDCA 组肺组织MLCK、MLCP 的表达水平与CON 组相比差异无统计学意义(P>0.05)。

图7 FDCA对HPH大鼠MLCK、MLCP表达的影响Figure 7 Effects of FDCA on expression of MLCK and MLCP in rats with HPH
2.8 FDCA 对HPH 大鼠肺组织中ROCK1、ROCK2蛋白表达的影响
Western blot 半定量结果显示:CON 组及CON+FDCA 组ROCK1、ROCK2的表达水平均无明显差异(P>0.05)。与CON 组相比,CH 组肺组织匀浆中ROCK1、ROCK2 表达水平均明显增加;CH+FDCA组与CH 组相比,肺组织中ROCK1、ROCK2 表达水平均有所降低,差异有统计学意义(P<0.01,图8);与CON 组相比,CH+FDCA 组肺组织ROCK1、ROCK2 的表达水平差异均无统计学意义(P>0.05)。

图8 FDCA对HPH大鼠ROCK1、ROCK2表达的影响Figure 8 Effects of FDCA on expression of ROCK1 and ROCK2 in rats with HPH
3 讨论
HPH 是临床上常见的一类PH,常继发于慢性阻塞性肺疾病、阻塞性睡眠呼吸暂停综合征、间质性肺病、慢性高原病等慢性缺氧性疾病[12]。HPH 的发生发展过程与肺血管结构、功能异常密切相关。慢性缺氧可以引起炎症反应、肺血管收缩、肺动脉重构(包括肺血管床内膜损伤、中膜肥厚与外膜纤维化),导致远端肺小血管闭塞,肺动脉管腔逐渐狭窄,肺血管阻力进行性升高,进而出现右心功能衰竭甚至死亡[13-15]。本研究采用慢性缺氧诱导的大鼠PH模型,探讨FDCA对HPH的治疗作用。结果显示缺氧4 周大鼠RVSP 异常升高,右心室代偿性肥厚,伴随明显的肺血管壁肥厚、肌化以及纤维化,提示成功构建HPH大鼠模型。FDCA可缓解慢性缺氧诱导的大鼠肺血管重构,调节血流动力学参数,减轻右心室肥厚,提示FDCA对HPH具有良好的治疗作用。
缺氧诱导的肺血管重构是HPH 重要的发病机制。肺血管重构是遗传因素、表观遗传因素以及环境因素共同作用的结果。近年来,炎症反应在肺血管重构中的作用备受关注[16]。研究发现PH动物模型及PH患者肺组织中均可见大量炎症细胞在重构的肺血管周围积累并向血管内浸润。这些肺血管细胞和炎症细胞可在局部产生大量细胞因子和趋化因子,主要包括IL-1β、IL-6、TNF-α、单核细胞趋化蛋白-1和趋化因子-5等。这些促炎细胞因子和趋化因子表达增加,可进一步促进血管细胞过度收缩与增殖,导致肺血管重塑[17]。研究表明,促炎性细胞因子水平升高的PH 患者临床预后较差,其中IL-6、IL-8、IL-10 等细胞因子的表达水平与PH 患者生存恶化相关[18-19]。本研究结果显示,FDCA可显著抑制HPH 模型大鼠肺组织中重构血管周围的炎症细胞浸润及肺组织炎症因子IL-1β、IL-6、TNF-α的表达,提示FDCA可减轻缺氧诱导的肺组织慢性炎症反应,这可能是其减轻肺小血管重构的重要原因之一。
肺血管重构机制复杂,涉及多个信号通路,其中ROCK通路是研究的热门通路之一。ROCK蛋白属于丝氨酸/苏氨酸激酶家族,是小GTP酶Rho A下游的效应分子,有ROCK1和ROCK2两个同工型,在人体内参与调控细胞形态、增殖、黏附和运动等重要的生物过程,在心血管、神经系统、代谢疾病及癌症的发生发展中起到重要作用[20-21]。ROCK1 和ROCK2 结构相似,具有高度的序列同源性,可以共享相同的蛋白质靶标。这两种亚型的ROCK分布广泛,ROCK1 主要在肺组织、肝、肾、脾和炎症细胞中大量表达,ROCK2主要分布在心脏、血管、肌肉(包括平滑肌)[22]。ROCK蛋白在HPH患者及动物模型肺组织中表达上调,参与炎症反应、肺血管收缩、肺血管重构等多个病理生理过程,但ROCK1和ROCK2的作用尚不完全明确。研究表明,在缺氧条件下,ROCK2通过诱导氧化应激、促进炎性细胞因子分泌调节血管平滑肌细胞的增殖和迁移,促进肺血管重构[23-24]。在新生血管内膜形成过程中,ROCK1参与炎症细胞的募集、炎症因子的释放、血管细胞的增殖、内皮黏附分子的表达以及血管平滑肌细胞迁移[20]。在心脏组织中,研究证明使用ROCK抑制剂可抑制小鼠病理性心肌肥大与心脏重塑[25]。本研究HPH模型大鼠肺组织中ROCK1和ROCK2的表达上调,FDCA可抑制慢性缺氧诱导的ROCK1和ROCK2的表达,提示FDCA可能部分通过抑制ROCK通路抑制炎症反应、减轻肺血管重构和右心室肥厚。
缺氧诱导的肺血管舒缩功能失调是HPH 肺血管阻力持续性升高的重要病理生理机制。MLCK和MLCP通过调节肌球蛋白轻链磷酸化水平来调节细胞收缩的一组关键酶。MLCK 是一种钙/钙调蛋白依赖的蛋白激酶,可使肌球蛋白轻链磷酸化,触发肺血管收缩;而MLCP 负责使磷酸化的肌球蛋白轻链脱磷酸,维持血管舒张,两者处于动态平衡状态。研究表明,缺氧可抑制离子通道Kv1.5,升高肺动脉平滑肌细胞胞浆内钙离子浓度,上调MLCK 表达,诱导细胞收缩,即钙依赖的细胞收缩。DCA 可抑制PDK 活性使Kv1.5 表达增加,减少肺动脉平滑肌细胞钙离子内流,从而抑制MLCK活性,改善肺血管收缩[26]。另一方面,缺氧激活ROCK通路,通过磷酸化MLCP的肌球蛋白结合亚基使MLCP失活,促进细胞收缩,即非钙依赖的细胞收缩。法舒地尔可抑制ROCK恢复MLCP活性,使细胞恢复舒张状态。在缺氧诱导的双重收缩机制下,肺动脉持续收缩,肺血管阻力进行性升高[27-28]。本研究中,FDCA治疗逆转了HPH模型大鼠肺组织中MLCK表达的增加和MLCP表达的降低,提示FDCA可同时作用于钙离子依赖的收缩机制和非钙依赖的收缩机制,抑制肺血管收缩,这可能是FDCA治疗HPH的另一重要机制。
综上所述,FDCA 可同时靶向ROCK 通路和PDK通路,通过多个机制共同抑制慢性缺氧诱导的肺血管收缩与重构,降低肺动脉压力,缓解右心室肥大,在HPH 动物模型上的治疗效果显著。且FDCA的两个基础药物法舒地尔与DCA 已在临床广泛使用,其安全性已被证实。然而,FDCA 作为一个分子,其相对于法舒地尔和DCA 的组合,在整体的组织分布和生物利用度方面有哪些优势,仍需要进一步研究来揭示潜在的机制。此外,DCA抑制PDK活性、恢复细胞能量代谢后对ROCK 通路是否有所影响,也需要深入的细胞分子生物学研究来阐明。总之,本研究结果表明,FDCA有望成为未来治疗HPH的候选药物之一。

