α7-nAChR通过抑制软骨细胞凋亡延缓小鼠膝骨关节炎关节软骨退变
章海军,黄嘉琛,钱考亮,胡 军,范卫民
南京医科大学第一附属医院骨科,江苏 南京 210029
骨关节炎(osteoarthritis,OA)是一种慢性退行性关节疾病,以缓慢发展的关节疼痛、僵硬伴活动受限等为主要临床特点。关节软骨细胞的变性退变是OA 的病理生理基础,但其确切的病因机制目前仍不清楚[1-2]。研究发现,在人类OA组织标本中,细胞凋亡与软骨破坏和基质消耗的程度呈正相关,在OA软骨中,18%~21%的软骨细胞表现出凋亡特征,而在正常软骨中,这一比例仅为2%~5%[3]。靶向软骨细胞凋亡的调控正成为OA治疗药物研究的重要方向[4-5]。
烟碱型乙酰胆碱受体(nicotinic acetylcholine receptor,nAChR)广泛分布于多种细胞,其中α7 烟碱型乙酰胆碱受体(α7 nicotinic acetylcholine receptor,α7-nAChR)是由5 个α7 亚单位组成的同源五聚体。α7-nAChR具有快速激活、快速脱敏和对Ca2+高度渗透的特点,在胆碱能抗炎通路介导的神经免疫网络调节中起着关键性作用[6]。研究表明α7-nAChR 兴奋后可产生一个快速衰减的内向电流,通过直接打开离子通道或间接兴奋电压依赖型钙通道而使细胞内游离钙水平提高,从而引发许多细胞内下游事件,包括蛋白激酶的激活,即早基因的表达,新蛋白的合成,最终导致神经元或非神经元功能的变化,产生众多生物学效应[7-8]。
Van Maanen 等[9]构建胶原诱导的关节炎模型,分为一侧迷走神经切除术或假切除术组、烟碱(nicotine,Nic)干预组、α7-nAChR激动剂组,结果表明迷走神经切除后关节炎症状加重,而给予口服Nic 后关节症状得到缓解,同时口服Nic 可抑制骨降解和抑制滑膜组织中肿瘤坏死因子(tumor necrosis factor,TNF)-α表达。本实验室前期研究发现,Nic可明显改善碘乙酸钠(monosodium iodoacetate,MIA)诱导的OA 模型小鼠的膝关节退变,减少关节软骨退变及周围滑膜增生,其机制与Nic激活α7-nAChR通过磷脂酰肌醇3 激酶/蛋白激酶B(PI3K/Akt)信号通路调控巨噬细胞功能有关[10],表明α7-nAChR 在类风湿性关节炎和OA 中皆发挥重要作用。但激活α7-nAChR 能否对关节软骨细胞的凋亡产生影响尚无此类报道。本研究通过关节腔内注射MIA 建立小鼠OA 模型,旨在探讨激活α7-nAChR 对OA 关节软骨细胞凋亡的作用及其机制。
1 材料和方法
1.1 材料
MIA、Nic 和α7-nAChR 特异性拮抗剂甲基牛扁碱(methyllycaconitine,MLA)(Sigma-Aldrich 公司,美国);Von Frey纤维丝(Woodland Hills公司,美国);B淋巴细胞瘤-2(Bcl-2)抗体(1∶1 000)、Bcl-2 相关X蛋白(Bax)抗体(1∶1 000)、活性含半胱氨酸的天冬氨酸蛋白水解酶-9(cleaved caspas-9)抗体(1∶1 000)和caspas-9抗体(1∶1 000)(Cell Signaling Technology公司,美国)。
1.2 方法
1.2.1 实验动物与模型制备
40 只C57BL/6J 雄性小鼠购于南京医科大学动物中心,10~12周龄,体重24~28 g。实验前,将动物置于实验环境中适应3 d。根据前期研究Nic、MIA和MLA的有效剂量[10],我们将小鼠随机分为以下5组:对照(control)组、MIA 模型组(每只小鼠左后腿膝关节内注射MIA 0.1 mg,体积为10 μL)、MIA+Nic(0.5 mg/kg)治疗组、MIA+Nic(1.0 mg/kg)治疗组和MIA+Nic(1.0 mg/kg)+MLA(1.0 mg/kg)治疗组,每组8 只小鼠。在MIA+Nic 治疗组中,小鼠在造模前连续腹腔注射0.5或1.0 mg/kg Nic 1周,每天1次,第7天时,给予Nic 后30 min,向小鼠的左后腿膝关节内注射0.1 mg MIA,第28 天处死小鼠。在MIA+Nic+MLA 治疗组中,小鼠在造模前除提前1 h 腹腔注射1.0 mg/kg Nic外,还提前30 min腹腔注射1.0 mg/kg的MLA。对照组小鼠和MIA 模型组小鼠同期腹腔注射等体积的生理盐水。第28天小鼠处死后,取左后膝关节软骨组织标本进行实验。上述操作程序均严格按照国际疼痛研究协会伦理委员会的规章、实验室动物管理和使用指南(中国科学技术部)的规定执行。所有动物实验均经南京医科大学实验动物福利伦理委员会批准,旨在最大程度地减少痛苦并减少所用动物的数量。
1.2.2 小鼠行为学检测
在进行基线测试之前,将小鼠置于测试环境至少3 d 以适应测试环境。使用Von Frey 纤维丝测定小鼠后爪机械缩足反射潜伏期阈值,用以评价小鼠的疼痛行为。测试时,首先将小鼠放入金属网地板的盒子中,使其适应30 min。将标准的Von Fery 纤维丝(0.008 g、0.02 g、0.04 g、0.07 g、0.16 g、0.4 g、0.6 g、1.0 g、1.4 g和2.0 g)刺激小鼠左后爪的足底表面,直到纤维弯曲,记录所用Von Fery纤维丝提供的刺激力。对每只小鼠进行3 次测试,计算测量阈值的平均值。当小鼠表现出对≤0.4 g 的刺激有反应时,则判定为异常,正常小鼠的阈值在1~2 g[10]。
1.2.3 组织学分析
新鲜获得的整个小鼠左后膝关节迅速固定在4%多聚甲醛中,常规脱钙、脱水后用石蜡包埋固定。标本切片、脱蜡后,分别用甲苯胺蓝染色和番红固绿染色。
甲苯胺蓝染色时,标本先用甲苯胺蓝溶液浸泡30 min,清洗后置于冰醋酸溶液中,蒸馏水清洗2次,随后逐级乙醇脱水、二甲苯透明、中性树胶封固。由两位病理学医师依据评分标准在光学显微镜下观察软骨病变、软骨下糖胺聚糖改变并对甲苯胺蓝染色标本进行评分,取两者平均分为最后得分。
番红固绿染色时,标本用l%番红染液浸染3 min,1%固绿复染3 min,95%酒精分化数秒,复加番红染色2 min,镜下95%酒精分化数秒,随后逐级乙醇脱水、二甲苯透明、中性树胶封固。根据关节软骨退变评分和蛋白聚糖损失评分标准分别在光学显微镜下观察软骨病变[11-12],对番红固绿染色标本评分,取两者平均分为最后得分。
1.2.4 石蜡切片荧光TUNEL实验
试剂盒采用Fluorescein(FITC)Tunel Cell Apoptosis Detection Kit(G1501-50T,Servicebio 公司,美国),按试剂盒说明书应用TUNEL 染色评估凋亡细胞数量。依次将石蜡切片脱蜡水洗后,用蛋白酶K工作液覆盖组织,然后用PBS(pH7.4)在脱色摇床上晃动洗涤3 次,每次5 min,切片稍甩干后在圈内滴加破膜工作液覆盖组织。按片子数量和组织大小取TUNEL 试剂盒内适量试剂1(TdT)和试剂2(dUTP)按1∶9混合,覆盖组织。随后将切片平放于湿盒内。细胞核加DAPI 染液复染后封片,倒置荧光显微镜(Eclipse Ti-SR,Nikon 公司,日本)下观察细胞并采集图像,并通过HALO 软件计算出TUNEL阳性细胞的百分比[13-14]。
1.2.5 蛋白质免疫印迹
取出小鼠膝关节软骨,蛋白提取试剂盒提取蛋白,并测定蛋白质浓度。蛋白质经10%十二烷基硫酸钠中凝胶电泳,4 ℃100 V 转移1.5 h至硝酸纤维素膜上。用5%脱脂奶粉溶液在室温下封闭1 h,然后加入相应一抗Bcl-2、Bax、cleaved caspase-9和caspase-9,4 ℃孵育过夜。第2天洗膜后,与相应二抗在常温下孵育1 h。显色、成像,并使用Image J(2.0)分析软件对条带灰度分析,计算蛋白质的相对表达量。
1.3 统计学方法
采用SPSS22.0 软件进行统计分析。计量资料以均数±标准差()表示,组间比较采用单因素方差分析,组间两两比较采用SNK 法。P<0.05 为差异有统计学意义。
2 结果
2.1 Nic对OA模型小鼠关节疼痛的影响
如图1 所示,MIA 给药后1~3 周,小鼠的运动功能受到明显影响,引起机械性痛觉超敏,痛阈下降,第1 周MIA 组小鼠机械缩足反射潜伏期阈值为(0.21 ± 0.04)g,较正常对照组下降80%,持续至第3 周MIA组机械缩足反射潜伏期阈值仍较对照组下降约69%(P<0.05);而给予Nic 进行预处理,能显著增加小鼠的运动功能评分,其中1.0 mg/kg Nic 较0.5 mg/kg Nic效果更为明显,Nic预处理21 d后,小鼠机械缩足反射潜伏期阈值可恢复至(1.08±0.09)g,接近对照组水平(P>0.05),表明Nic能减轻MIA引起的疼痛行为。同时,选择性的α7-nAChR 拮抗剂MLA(1.0 mg/kg)能取消Nic 对MIA 模型小鼠的镇痛作用,MLA组小鼠机械缩足反射潜伏期阈值显著下降至(0.25±0.04)g,与Nic 预处理组比差异有统计学意义(P<0.05),表明Nic 可能是通过α7-nAChR发挥镇痛作用。
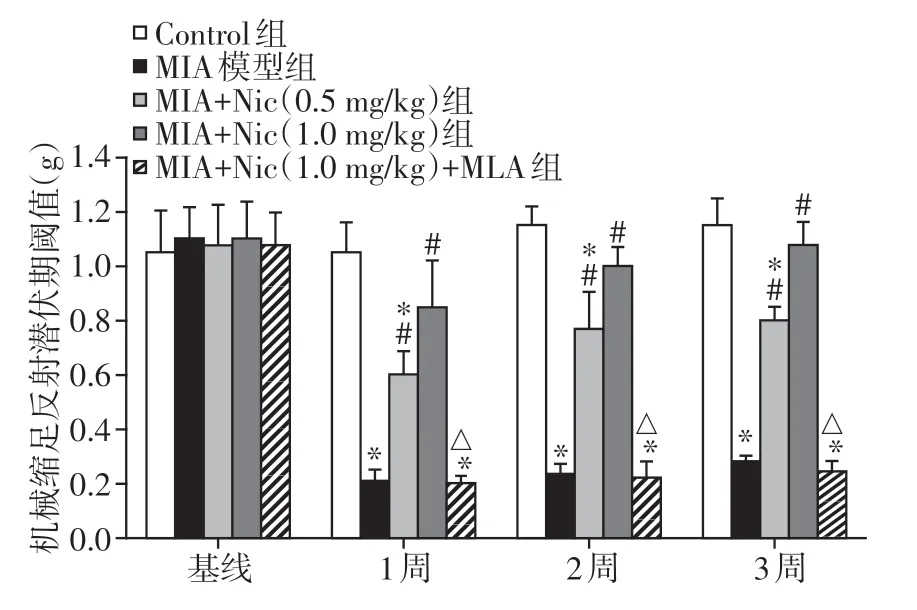
图1 Nic 对MIA 模型小鼠Von Frey 纤维丝实验中疼痛行为的影响Figure 1 Effects of Nic treatment on pain behavior in mice subjected to MIA injection
2.2 Nic对MIA诱导的小鼠关节软骨退化及细胞凋亡的影响
关节内注射0.1 mg/10 μL MIA可诱发膝关节软骨退化,甲苯胺蓝和番红固绿染色(图2A)显示MIA组关节软骨浅表层纤维化,表面完整性破坏,结构紊乱,裂隙深,可见放射带,软骨细胞明显减少,潮线破坏。MIA组关节软骨退变评分和蛋白聚糖损失评分分别为(5.33±1.19)分和(2.33±0.27)分,1 mg/kg Nic 可显著降低关节软骨退变评分和蛋白聚糖损失评分(P<0.05,图2B、C)。软骨细胞再次清晰可辨,排列规整、致密,近似水平排列,软骨潮线结构恢复存在。TUNEL 荧光染色显示MIA 可诱发膝关节软骨细胞发生凋亡,MIA组软骨细胞凋亡率明显增高,达到(31.83±3.89)%,是对照组的6.58倍(P<0.05,图2A)。1.0 mg/kg Nic 可显著降低软骨细胞凋亡率(P<0.05,图2D),这一结果表明Nic 对MIA 诱导的关节软骨退变及细胞凋亡具有保护作用,而α7-nAChR 选择性拮抗剂MLA 可抵消Nic 对软骨细胞凋亡的保护作用,使得软骨细胞凋亡率重新升高至(31.67±5.35)%。
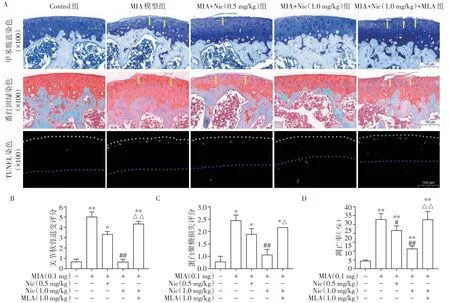
图2 Nic对MIA模型小鼠膝关节退化及软骨细胞凋亡的影响Figure 2 Effects of Nic on knee joint degradation and apoptosis in mice subjected to MIA injection
2.3 Nic对MIA诱导的软骨细胞凋亡相关蛋白表达的影响
Western blot 实验结果显示,MIA 造模小鼠关节软骨中Bcl-2的蛋白表达显著下调,同时Bax蛋白的表达上调,cleaved caspase-9 表达增加。而Nic 治疗组Bcl-2 的蛋白表达上调,Bax 蛋白表达和cleaved caspase-9/caspase-9 的比率降低,α7-nAChR 特异性拮抗剂MLA可抵消Nic对MIA诱导的软骨细胞凋亡相关蛋白表达的影响(图3)。考虑到caspase-9是半胱氨酸天冬氨酸蛋白酶家族的重要成员。受到凋亡刺激时,线粒体释放的细胞色素C 会结合procaspase-9/凋亡酶激活因子-1(Apaf-1)。Apaf-1 介导的caspase-9 激活涉及固有蛋白酶解加工,可导致cleaved caspase-9增加,启动caspase 级联,进而导致凋亡。因此Nic对MIA诱导的软骨细胞凋亡的影响可能与线粒体途径相关[15-16]。
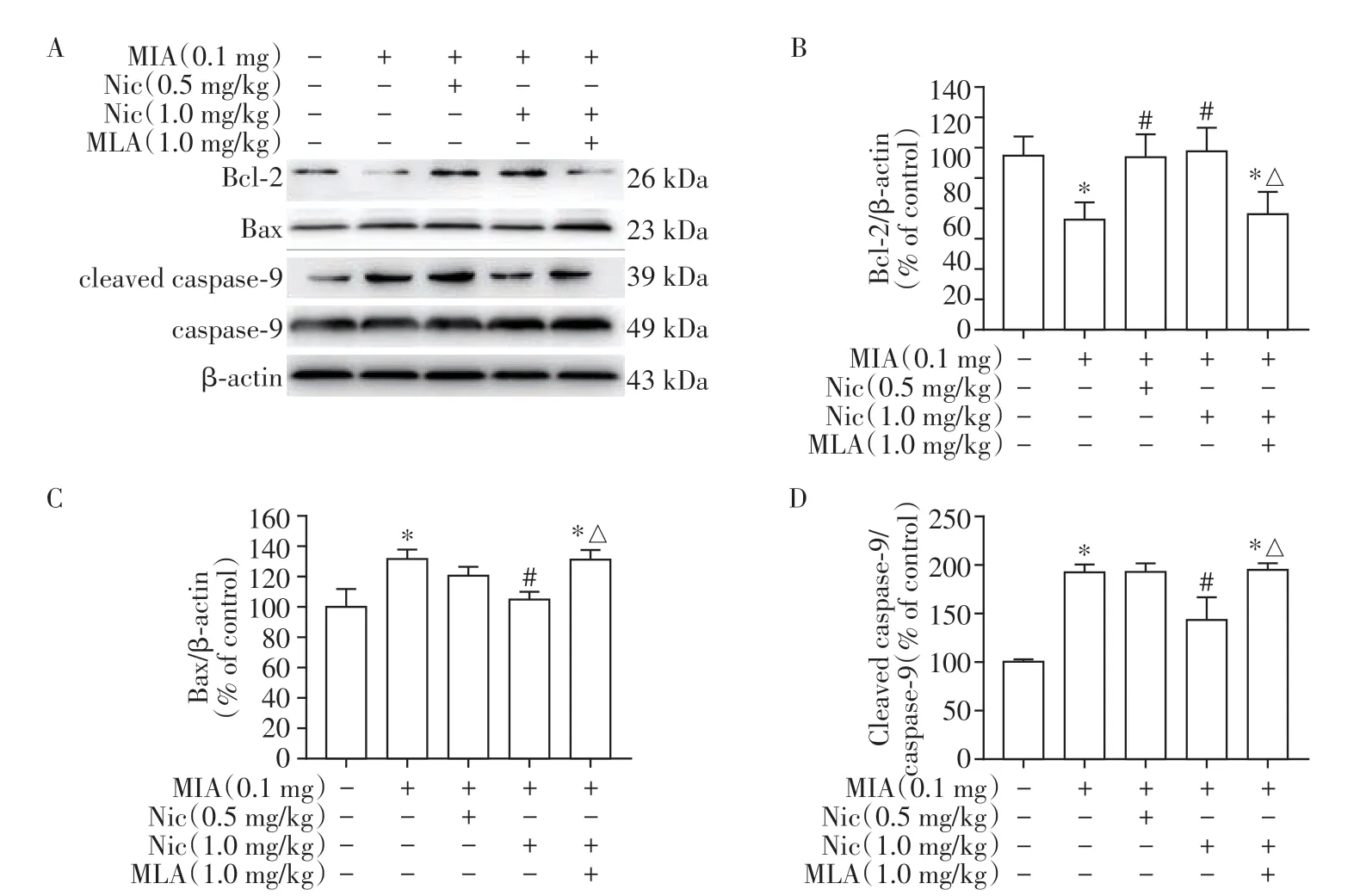
图3 Nic对MIA模型小鼠膝关节软骨凋亡相关蛋白表达的影响Figure 3 Effects of Nic on the expression of apoptosis-related proteins in mice subjected to MIA injection
3 讨论
越来越多的研究发现胆碱能抗炎通路在免疫系统中发挥重要作用,感染或损伤的分子产物激活感觉神经元到达迷走神经脑干部,诱发从脑干到脾脏或其他器官的动作电位,最终导致T 细胞释放乙酰胆碱,后者与α7-nAChRs结合可抑制巨噬细胞中细胞因子的释放[17]。α7-nAChR是近年来多种炎性疾病的研究热点,是胆碱能抗炎通路中的关键分子[18]。Van Maanen 等[19]发现在α7-nAChR 敲除小鼠中,胶原诱导的关节炎严重程度显著增加,滑膜炎症和关节破坏也明显增多。Li等[20]研究进一步发现Nic干预可明显缓解胶原诱导的关节炎动物模型相关临床和组织病理学变化,减少滑膜中CD11b 阳性巨噬细胞的数量,下调血清中巨噬细胞炎性蛋白和单核细胞趋化蛋白的表达水平,而迷走神经切除则加重了关节炎程度,上调单核细胞趋化蛋白的表达水平[20-21]。以上研究证实α7-nAChR 在胶原诱导的关节炎模型的发生与发展中发挥重要作用,胶原诱导的关节炎模型的病理特点与类风湿关节炎接近,α7-nAChR在OA动物模型中的作用机制仍不清楚。
OA 的主要病理变化是软骨退变,软骨细胞合成代谢与分解代谢的动态平衡有助于维持软骨细胞外基质结构和功能完整,因此软骨细胞功能是调控细胞外基质稳定的关键因素之一。越来越多的研究发现:软骨细胞凋亡与OA 的发生发展密切相关,寻找软骨细胞凋亡调控的新靶点正成为OA 研究的热点问题[22]。本实验室前期研究发现,Nic 通过激活α7-nAChR 调控细胞外调节蛋白激酶1/2(ERK1/2)和p38 丝裂原活化蛋白激酶抑制脂多糖诱导的脑星形胶质细胞的活化[16]。Que 等[23]发现FK506在体外能抑制成纤维细胞的增殖并诱导其凋亡,而ERK1/2抑制剂PD98059可以抑制FK506诱导的成纤维细胞凋亡。Zhou等[24]发现p38在骨髓增生异常综合征的骨髓中过度活化,并诱导造血干细胞凋亡,在分子水平抑制p38 MAPK 通路可以减少干细胞凋亡,并刺激体外造血祖细胞的造血作用,说明ERK1/2 和p38 丝裂原活化蛋白激酶均参与了凋亡信号通路的调控,但Nic 能否通过激活α7-nAChR对关节软骨细胞的凋亡产生影响仍不清楚,本研究构建了MIA 诱导的小鼠膝OA 模型[25],发现MIA 可以明显诱导小鼠膝关节疼痛,Nic 对小鼠膝关节疼痛有明显的缓解作用,α7-nAChR 阻断剂MLA 可以消除这种缓解作用,MIA 注射后可致小鼠膝关节面软骨糜烂,软骨下骨暴露,软骨细胞显著减少,基质染色重度减退,关节软骨退变评分和蛋白聚糖评分明显升高,软骨细胞凋亡率增加,Nic小鼠腹腔内给药可明显阻断OA病理进程,软骨细胞凋亡率下降,α7-nAChR阻断剂MLA可拮抗这种保护作用。
对Nic 凋亡调控机制的深入研究发现,MIA 可破坏软骨细胞凋亡相关蛋白Bax/Bcl-2 的稳态及促进cleaved caspase-9/caspase-9 比值升高,Bcl-2 通过抑制线粒体细胞色素C的释放而作为一种广泛的凋亡调节蛋白,参与调节线粒体的钙稳态和质子流。相反,Bax则与线粒体膜上的孔蛋白相互作用并提高线粒体细胞色素C的通透性,从而导致线粒体中细胞色素C的释放和caspase的活化,导致凋亡[26-27]。本研究发现Nic 可以稳定Bax/Bcl-2 的比例,并通过α7-nAChR 抑制caspase-9 的裂解,提示α7-nAChR 可通过抑制线粒体介导的软骨细胞凋亡延缓小鼠膝骨关节炎关节软骨退变,α7-nAChR可成为OA治疗的新靶点。但需要注意的是,凋亡信号转导主要通路不仅包括线粒体通路,还包括死亡受体通路、内质网通路等,这3种凋亡途径并非完全独立,在某些情况下它们存在相互联系,已有研究表明,Bcl-2 与线粒体通路及死亡受体通路均关系密切[28],因此α7-nAChR 是否在其他凋亡信号转导通路中发挥作用仍需要进一步研究。

