显微镜下三联手术治疗合并白内障的孔源性视网膜脱离的效果
李健 陈海英 黄正如
作者单位:江苏省常熟市第二人民医院眼科,苏州 215500
目前,孔源性视网膜脱离(Rhegmatogenousret inaldetachment,RRD)最常用的手术治疗方式是巩膜扣带术和玻璃体切割术。虽然随着玻璃体视网膜手术技术及设备的发展进步,白内障超声乳化吸除、人工晶状体(IOL)植入联合玻璃体切割手术的适应证日益宽泛,但经睫状体平坦部入路玻璃体切割手术(Pars planavitrectomy,PPV)有其不足之处,如手术创伤大、费用相对昂贵、玻璃体腔气体或硅油填充所导致的术后高眼压、填充物需二期手术取出,而且患者在术后较长时期内需要采用俯卧位,对老年患者而言依然是痛苦、艰难和漫长的等待过程。巩膜扣带术在治疗单纯性RRD方面依旧具有不可替代的优势[1]。临床上相当部分的RRD患者合并白内障,因白内障而影响眼底检查的占RRD患者的3.5%~6.7%[2,3]。1997年,Girard和Saade[2]首先报道白内障超声乳化摘除、后房型人工晶状体植入联合巩膜扣带手术治疗合并白内障的RRD,手术成功率达到87%(13眼/15眼),随后一些学者在Girard报道的手术基础上进行了一些尝试和改进,也取得了较好的效果[3,4]。本研究回顾分析了在本院进行的白内障超声乳化吸除、IOL植入和巩膜外加压三联手术治疗的病例,现将结果报告如下。
1 对象与方法
1.1 对象
将2010年1月至2017年12月在常熟市第二人民医院眼科确诊的RRD合并白内障患者17例(17眼)纳入本研究,其中男8 例,女9 例。年龄52~77(66.4±6.6)岁。视网膜脱离时间1~32(4.3±6.1)周。最佳矫正视力(BCVA):手动/眼前~0.5。纳入标准[2]:①RRD合并白内障;②增殖性玻璃体视网膜病变C1级以下;③无严重全身疾病;④患者知情同意。排除标准:①巨大裂孔、黄斑裂孔、不同象限多发裂孔、赤道后部孔源性视网膜脱离;②增殖性玻璃体视网膜病变C2级以上。本研究遵循赫尔辛基宣言,通过常熟市第二人民医院伦理委员会论证(批号:2009051)。
1.2 白内障程度及视网膜脱离情况
按照美国国立眼科研究所指定的晶状体混浊分类系统(Lens Opacities Classification System Ⅱ,LOCS Ⅱ)分级标准[5],17 眼的晶状体混浊程度为N1C3P0~N3C3P3,其中17 眼90D前置镜下均可以观察到视网膜脱离且至少可见1 处明确的视网膜裂孔。视网膜脱离累及黄斑区13 眼,未累及黄斑区4 眼;正视及低度近视13 眼,中高度近视4 眼(-12.0~-3.0 D)。其中马蹄孔10眼,圆形孔7眼。颞上象限裂孔11眼,颞下象限裂孔4眼,鼻上象限裂孔2眼。单发裂孔13眼,不超过1个象限范围内的簇状多发裂孔4眼。增殖性玻璃体视网膜病变A级14眼,B级3眼。
1.3 方法
1.3.1 一般眼科检查 常规检查裸眼视力、BCVA,利用非接触式眼压计检查眼压,在裂隙灯显微镜下检查角膜、前房、晶状体、前段玻璃体,并通过前置镜检查后段玻璃体及视网膜,进一步在三面镜辅助下检查视网膜,常规进行眼部A超(见图1)和眼部B超检查。
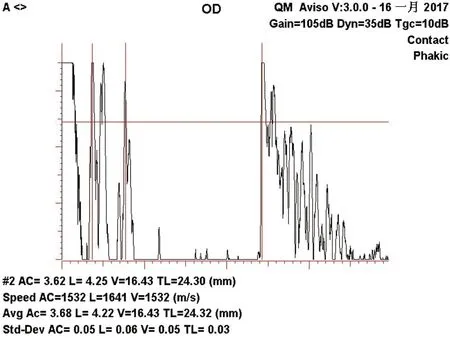
图1.视网膜脱离眼A超检查结果图示检查显示前房深度、晶状体厚度及眼轴长度,左侧起始波为探头头端产生的饱和波,前房为小平段,随后右侧2个平行的高波峰为晶状体前、后交界面反射波峰,随后较宽的平段是玻璃体,其后的饱和波代表玻璃体与视网膜的界面波,球壁波后是一串排列紧密的眶组织高振幅波Figure 1.A-scan ultrasound image of retinal detachment.Results show the depth of the anterior chamber,the thickness of the lens,and axial length.The initial wave on the left is the saturation wave produced by the tip of the probe,the anterior chamber is the small,flat segment,and the two parallel peaks on the right are the reflection peaks at the anterior and posterior interfaces of the lens.The later wide segment is vitreous,the subsequent saturation wave represents the interface wave between the vitreous and retina.A series of closely arranged high-amplitude waves of orbital tissue are behind the spherical wall.
1.3.2 IOL屈光度测量 先通过验光仪测出角膜曲率,在A超检查界面输入角膜曲率数值,患者仰卧位于检查床上,75%乙醇棉片消毒A超探头,静待乙醇自然挥发,患者双眼结膜囊滴奥布卡因滴眼液2次进行表面麻醉,嘱患者注视检查室正上方的天花板,A超探头垂直于角膜中央表面,当A超探头接触到角膜表面时,机器自动连续收集10 次数据并进行自动计算均数和标准差,检查过程中避免探头按压角膜,避免探头倾斜放置,如标准差>0.05 mm,提示存在误差较大的数据,将明显偏离均数的数值删除,再补充测量数据,机器将再次进行自动计算均数和标准差。检查过程中注意A超波形形态。待A超测量好眼轴数据后,点击IOL计算界面,以SRK-Ⅱ公式计算IOL屈光度数,若患者近视屈光度数高于-6.0 D,则以SRK-T公式计算IOL屈光度数。
1.3.3 手术方法 所有手术操作均由同一位医师完成。17眼均以罗哌卡因球后神经阻滞麻醉及球结膜下浸润麻醉。首先做右上方2.8 mm透明角膜隧道主切口及左侧透明角膜隧道穿刺切口,从切口进入前房注入黏弹剂,自主切口进入前房,通过撕囊镊完成连续环形撕囊,充分进行水分离和水分层,然后利用超声乳化吸除晶状体核,随后在I/A模式下吸除晶状体皮质,角膜切口水化密闭。完成前述白内障摘除步骤后,于裂孔相应位置角膜缘剪开一个象限的球结膜,相邻直肌下置牵引线,分离暴露巩膜,显微镜直视下用1 ml注射器针头在视网膜脱离最高处巩膜面斜行穿刺引流视网膜下液,在显微镜直视下直接以冷凝头自巩膜外向球心方向顶压定位、冷凝裂孔,并以亚甲蓝标记。然后根据裂孔位置、形状、裂孔长轴方向利用硅海绵进行平行于角膜缘的环形巩膜外加压或者垂直于角膜缘的放射状巩膜外加压。外加压缝线结扎完成后再次在巩膜外顶推加压的硅海绵,显微镜直视下再次确认裂孔位于加压嵴前,封闭确切。最后植入IOL于囊袋中,注吸黏弹剂,再次水密角膜切口。手术结束前根据眼压情况确定玻璃体是否需注射消毒空气,17眼玻璃体均注射了消毒空气0.6~1.2 ml。
1.4 术后处理及随访
术后患者半卧或侧卧体位使裂孔处于相对高位。局部给予复方妥布霉素滴眼液、普拉洛芬滴眼液抗炎治疗,给予复方托吡卡胺滴眼液散瞳。术后随访6~24(15.2±3.6)个月,随访期间观察视力、眼压、视网膜复位情况、黄斑形态以及并发症等。
1.5 统计学方法
回顾性研究。采用STATA 12统计学软件进行数据处理。对手术前后BCVA的比较以及预设术后屈光度和术后实测屈光度的比较行Wilcoxon符号秩和检验。以P<0.05为差异有统计学意义。
2 结果
2.1 视力
术后12 个月,BCVA为0.12~1.0,15 眼术后BCVA高于术前,1眼BCVA无变化,1眼BCVA低于术前。手术前后BCVA差异有统计学意义(Z=3.825,P<0.001)。
2.2 视网膜复位情况
术后1 d,90 D前置镜检查见17眼视网膜下液均吸收,视网膜均解剖复位。术后检查示视网膜裂孔均准确位于加压嵴上,封闭良好。术后1 个月,OCT检查示2眼黄斑区局灶性残留视网膜下液;术后6 个月,黄斑区局灶性视网膜下液均完全吸收。随访期间视网膜在位,巩膜嵴清晰,未见视网膜脱离复发。术前视网膜脱离B超见图2,术后视网膜复位B超见图3。
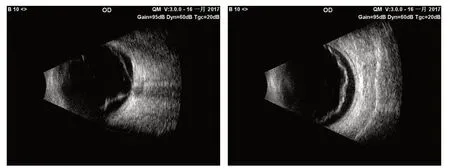
图2.合并白内障的孔源性视网膜脱离眼手术前B超A:轴位扫描,晶状体后囊回声和视神经暗区位于声像图中央;B:横向扫描,声束避开晶状体,初始回声后即为玻璃体无回声区Figure 2.Preoperative B-ultrasound in rhegmatogeous retinal detachment eyes with cataract.A:Axial scan,Echo of the posterior capsule of the crystalline lens and area opaca of the optic nerve located in the center of the sonogram.B:Transverse scan,Ultrasonic acoustic beam avoids the crystalline lens,the anechoic region of the vitreous followed by the initial anechoic region.

图3.合并白内障的孔源性视网膜脱离患者外加压联合白内障摘除和IOL植入术后B超A:轴位扫描,视网膜脱离光带已消失;B:横向扫描,见加压嵴Figure 3.B-ultrasonography of rhegmatogenous retinal detachment with cataract after phacoemulsification and IOL implantation combined with scleral buckling.A:Axial scan,the retinal detachment strip has disappeared.B:Transverse scan,the scleral compression ridge is obvious.
2.3 IOL位置及术后屈光状态
术后IOL均植入于晶状体囊袋内,无IOL脱位、夹持等位置异常。术前按照术眼测定的IOL屈光度及对侧眼的屈光状态,术眼设定的术后屈光度为-3.0~0(-0.88±1.49)D。术后6个月,术眼的实测屈光度为-8.0~-0.5(-1.67±1.43)D。与目标屈光度的差值为-8.0~0(-1.73±1.46)D。预设术后屈光度与术后实测屈光度差异无统计学意义(Z=1.519,P=0.13)。
2.4 术后并发症及随访情况
术后Ⅰ~Ⅱ级角膜内皮水肿(Dickey分级)2眼,术眼局部妥布霉素地塞米松滴眼液及妥布霉素地塞米松眼膏应用后逐渐消退;一过性高眼压2 眼,局部盐酸卡替洛尔滴眼液滴眼后降至正常,停药后未出现再次升高;轻中度纤维蛋白渗出2 眼,术眼局部妥布霉素地塞米松滴眼液及眼膏应用,阿托品眼用凝胶及复方托比卡胺滴眼液滴眼后逐渐吸收,未出现瞳孔持续后粘连或虹膜前粘连;不同程度后囊膜混浊4眼,随访期间2眼混浊明显者行YAG激光截开混浊后囊膜中央,未见眼压升高,未见持续性葡萄膜炎,随访期间视网膜平伏;2 眼后囊膜混浊程度较轻者,随访期间未进行处理;黄斑前膜1眼,患者自觉视物变形及扭曲不明显,OCT显示前膜纤细且位于中心凹旁,黄斑中心凹形态尚存,未进一步处理。未发现视网膜下液引流和玻璃体注气相关并发症。
3 讨论
白内障超声乳化吸除、IOL植入术和巩膜扣带手术的联合术与不做白内障处理的单纯巩膜外加压相比,视网膜复位率无明显差异;与联合白内障超声乳化摘除的玻璃体切割手术相比,其并不影响RRD视网膜的最终复位率及视力预后[3]。对合并明显白内障的RRD的患眼行白内障超声乳化吸除、IOL植入术及巩膜外加压术可将多次手术合并为1 次手术,以减少患者的不适和降低成本,缩短术后恢复时间[5,6]。白内障超声乳化吸除术既可以治疗白内障,更为后继的视网膜手术恢复了透明的屈光介质,也有利于术中及术后检查眼底情况。术前充分复方托吡卡胺滴眼液滴眼放大瞳孔,白内障超声乳化灌注液中加入盐酸肾上腺注射(1 ml∶1 mg,上海禾丰制药有限公司)0.5 ml,术中减少对虹膜的刺激等以防瞳孔缩小,进行后囊膜抛光以尽可能去除残余的细小皮质,这些措施的合理优化均有利于保持眼后段手术野的清晰度。晶状体后囊破裂与巩膜扣带术的视网膜复位成功率呈负相关[7],因此术中应避免晶状体后囊破裂。如果术中后囊破裂,可造成玻璃体丧失、瞳孔变形和低眼压,随后的巩膜扣带术和周边部视网膜的检查也将会受到影响,术中为查找裂孔、巩膜外顶压眼球和巩膜外冷凝裂孔会引起玻璃体前移,不利于IOL的植入,也不能玻璃体注射消毒空气,因此往往不得不改行玻璃体切割术。本研究的17 眼术中均保持晶状体后囊完整,为后继的巩膜外加压术提供了前提条件。
治疗视网膜脱离主要有巩膜手术和玻璃体视网膜手术2种主要方式。与玻璃体视网膜手术相比,巩膜手术的创伤小,对眼内组织结构的影响小,并发症相对较少,术后恢复快。蔡瑞珍和陈慷[8]采用多焦视网膜电图和OCT检查对视网膜脱离经巩膜外加压复位术后黄斑超微结构进行检查,认为视网膜脱离术后黄斑的功能是影响视功能恢复的重要因素。RRD的手术基本原则是确切封闭所有视网膜裂孔。既往巩膜外加压术中通常以直接或间接检眼镜定位裂孔[2,9],直接检眼镜放大倍率大,可视范围小,不利于临床操作;间接检眼镜检查时图像为倒像,放大倍率小,熟练掌握和得心应手的应用需要长时间的训练和积累经验,学习周期较长;直接和间接检眼镜在一定程度上均无法实现检查设备的完全灭菌,手术医师在使用检眼镜的过程中存在不慎污染无菌环境的风险。随着显微操作技术发展,手术显微镜在眼科已是最基本的设备,显微镜下可以任意调整放大倍数,容易发现眼底大小不一、形态各异的视网膜裂孔,冷凝时可以清楚观察到冷凝的层次从脉络膜到视网膜色素上皮,然后到视网膜神经上皮层的逐步变化过程,精确掌握视网膜的冷凝范围和冷凝程度,避免过度冷凝或冷凝不足[10];也省略了反复取和戴检眼镜的过程,降低了手术野在无意中不慎被污染的风险。本研究17 只患眼的手术全程在手术显微镜下完成。显微手术操作精细,定位视网膜裂孔清晰而准确,有利于准确控制冷凝反应的程度,也能更好地遵守无菌操作原则。但显微镜直视下查找定位视网膜裂孔需要巩膜外顶推视网膜至瞳孔区,因此首先需要减少眼内容以利于巩膜外顶推。白内障超声乳化吸除术可减少一定的眼内容物;而穿刺引流视网膜下积液有助于进一步降低眼内压,有利于接下来在巩膜外顶压下进行巩膜外冷凝裂孔等操作;术中还可向裂孔方向偏转眼球利于在显微镜下通过瞳孔观察视网膜。当视网膜下液较少而引流后仍不能完成巩膜外有效顶推时,可通过白内障手术的3∶00 点位透明角膜侧切口放出部分前房液体进一步减少眼内容物。1997 年,Girard采取的是经角膜缘后2 mm的巩膜隧道切口进行超声乳化摘除白内障[2],近些年经透明角膜隧道切口进行白内障超声乳化摘除已普遍使用,在白内障超声乳化手术联合巩膜外加压病例中,通过对透明角膜进行10-0线临时缝合可以有效避免巩膜顶压造成前房变浅或者消失。我们通过对透明角膜隧道切口进行水密,随后进行巩膜外顶推寻找视网膜裂孔,完成巩膜外顶压冷凝,加压块固定等操作,同样可以起到相应的效果,主要在于做好透明角膜隧道切口,同时在白内障超声乳化结束后通过水化角膜进一步加强角膜切口的密闭性。
本研究中17 眼的视网膜裂孔通过上述方法均能在手术显微镜下清晰可见。引流视网膜下液可使裂孔定位、巩膜外加压更准确;促使脱离的视网膜神经上皮层与色素上皮层更好贴合,为裂孔的粘连封闭创造条件;使巩膜外冷凝更为准确和高效;有利于判断加压嵴的高度;也为玻璃体腔注气提供了空间[11]。因此,巩膜扣带术中引流视网膜下液能提高视网膜解剖复位成功率[7]。玻璃体腔注气一方面可恢复眼内压,另一方面可避免裂孔鱼嘴样张开。最近的研究显示玻璃体切割术后玻璃体腔部分和完全填充消毒空气能有效治疗上方视网膜裂孔导致的RRD[12]。因此,本组玻璃体注气后的患者通过适当的头位或体位使裂孔处于高位,有利于空气填充玻璃体腔顶压视网膜裂孔而促进视网膜下液吸收和视网膜裂孔的粘连封闭。本研究17 眼的视网膜裂孔均准确位于加压嵴,粘连封闭良好,术后视网膜均解剖复位,88%(15/17)患眼的术后视力得到提高。但术中不必强调完全引流视网膜下液,因为如果术前视网膜脱离已经累及到黄斑区,巩膜外加压手术结束时即使视网膜下有部分液体存在,只要术后视网膜裂孔封闭,视网膜下积液会自行吸收,并不影响RRD患眼视网膜的复位率及BCVA的改善[13]。
Scharwey等[14]建议IOL应在视网膜手术完成后植入,以避免IOL边缘的棱镜效应引起眼后段尤其是周边视网膜的手术视野不清晰。段欣荣和朱晓青[15]认为巩膜扣带手术操作中对眼球的顶压可能造成IOL移位,以及IOL边缘和IOL袢与晶状体囊膜的折射率差异大,在IOL边缘和IOL袢与晶状体囊膜的交界处可能对术中眼底检查造成一定干扰,建议先行超声乳化摘除白内障,然后行巩膜扣带术,再进行IOL植入。Mitry等[3]认为视网膜复位率、视力预后、并发症等主要取决于眼后段病情严重情况,和联合手术的步骤无相关性。我们基于此也选择了在完成巩膜外加压后再植入IOL。当视网膜脱离累及黄斑时,需仔细测量眼轴长度,眼轴的长度应测量至视网膜色素上皮层。本研究中视网膜脱离累及黄斑的1 眼,A超测量眼轴时只将眼轴长度测量至脱离的视网膜前表面而未至视网膜色素上皮层,造成了-8 D的屈光度误差,其余16 眼的术后屈光度与设定屈光度基本一致。该病例也警示我们在测量眼轴时需同时结合患者既往双眼屈光史,注意与对侧眼比较,如测量值与对侧眼差异明显。而患者既往双眼无明显屈光参差病史或不清楚既往屈光情况。I期植入IOL需结合病史及眼底检查慎重考虑,对于这些患者在视网膜复位后再择期通过A超或IOLMaster测量眼轴长度进而考虑II期植入IOL可能更为稳妥。
综上,对于一些合并有白内障的RRD患者,术中先通过超声乳化摘除混浊的白内障,随后在显微镜直视下进行巩膜外加压手术复位视网膜,然后再将IOL植入囊袋内,这种超声乳化摘除白内障联合显微镜下巩膜外加压手术+人工晶状体植入在合并白内障的部分孔源性视网膜脱离患者中能够通过1次手术在复位视网膜的同时解除晶状体混浊导致的视力下降。可以使一些患者避免玻璃体切割手术,术中操作及对眼后段的干扰较小,术后恢复较快,但该手术也存在人工晶状体度数测算误差、外加压后屈光度变化等不足。因本组病例数较少,未能与II期植入人工晶状体进行比较,在今后的研究中,我们可以通过IOLMaster和A超二者对照进行眼轴的精确测量,对II期植入IOL的患者与I期植入IOL的病例进行术后屈光度的比较,进一步加深研究。
利益冲突申明本研究无任何利益冲突
作者贡献声明李健:收集数据;参与选题、设计及资料的分析和解释;撰写论文;统计分析;根据编辑部的修改意见进行修改。陈海英:参与选题、设计和修改论文的结果、结论。黄正如:参与选题、设计、资料的分析和解释;手术操作;修改论文中关键性结果、结论;对文章的知识性内容作审阅;根据编辑部的修改意见进行核修

