口服维生素D3治疗飞秒激光辅助LASIK术后干眼
林颖 苏焕钧 张霞 袁牧之
作者单位:广西省柳州市工人医院眼视光科 545005
飞秒激光辅助准分子激光原位角膜磨镶术(Femtosecond laser in situ keratomileusis,FSLASIK)因其可预测性和稳定性高而成为当前角膜屈光手术的主流[1,2]。FS-LASIK虽然有许多优点,如视力恢复快,角膜上皮下混浊少,但术后干眼症状以及泪液不稳定时有发生,在术后1个月的发生率约40%,术后6个月约20%~40%[3,4]。虽然准分子激光原位角膜磨镶术(LASIK)后干眼症是暂时性的,但患者仍抱怨视物模糊、夜间视力下降、眩光、光晕等不适[5]。泪膜不稳定,泪液分泌的降低等对视功能的影响比较大。传统的治疗方法有使用人工泪液润滑眼表或者泪点栓塞,但有时人工泪液并不能有效地缓解患者的症状。有研究显示人工泪液和皮质类固醇对LASIK术后干眼症有效[6]。然而,长期的皮质类固醇和激素治疗可能存在潜在的不良反应,例如高眼压症和并发性白内障。
维生素D3(Vitamin D3)是指一组脂溶性分泌激素,它能促进肠道对钙、铁、镁等的吸收,严格来说它不是一种维生素,它在免疫调节、增值、分化、凋亡以及血管生成方面都可以发挥重要作用。维生素D3缺乏可能引起多种眼部病变,如黄斑变性、糖尿病视网膜病变、葡萄膜炎等。Adorini和Penna[7],Marctorchino等[8]的研究表明,维生素D3水平的升高能减少炎症介质的产生,改善了抗氧化功能[9]。最近的1项研究发现,维生素D3可以预防干眼症[10],而且也有研究显示血清维生素D3水平高的患者较少出现干眼症状[11]。眼干燥综合征的患者中通常伴有血清维生素D3水平的降低[12]。本研究旨在探讨口服维生素D3是否能改善FS-LASIK术后干眼症,提高患者的视觉质量。
1 对象与方法
1.1 对象
选择2019 年1 ─12 月在柳州市工人医院接受FS-LASIK且术后1 个月有明显干眼以及血清维生素D3水平低于正常的患者90例(90眼)。所有患者随机分为研究组45例(45眼)和对照组45例(45眼)。由于双眼重复性的原因,本研究只纳入了右眼的数据。本研究经柳州市工人医院伦理委员会批准,批号:K2019072。所有患者知情同意并签署手术知情同意书。临床注册号:ChiCTR1900026944。
纳入标准:①自愿接受屈光手术的近视患者;②年龄20~35岁;③术前无干眼病史,参考《干眼临床诊疗专家共识》[13];④屈光度稳定至少2年(变化≤±0.5 D);⑤无硬性或软性角膜接触镜配戴史。排除标准:①眼睑闭合不全、结膜炎等对泪膜产生影响的疾病;②泪腺疾病及手术史;③眼睑结构或功能异常;④白内障、青光眼、圆锥角膜、葡萄膜炎、视网膜脱离、视神经炎等眼部疾病;⑤患有糖尿病、高血压等全身系统性疾病;⑥有使用影响角膜代谢的药物治疗者。
1.2 手术及术后干预
所有患者均行FS-LASIK,德国Wavelight FS200 飞秒激光系统制作角膜瓣,角膜瓣厚度为120 µm,角膜瓣直径为8.5 mm。Wavelight EX500准分子激光器切削,切削直径均为6.5 mm。所有手术均由同一位经验丰富的医师完成。
术后第1 天常规给予左氧氟沙星滴眼液(日本参天公司),4次/天,使用2周;0.1%氟米龙滴眼液(日本参天公司)抗炎,4次/天,每周递减至1次,持续使用4 周;0.3%玻璃酸钠滴眼液(日本参天公司),补充人工泪液,4次/天,持续使用3个月。
术后研究组口服补充维生素D3软胶囊,每粒胶囊含2000 IU维生素D3(美国Confidence Inc.公司),1 次/天,每次1 粒,随早餐服用,持续服用12 周;对照组不服用任何制剂。
1.3 临床检查
患者在FS-LASIK术后服药前和服药后1、3和6个月时进行视力、干眼各项指标、对比敏感度等检查,所有检查均由同一医师完成。患者在每次眼部检查前均填写眼表疾病指数(Ocular surface disease index,OSDI)问卷,共12个问题,用于评估干眼症症状。
1.4 干眼各指标的测量
采用非侵入式眼表综合分析仪(Keratograph 5M,德国Oculus公司)测量泪河高度、非接触性泪膜破裂时间(Tear break up time,TBUT)以及Schirmer Ⅰ试验(Schirmer's test Ⅰ,SⅠT)。泪液检测试纸购于天津晶明新技术开发有限公司。泪河高度测量:被检者按照要求放置头位,平视正前方中央圆点,检测仪调试至泪河高度(Tear meniscus height,TMH)测量模式,嘱患者瞬目后采集图像。TBUT测量:嘱患者瞬目2 次,至Placido环在角膜上投射的圆环破裂时,记录首次TBUT、平均TBUT。SⅠT:将泪液检测试纸置于患者下睑中外侧1/3结膜囊内,5 min后读取滤纸湿润的长度。
1.5 维生素D3的测量
体内维生素D3的含量通过血清25-羟基维生素D3[25(OH)D3]分级进行评估。分别于用药前及用药后1、3 和6 个月采集患者空腹血清标本,分析血清25(OH)D3水平。对血清样品进行预处理并储存在-80°C的环境中直至下一步研究。使用放射免疫分析试剂盒(Shimadzu API 3200,AppliedBiosystem,Waltham,MA,USA)测定血清25(OH)D3水平。血清25(OH)D3水平<20 ng/mL被诊断为维生素D3缺乏。
1.6 统计学方法
前瞻性临床研究。采用SPSS 22.0统计学软件进行数据分析。使用Kolmogorov-Smirnov评估数据的正态性,符合正态分布的数据以均数±标准差表示,选用重复测量的方差分析进行数据分析。不符合正态性的数据选用Mann-WhitneyU非参数检验。组间比较采用独立样本t检验,组内不同时间点的比较采用重复测量方差分析。维生素D3水平与各观察指标的相关性使用相关分析。以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
入组的90例患者随机分为2组:研究组45例(45眼),对照组45例(45眼)。研究组患者的年龄22~35(27.4±4.4)岁,对照组23~36(26.9±5.1)岁。用药前球镜度、散光度以及最佳矫正视力(BCVA)情况见表1。研究组和对照组患者血清维生素D3情况分别为(23.80±3.26)ng/ml和(23.76±3.11)ng/ml,差异无统计学意义(t=1.50,P=0.331)。
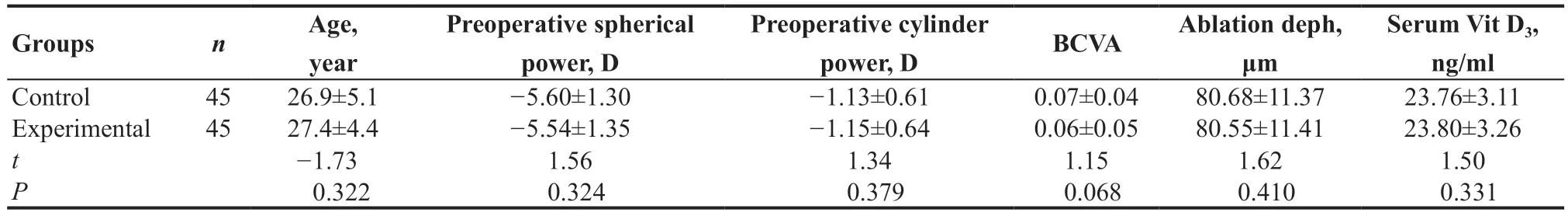
表1.用药前研究组和对照组患者的基本情况Table 1.Premedication general data between experimental group and control group
2.2 视力
服药后1个月,研究组LogMAR裸眼视力(UCVA)为-0.11±0.15,对照组为0.01±0.14,差异有统计学意义(t=3.14,P=0.030)。服药后3个月,研究组UCVA为-0.12±0.13,优于对照组的-0.03±0.11,差异有统计学意义(t=2.36,P=0.042)。服药后6个月,研究组UCVA优于对照组,且差异有统计学意义[(-0.12±0.09)vs.(-0.05±0.15),t=2.01,P=0.045]。
2.3 眼表疾病指数
2 组服药前眼表疾病指数(Ocular surface disease index,OSDI)评分差异无统计学意义(t=1.21,P=0.054);服药后1 个月,研究组OSDI评分低于对照组,差异有统计学意义(t=4.32,P=0.007);服药后6个月,研究组OSDI评分明显低于服药前(t=6.32,P=0.003),对照组略低于服药前,但差异无统计学意义(t=0.89,P=0.36),见表2。研究组患者在服药后1、3、6个月无眼部刺痛。对照组患者中有5眼出现眼部刺痛。
2.4 TBUT
服药1个月时,研究组TBUT明显高于对照组,差异有统计学意义(t=3.02,P=0.027);服药后3个月及6 个月,研究组的TBUT接近正常水平,与对照组比较差异均有统计学意义(t=2.32,P=0.031;t=2.30,P=0.039),见表2。对照组在6个月的随访期间没有恢复到正常水平,见图1。
2.5 SⅠT
服药后1 个月,研究组的SⅠT值高于对照组(t=2.78,P=0.030);服药后3个月,研究组的SIT值增加明显,并高于对照组(t=3.25,P=0.026),到6 个月时,2 组差距变小,但差异仍有统计学意义(t=3.03,P=0.028)。见表2和图2。
2.6 TMH
服药后1个月时,研究组TMH较服药前明显提高(t=2.37,P=0.038);研究组服药后3个月与对照组相比差异有统计学意(t=2.61,P=0.030),见表2。
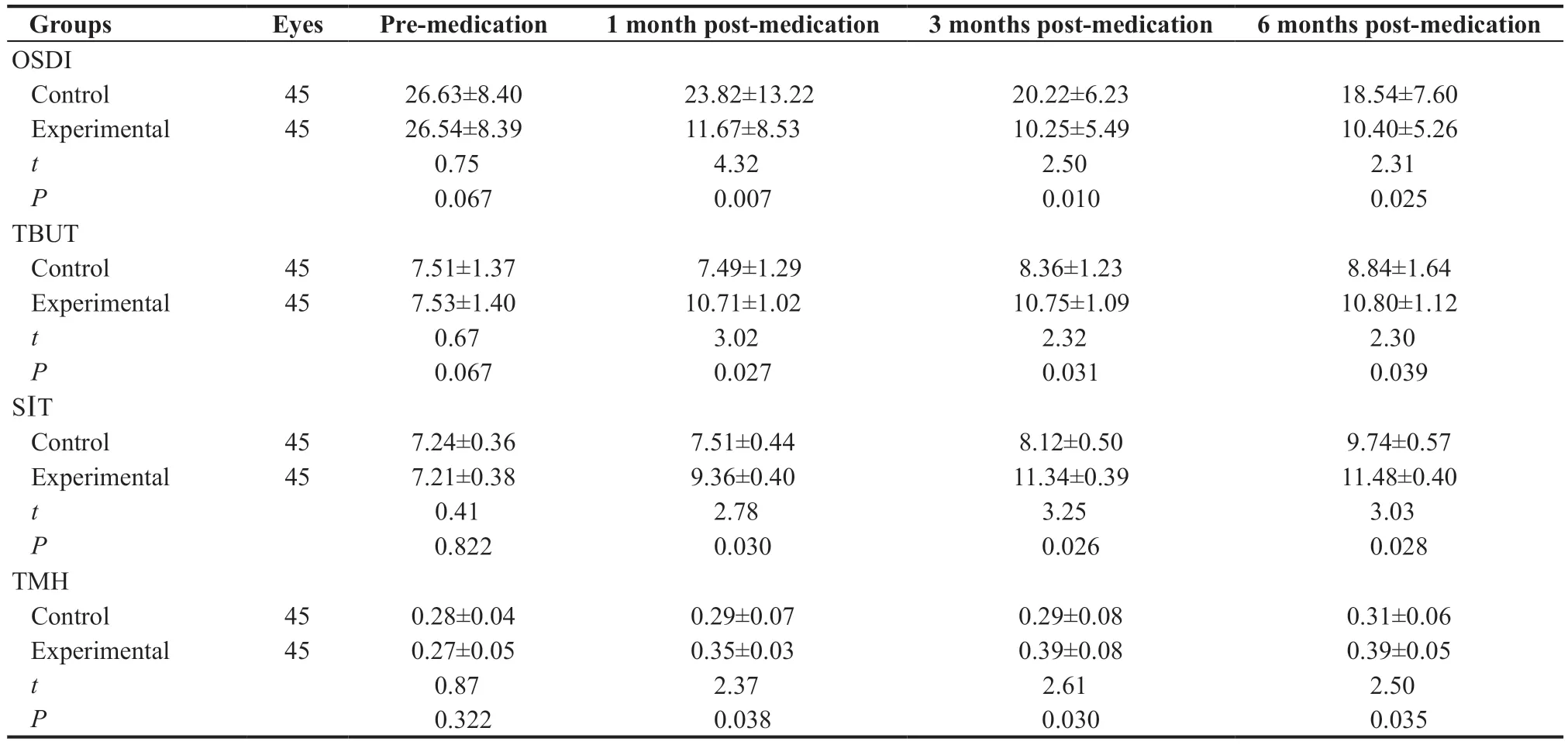
表2.对照组和研究组患者泪液相关指数Table 2.Tear related index between control group and experimental group
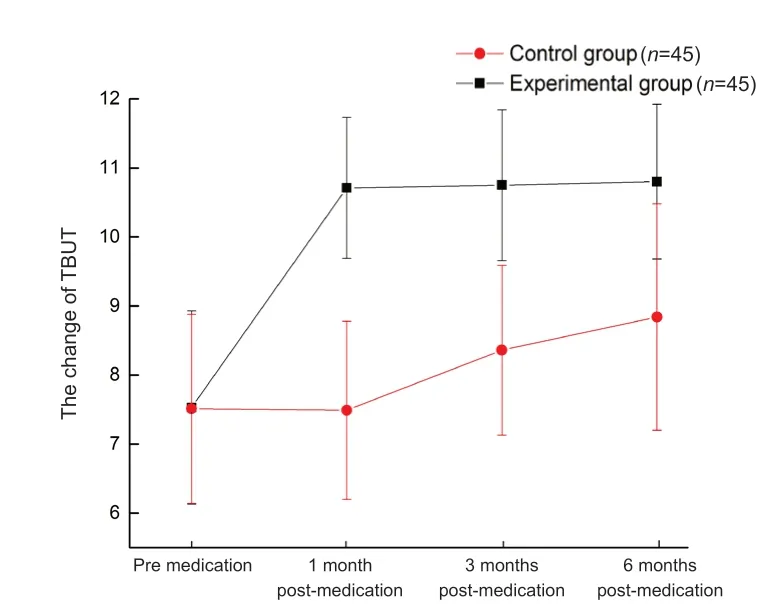
图1.对照组和研究组术后TBUT的变化情况Figure 1.Tear break up time changes between the two groups.
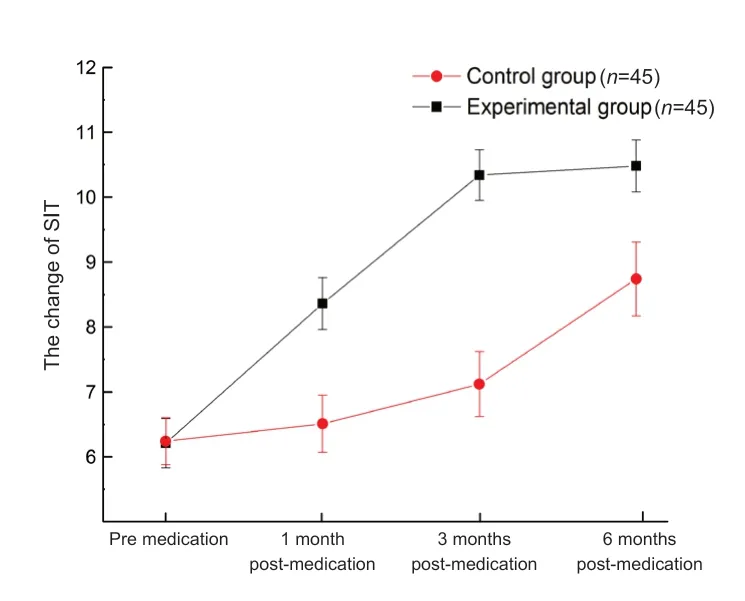
图2.对照组和研究组患者SIT的变化情况Figure 2.Schirmer's test I changes between the two groups.
2.7 研究组血清维生素D3情况
研究组术前血清25(OH)D3为(12.80±5.24)ng/ml(9.57~18.89 ng/ml),用药后1 个月和3 个月升高到(46.83±8.52)ng/ml(38.41~58.12 ng/ml)和(56.51±10.36)ng/ml(44.78~69.14 ng/ml)。研究组患者血清维生素D3水平与OSDI评分呈负相关(r=-0.90,P<0.001),与SⅠT值(r=0.88,P<0.001)、TBUT(r=0.89,P<0.001)和TMH(r=0.80,P<0.001)呈正相关,见图3。

图3.血清维生素D3水平和泪液相关指数的相关性Figure 3.Correlation between serum vitamin D3 level and tear related index.
2.8 明暗视对比敏感度
服药前的研究组和对照组患者双眼对比敏感度在各空间频率均低于术前水平(3 cpd:t=4.15,P=0.02;6 cpd:t=2.58,P=0.04;12 cpd:t=3.72,P=0.02;18 cpd:t=4.25,P=0.03)。服药后研究组患者的对比敏感度缓慢恢复至正常水平。服药后第3个月,研究组患者的明视对比敏感度和暗视对比敏感度均较对照组明显改善(3 cpd:t=3.10,P=0.03;6 cpd:t=2.84,P=0.03;12 cpd:t=2.63,P=0.04;18 cpd:t=2.96,P=0.03)。至服药后第6 个月,研究组与对照组明暗对比敏感度的差异减小(3 cpd:t=2.40,P=0.04;6 cpd:t=2.16,P=0.04;12 cpd:t=2.23,P=0.04;18 cpd:t=2.37,P=0.04),见表3。
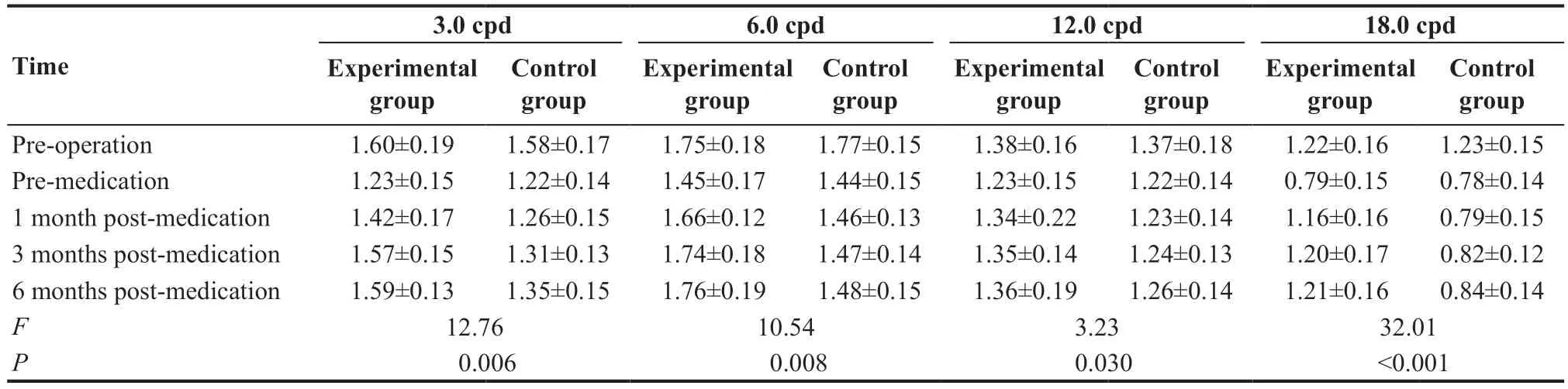
表3. 服药前与服药后1、3、6个月对比敏感度变化Table 3.Changes of contrast sensitivity before and 1,3,6 months after medication
3 讨论
角膜屈光术后患者会出现暂时性的干眼症。干眼症患者通常会出现沙砾、疼痛、眼睛疲劳、发红或灼烧等症状。研究表明角膜屈光手术后干眼症的发生与术前眼表状况、手术方式、术中角膜神经的损伤等因素密切相关。LASIK术后干眼症会影响功能性视力[14]。既往的研究显示LASIK术后会出现TBUT减少,SⅠT值明显降低,而且TBUT和SⅠT值的减少会持续到手术后几个月[15]。
本研究中患者在LASIK术后1个月有明显干眼症,2组患者TBUT和SⅠT值均较术前减少,同时我们还发现血清维生素D3水平均低于正常,这些患者术后干眼的症状较其他患者严重。通过给患者口服维生素D3,观察患者服药后眼部的变化,我们发现在服药后1个月时,研究组的TBUT、SⅠT值和TMH均明显高于对照组,与以往的研究结果[3,4]一致。角膜瓣制作的过程切断了角膜上皮下神经丛,导致反射性泪液分泌显著减少[16]。角膜上皮下神经丛的切断会损害角膜知觉,并破坏自主神经和泪腺之间的相互作用[17,18]。本研究中研究组在LASIK术后UCVA、明视对比敏感度和暗视对比敏感度均有明显改善,而对照组无明显变化。这表明,口服维生素D3对于治疗LASIK术后干眼的发生可能比仅使用传统滴眼液有效。有研究发现泪液分泌量与血清维生素D3水平相关[19,20]。血清维生素D3水平较低的患者SⅠT值较低。Lu等[21]的研究表明,维生素D3存在于泪液中,维生素D3转运体在泪腺和副腺中表达。本研究也证实服用了维生素D3的患者具有更好的泪膜稳定性。
Yang等[22]证实OSDI和维生素D3之间存在相关性。本研究也发现研究组在补充维生素D3后1 个月OSDI评分明显降低,并且随着血清维生素D3水平的升高而降低。研究组患者血清维生素D3水平与OSDI评分呈负相关,与SⅠT值、TBUT评分以及TMH呈正相关。这表明维生素D3能够改善FS-LASIK术后的干眼症状、泪液质量以及眼表的状况。我们知道LASIK术后神经纤维密度与术前相比仍然较低,有些患者甚至在术后5年仍未恢复至术前水平,这导致干眼症的持续存在[14]。Cruzat等[23]的研究发现角膜免疫细胞可以影响角膜神经的密度。而维生素D3正是通过降低炎症因子水平促进角膜神经再生[24]。因此,维生素D3可以改善LASIK术后干眼的症状,降低OSDI评分。
本研究中对照组的患者术后有疼痛的症状,而研究组患者则没有。我们推测炎症介质可降低眼表的感觉神经阈值,从而导致患者对疼痛的阈值降低[25]。研究表明维生素D3可调节包括角膜上皮细胞在内的各种细胞中各种炎性细胞因子的表达[26]。因此,Wei和Christakos[24]指出维生素D3在免疫系统中起着重要的免疫调节作用。有研究显示在患者服用维生素D3后,IL-17、IL-21、IL-22水平下降明显[27]。而IL-17在炎症性疾病中起着调节病理反应的重要作用。接下来我们将进一步研究维生素D3在FS-LASIK干眼症中的作用机制,并探讨IL-17在FS-LASIK干眼症中的作用及与维生素D3的关系。
综上所述,对于单纯使用人工泪液无效的患者而言,人工泪液联合口服维生素D3的治疗方法可以延长LASIK术后TBUT、增加泪液分泌量及TMH,减轻干眼不适症状,但维生素D3改善LASIK术后干眼症的机制尚不清楚。将来更多的研究将投入确定维生素D3在降低LASIK术后干眼症发生率和严重程度方面的作用及其相关机制。维生素D3可以改善LASIK术后干眼症状、泪液质量及眼表状况,且提升FS-LASIK术后的视觉质量。
利益冲突申明本研究无任何利益冲突
作者贡献声明林颖:课题设计,收集数据,资料分析及解释,撰写论文,根据编辑部的修改意见进行修改。苏焕钧:参与收集数据,修改论文并参与编辑部修改意见的修改。张霞、袁牧之:参与收集数据,参与修改论文中关键性结果、结论

