γ射线体部立体定向放射治疗不可手术的晚期胰腺癌的临床观察
赵 娜 齐高强 张晶芳
胰腺癌因早期症状并不明显,80%以上的患者在确诊时已进展至晚期,且该类患者因远处转移、局部进展、浸润等原因失去手术治疗机会,多需选择其他方式治疗,如放化疗[1]。全身治疗或放射治疗是无法手术的晚期胰腺癌患者的主要治疗手段,其中直线加速器X射线常规三维适形放射治疗(3 dimensional conformal radiationtherapy,3D-CRT)为晚期胰腺癌的常规放疗方法,因周围正常组织耐受剂量限制,难以对靶区采用根治剂量,疗效有待提升[2-3]。而新型的γ射线体部立体定向放射治疗利用旋转聚焦照射原理,可有效提升胰腺原发肿瘤灶的总剂量[4]。但γ射线体部立体定向放射治疗在晚期胰腺癌中的应用效果是否较常规放疗好尚存争议,且重点比较二者治疗晚期胰腺癌疗效的相关研究较少。为找到晚期胰腺癌患者更为理想的放疗方法,本研究将观察不可手术的晚期胰腺癌患者采用γ射线体部立体定向放射治疗的效果,并与3D-CRT对比,现将结果报告如下。
1 资料与方法
1.1 一般资料
选取2017年1月至2020年6月医院接受直线加速器X射线常规三维适形放射治疗(3D-CRT)的45例患者纳入对照组,并将同期接受γ射线体部立体定向放射治疗的45例患者纳入观察组。纳入标准:①经细胞学检查或穿刺病理学确诊;②预计生存期>6个月;③癌肿直径在2.5~7.0 cm;④TNM分期[5]为Ⅲ~Ⅳ期;⑤资料完整。排除标准:①手术后局部复发;②既往有放化疗史;③有手术指征。对照组男性25例,女性20例;年龄42~78岁,平均年龄(64.42±3.19)岁;胰头癌27例,胰体、尾癌18例。观察组男性26例,女性19例;年龄43~77岁,平均年龄(64.41±3.54)岁;胰头癌26例,胰体、尾癌19例。2组一般资料比较(P>0.05),有可对比性。
1.2 方法
观察组采用γ射线体部立体定向放射治疗,对照组采用3D-CRT。2组均治疗5周后观察治疗效果。所有患者定位时均口服3%泛影葡胺300 ml,静脉推注优维显。患者仰卧于真空成形袋,固定于立体定位体部框架内,让患者平静呼吸,增强CT扫描,层距和层厚为5 mm,将扫描图像上传至治疗计划系统,勾画靶区,其中CT所示肿瘤范围为肿瘤靶区(gross tumor volume,GTV)。
1.2.1 3D-CRT治疗方法 采用直线加速器及三维适形治疗系统,胰腺周围上至肝门下至十二指肠水平腹部主动脉周围淋巴引流区为临床靶区(clinical target volume,CTV)。照射范围:CTV+10 mm为PTV,每次1.8~2 Gy,每天1次,每周5次,3D-CRT计划总剂量为46~54 Gy。
1.2.2 γ射线体部立体定向放射治疗方法 采用立体定向伽玛射线全身治疗系统,照射范围:GTV+5 mm为PTV,选取50%等剂量曲线为参考剂量,每次3~5 Gy,每天1次,每周5次,计划总剂量为40~45 Gy。
1.3 评价指标
(1)临床疗效:参照《胰腺癌诊疗规范(2011年版)》[6]中相关标准,其中完全缓解(complete remission,CR):靶病灶消失,未出现新病灶;部分缓解(partial remission,PR):靶病灶最大直径之和减少>30%;疾病稳定(stable disease,SD):靶病灶最大直径之和增大未达PD,或缩小未达PR;疾病进展(disease progression,PD):靶病灶直径之和>20%,或出现新病灶。临床有效=(CR+PR+SD)/总例数×100%。(2)疼痛程度:于治疗前(T0)、治疗1周(T1)、治疗3周(T2)、治疗5周(T3)时采用数字疼痛分级法(numeric rating scale,NRS)[7]评分评估,其中0分为无痛,10分为剧烈疼痛。(3)肿瘤标志物:于T0、T1、T2、T3,抽取患者清晨空腹静脉血3 mL,3000 r/min离心10 min后,取上层血清,采用瑞士罗氏公司生产的CoBAS 6000型全自动电学发光仪测定糖类抗原19-9(carbohydrate antigen 19-9,CA19-9)水平。(4)毒副作用:统计治疗期间骨髓抑制、急性肝损伤、急性胃肠炎发生情况。治疗后随访1年,比较2组生存率。
1.4 统计学方法

2 结果
2.1 2组临床疗效比较
观察组整体治疗效果优于对照组,且临床有效率高于对照组(P<0.05)。见表1。

表1 2组疗效比较(例,%)
2.2 2组疼痛程度比较
T0时2组NRS评分比较,差异无统计学意义(P>0.05);2组T1、T2、T3时NRS评分较T0时降低,且观察组低于对照组(P<0.05)。见表2。
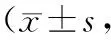
表2 2组NRS评分比较分)
2.3 2组肿瘤标志物比较
T0时2组CA19-9水平比较,差异无统计学意义(P>0.05);2组T1、T2、T3时CA19-9水平均较T0时降低,且观察组低于对照组(P<0.05)。见表3。

表3 2组CA19-9水平比较
2.4 2组不良反应、生存情况比较
观察组治疗期间不良反应发生率较对照组低,治疗1年生存率高于对照组(P<0.05)。见表4。
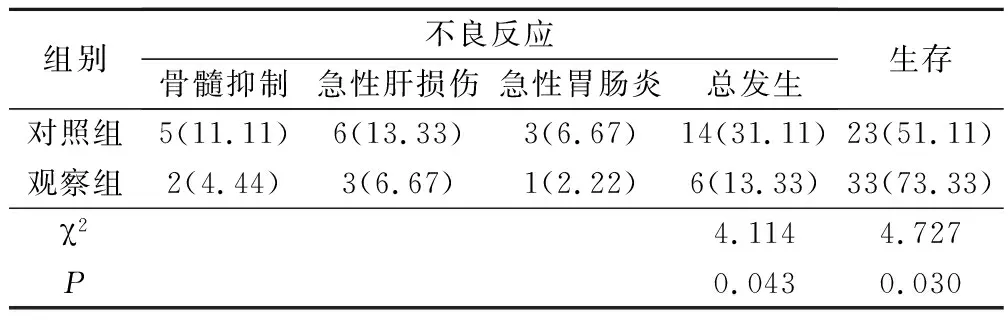
表4 2组不良反应、生存情况比较(例,%)
3 讨论
晚期胰腺癌患者因失去手术治疗机会,预后差,且临床尚未建立标准治疗方案,多认为放化疗结合是合理的治疗措施[8]。但胰腺癌对放疗并不敏感,且其解剖位置与肝脏、肾脏、十二指肠、脊髓等毗邻,因周围正常组织耐受剂量限制,采用常规的3D-CRT技术难以高剂量行放射治疗,因此疗效也并不理想[9-10]。
γ射线体部立体定向放射通过旋转锥面聚焦方式,将30个钴-60放射源经准直器引导向一点聚焦,使焦点处受持续高剂量照射,焦点外瞬时低剂量照射,肿瘤可短期内受大剂量照射,继而导致肿瘤细胞坏死,瘤体缩小,达到治疗目的[11]。且有研究报道采用γ射线体部立体定向放射在恶性肿瘤治疗中获得满意效果[12],推测γ射线体部立体定向放射可使晚期胰腺癌患者获益。作为腺癌细胞产生的一种糖类抗原,CA19-9是目前胰腺癌诊断的最佳标志物,其下降程度可对胰腺癌的治疗效果进行评估,并可预测患者治疗后的转移、生存情况[13]。因此,检测CA19-9水平对胰腺癌患者的治疗效果评估有重要价值。本研究结果显示,观察组治疗5周的整体治疗效果优于对照组,且临床有效率高于对照组,治疗期间各时点CA19-9水平低于对照组,说明晚期胰腺癌患者采用γ射线体部立体定向放射治疗效果好,更利于调节CA19-9水平。分析原因,γ射线体部立体定向放射治疗可在短期内对癌组织进行大剂量照射,使照射区域的癌组织缩小,继而促进患者CA19-9水平降低,提升临床治疗效果[14-15]。
胰腺肿瘤在腹腔内所处位置较狭小,胰腺癌患者往往因局部肿瘤增大压迫,引起癌痛及腹部疼痛[16]。且有关研究表明,胰腺癌患者经放射治疗后可有效缓解癌痛程度[17]。因此,分析评估晚期胰腺癌患者癌痛程度,是评估治疗效果的重要途径。本研究结果显示,观察组治疗各时点的NRS评分均较对照组低,说明γ射线体部立体定向放射治疗可有效缓解晚期胰腺癌患者的癌痛程度。分析原因,γ射线体部立体定向放射治疗因分次高剂量短疗程放疗,故安全、无创,并可快速缓解患者的疼痛程度[18]。此外,本研究还对2组安全性及短期生存率进行比较,结果显示,观察组不良反应总发生率比对照组低,生存率高于对照组。说明晚期胰腺癌患者采用γ射线体部立体定向放射治疗可减少不良反应发生,提高患者短期生存率。分析原因,因胰腺毗邻十二指肠、胃、小肠等重要器官组织,采用3D-CRT治疗时,部分胃肠组织不可避免进入照射区,继而引起不良反应;而γ射线体部立体定向放射可提高PTV的准确性及高剂量分布,同时降低PTV周围正常组织的照射剂量,在患者治疗的同时,有效避免受照范围过大,胰腺周围正常组织仅受到可耐受的小剂量照射,因而不良反应减少[19]。而观察组短期生存率提高的原因可能为:γ射线体部立体定向放射治疗在放射生物效应方面也有优势,采用短疗程,分次高剂量的方式,可提高有效照射区内的放射生物效应剂量,提升治疗效果,继而提高晚期胰腺癌患者的生存率。
综上所述,晚期胰腺癌患者采用γ射线体部立体定向放射治疗效果较好,可缓解癌痛程度,调节血清肿瘤标志物水平,并可提高患者短期生存率,且不良反应较少,安全性好。

