miR-150-5p调控非小细胞肺癌的A549细胞凋亡的机制研究
董延琥 王艺静
细胞凋亡或程序性细胞死亡通常是由化学治疗药物诱导的,并且在人类癌症的临床治疗中起着至关重要的作用,其受许多凋亡相关基因和信号通路的调控[1]。miR-150-5p已经被证实在非小细胞肺癌中表达异常[2]。基于此,本研究旨在探讨miR-150-5p与非小细胞肺癌细胞A549细胞凋亡之间的联系,以及其调控非小细胞肺癌A549细胞凋亡的分子机制。
1 材料与方法
1.1 材料
Lipofectamine 3000购自广州双螺旋生物科技有限公司(货号:L3000015)。人非小细胞肺癌A549细胞购自深圳市科普生物有限公司(货号:IFO50153)。pmir-glo utr1质粒购自广州基旦生物科技有限公司(货号:JD190929001M)。miR-150-5p inhibitor、miR-150-5p mimics均由上海生工合成。siPDIA6和siTADA1由吉凯基因合成。PDIA6过表达质粒通过HELA细胞的cDNA克隆至pCDNA3.1表达载体上。RPMI-1640培养基购自北京华博德亿生物技术有限公司(货号:SH30809.02B)。胎牛血清购自广州市齐云生物技术有限公司(货号:HQ30071)。PDIA6 antibody购自北京泰泽嘉业科技发展有限公司(货号:GTX11432)。GAPDH antibody购自北京华夏远洋科技有限公司(货号:R1210-1-200ul)。RNA小量提取试剂盒购自北京欣华绿源科技有限公司(货号:R6834-00)。逆转录试剂盒购自昆明皇宝商贸有限公司(货号:218161)。2×SDS 蛋白电泳上样缓冲液购自武汉洁洋盛科技有限公司(货号:M337-5ML)。双荧光素酶报告基因试剂盒购自武汉纯度生物科技有限公司(货号:CDLG-4997)。黄芩苷购自上海麦克林生化科技有限公司(货号:B802696-1g)。荧光定量PCR试剂盒购自上海兢蔚生物科技有限公司(货号:BL705A)。
1.2 方法
1.2.1 细胞培养和转染 非小细胞肺癌A549细胞生长于RPMI-1640培养基中,并在37 °C,5%CO2的湿润培养箱中培养。所有培养基均添加10%胎牛血清、100 μg/ml链霉素和100 μU/ml青霉素。将转染试剂与miR-150-5p inhibitor、miR-150-5p mimics、PDIA6质粒、siPDIA6和siTADA1混合并在室温下孵育15 min后,缓缓滴入非小细胞肺癌A549细胞中。
1.2.2 RNA抽取和实时荧光定量PCR 根据说明书,使用RNA小量提取试剂盒提取的RNA。使用逆转录试剂盒逆转录为cDNA。实时定量PCR使用荧光定量PCR试剂盒进行实时荧光定量PCR。
1.2.3 Annexin-V染色 经过不同处理后,收集在6孔板上生长的漂浮非小细胞肺癌A549细胞和胰蛋白酶分离的细胞,并用冷的PBS洗涤。 然后将细胞沉淀物用结合缓冲液重悬,并根据试剂盒方案用Annexin-V染色。荧光显微镜观察。将实验组中凋亡细胞的百分比与对照转染组进行比较。所有样品一式三份测量。
1.2.4 荧光素酶报告实验 将A549细胞与PDIA6(800 ng)、对照载体(800 ng)的TK Renilla报告基因(8 ng)根据试剂盒说明,使用Lipofectamine 3000进行转染。转染48 h后,裂解了总细胞蛋白,并使用双重荧光素酶测定系统检测了荧光素酶活性(萤火虫和海肾)。
1.2.5 免疫印迹 使用RIPA缓冲液从非小细胞肺癌A549细胞中提取总细胞蛋白,然后以12 000 rpm离心20 min。 4 °C收集上清液。使用二辛可宁酸(BCA)蛋白质测定试剂盒测量这些蛋白质样品的浓度。在十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE)凝胶中分离蛋白质样品(每个泳道30 μg),然后转移到硝酸纤维素膜上。用5%脱脂牛奶封闭后,将膜与所示第一抗体在4 °C下孵育过夜。第2天,将膜与偶联了辣根过氧化物酶(HRP)的相应抗小鼠或抗兔IgG二抗在室温下孵育1 h。蛋白质条带使用Western Bright ECL试剂盒,然后使用ChemiDocTMXRS+系统进行可视化。
1.3 统计学方法
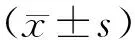
2 结果
2.1 miR-150-5p对非小细胞肺癌A549细胞凋亡的抑制作用
使用miR-150-5p mimics过表达miR-150-5p后,发现非小细胞肺癌A549细胞的凋亡水平显著下降(P<0.05);使用miR-150-5p inhibitor敲低miR-150-5p后,发现非小细胞肺癌A549细胞的凋亡水平显著上升(P<0.05),见图1。

注:*P<0.05。图1 miR-150-5p对非小细胞肺癌A549凋亡的作用
2.2 miR-150-5p对PDIA6和TADA1表达的抑制作用
使用miR-150-5p mimics过表达miR-150-5p后,发现非小细胞肺癌A549细胞中PDIA6和TADA1的表达显著下降(P<0.05);使用miR-150-5p inhibitor敲低miR-150-5p后,发现非小细胞肺癌A549细胞中PDIA6和TADA1的表达显著上升(P<0.05),见图2。
2.3 miR-150-5p靶向PDIA6调控A549细胞凋亡水平的机制
使用siPDIA6和siTADA1分别敲低PDIA6和TADA1后,发现敲低PDIA6的非小细胞肺癌A549细胞的凋亡水平明显下降(P<0.05),而敲低TADA1的非小细胞肺癌A549细胞的凋亡水平无显著变化(P>0.05),见图3A;通过荧光素酶报告系统发现miR-150-5p靶向PDIA6(P<0.05),见图3B;通过转染过表达PDIA6后(见图3C),发现非小细胞肺癌A549细胞的凋亡水平明显上升(P<0.05),见图3D。

图3 miR-150-5p靶向PDIA6调控A549细胞凋亡水平
2.4 miR-150-5p/PDIA6回补实验
同时敲低miR-150-5p和PDIA6后,发现非小细胞肺癌A549细胞的凋亡水平无显著变化(P>0.05),见图4A;同时过表达miR-150-5p和PDIA6后,发现非小细胞肺癌A549细胞的凋亡水平无显著变化(P>0.05),见图4B。

图4 miR-150-5p/PDIA6回补实验
3 讨论
从组织学上讲,肺癌可以分为非小细胞肺癌和小细胞肺癌[3],大约85%的肺癌病例被诊断为NSCLC[4]。尽管在过去的几十年中,早期检测和治疗策略取得了许多进步,但5年生存率仍低于20%[2]。因此,关于非小细胞肺癌发病机理和分子机制的研究对于提升非小细胞肺癌的5年生存率至关重要。
microRNA是小的非编码RNA,在许多生物学过程中起重要作用。miRNA在非小细胞肺癌中失调,并参与肿瘤的发生、发展和耐药性[5]。已有研究报道[2],miR-150-5p已经被证实在非小细胞肺癌中失调。在本研究中,发现过表达miR-150-5p后,非小细胞肺癌A549细胞的凋亡水平显著下降(P<0.05);敲低miR-150-5p后,非小细胞肺癌A549细胞的凋亡水平显著上升(P<0.05)。除了在非小细胞肺癌,在各种其他癌症类型中检测到miR-150-5p的表达失调,包括肝癌、前列腺癌和白血病。Liu等[6]报道了miR-150-5p促进前列腺癌中的肿瘤干细胞的发生发展。然而,Zhang等[7]发现miR-150-5p抑制肝癌的增殖和转移。这表明miR-150-5p在不同癌症类型中可能起相反的作用。
microRNA通过直接结合靶基因mRNA的3'UTR负调控基因表达,从而导致mRNA降解或翻译抑制[8]。在本研究中,过表达miR-150-5p后,发现非小细胞肺癌A549细胞中PDIA6和TADA1的表达显著下降(P<0.05);敲低miR-150-5p后,非小细胞肺癌A549细胞中PDIA6和TADA1的表达显著上升(P<0.05)。此外,通过荧光素酶报告系统证实miR-150-5p靶向PDIA6(P<0.05)。因此,miR-150-5p在A549细胞中能够直接靶向PDIA6发挥其生物学功能。本研究发现,敲低PDIA6的非小细胞肺癌A549细胞的凋亡水平明显下降(P<0.05),而敲低TADA1的非小细胞肺癌A549细胞的凋亡水平无显著变化(P>0.05)。miRNA充当识别互补mRNA的模板,然后根据miRNA与目标mRNA的互补性,通过直接mRNA降解或翻译抑制来负调控mRNA表达[8]。因此miR-150-5p能够引起非小细胞肺癌A549细胞中PDIA6 mRNA的降解。尽管TADA1未能引起非小细胞肺癌A549细胞凋亡水平的改变,但是miR-150-5p是否直接靶向TADA1,以及是否发挥其他生物学功能值得进一步研究。
细胞凋亡是程序性细胞死亡的代表形式,可通过多种途径,例如内在和外在途径或内质网应激,由化疗药物诱导[9-10]。在本研究中,发现过表达PDIA6后,非小细胞肺癌A549细胞的凋亡水平明显上升(P<0.05)。同时敲低miR-150-5p和PDIA6后,发现非小细胞肺癌A549细胞的凋亡水平无显著变化(P>0.05);同时过表达miR-150-5p和PDIA6后,发现非小细胞肺癌A549细胞的凋亡水平无显著变化(P>0.05)。因此,miR-150-5p是PDIA6调控非小细胞肺癌A549细胞凋亡的上游。半胱氨酸依赖性和天冬氨酸定向蛋白酶家族-胱天蛋白酶在凋亡信号通路中起着至关重要的作用[11-13]。例如,caspases-8和caspases-9分别负责激活外在和内在的凋亡途径。因此,miR-150-5p/PDIA6调控的细胞凋亡通路可能是caspases-9途径。
综上所述,miR-150-5p通过靶向PDIA6信使RNA的3端非编码区抑制了PDIA6蛋白的翻译,随后抑制了非小细胞肺癌A549细胞的凋亡水平。

