左旋门冬酰胺酶联合化疗治疗急性淋巴细胞白血病儿童对血糖及免疫功能影响的临床研究
李芸蕊 张 磊 刘 阳 赵丽丽
急性白血病属于造血干细胞恶性增殖性血液科疾病,具有发病迅速、病情复杂、死亡率高等特点,其中急性淋巴细胞白血病(acute lymphoblastic leukemia,ALL)发病率占所有白血病的15%,而占急性白血病的30%~40%,且多发于15岁以下的男性儿童[1]。发病时因骨髓中异常的原始淋巴细胞及幼稚淋巴细胞异常增殖而造成多脏器损伤,进而表现出贫血、出血、感染、免疫功能下降等症状,影响其生存质量[2]。现临床针对ALL患儿的治疗主要以化疗为主,联合化疗已取得理想疗效,其中以长春新碱及泼尼松组成的VP化疗方案属于其基础治疗方案,但目前国际认为其不适宜高危患儿,且疗效存在局限性[3]。左旋门冬酰胺(L-Asparaginase,L-Asp)为主的联合化疗方案则在一定程度上提高了远期疗效,L-Asp作为1种酶抑制剂,主要通过水解门冬酰胺发挥杀伤肿瘤细胞的作用,但部分报道显示其化疗期间高血糖、凝血功能异常等不良反应较为严重[4]。本研究采用回顾性分析的方法观察L-Asp联合化疗治疗ALL儿童对血糖及免疫功能影响的临床疗效。
1 资料与方法
1.1 一般资料
1.1.1 研究对象 回顾性分析2016年6月至2019年6月于我院接受治疗的80例ALL患儿的临床资料,并根据其治疗方法分组,其中VP组39例,VDLP组41例。本研究已获得医院伦理委员会批准。两组患儿性别、年龄、临床分型、法、美、英分型系统(French-American-British classification systems,FAB)分型等一般临床资料比较均无统计学意义(P均>0.05),具有可比性,见表1。

表1 两组临床资料比较
1.1.2 纳入标准 ①符合《儿童急性淋巴细胞白血病诊疗建议(第四次修订)》[5]中小儿ALL相关诊断标准,并通过骨髓细胞学或病理学检查确诊者;②临床检查资料完整者;③具备正常的阅读及听说能力者;④其监护人自愿签署知情同意书者;⑤年龄1~14岁;⑥初诊ALL,并于我院首次接受化疗治疗者。
1.1.3 排除标准 ①严重肝肾功能不全者;②意识及沟通障碍者;③预计生存期<6个月者;④随访失联,中途退出者;⑤存在化疗药物过敏反应者。
1.2 方法
1.2.1 治疗方法 VP组:分别于化疗第8 d、15 d、22 d、28 d静脉注射长春新碱1.5 mg/m2(最大剂量不可超过2 mg/m2/次),于化疗第1~28 d口服泼尼松40 mg/m2/d,7 d内减停,预防髓外白血病主要是三联(甲氨蝶呤+阿糖胞苷+地塞米松)鞘注,于化疗第22天、第33天复查骨髓缓解情况。VDLP组:分别于化疗第8 d、15 d、22 d、28 d静脉注射长春新碱1.5 mg/m2(最大剂量不可超过2 mg/m2/次),于化疗第1~28 d口服泼尼松60 mg/m2/d,3次/d,前7 d为剂量试验,29 d后剂量每间隔1 d减少1/2,7d内减停,于化疗第8~10 d静脉注射柔红霉素,注射前使用5%的葡萄糖溶液100 ml混匀,注射时间控制在30~40 min,于化疗第9 d、11 d、13 d、15 d、17 d、19 d、21 d、23 d静脉滴注左旋门冬酰胺酶5000~10000 U/m2,预防髓外白血病采用大剂量甲氨蝶呤和三联鞘注,于化疗第22天、第33天复查骨髓缓解情况。
1.2.2 指标检测方法 于治疗前及治疗33 d后,行常规静脉采血5 ml,以3000 r/min离心血样10 min,提取血清并于-70 ℃条件下保存待测。采用酶联免疫吸附法试剂盒(上海臻科生物科技有限公司)测定患儿胰岛素样生长因子结合蛋白-3((insulin-like growth factor binding protein 3,IGFBP-3)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)、肿瘤特异性生长因子(TSGF)水平,所有试剂盒操作均严格按照试剂盒自带说明书进行。通过迈瑞Mindray全自动生化分析仪BS-220(武汉盛世达医疗设备有限公司)测定两组乳酸脱氢酶(LDH)变化。通过CytoFLEX流失细胞仪(贝克曼库尔特商贸有限公司生产)检测两组患儿的T淋巴细胞亚群(CD3+、CD4+、CD8+)水平。
1.3 评估标准
1.3.1 临床疗效 参考全国指定的《血液病诊断及疗效标准》[6]评估其临床疗效,完全缓解(complete remission,CR):临床症状完全消失,骨髓象原始粒细胞Ⅰ+Ⅱ型≤5%,实验室指标检查血小板及中性粒细胞等水平恢复正常,红细胞系及巨核细胞系正常;部分缓解(partial remission,PR):临床症状基本消失,WBC水平较治疗前显著下降,5%<骨髓原始粒细胞Ⅰ+Ⅱ型≤20%,血象指标未完全恢复正常;未缓解(no-remission,NR):临床症状无缓解,WBC、PLT水平较治疗前无改善,或者其病情存在加重趋势,总有效率=(CR+PR)/总例数×100%。
1.3.2 不良反应 两组患儿随访3~12个月,平均随访(8.25±2.15)个月,观察并记录两组患儿治疗过程中骨髓抑制、消化道反应、高血糖、肝脏损伤、肾脏损伤、凝血功能异常、感染等相关不良反应发生情况。部分不良反应均采用世界卫生组织(WHO)在抗癌药急性及亚急性毒性反应分级中制定的相关标准[7],分为0~4级。在应用诱导化疗方案治疗过程中密切关注其空腹血糖(FBG)水平变化,药物性高血糖标准为FBG>6.7 mmol/l。化疗期间及治疗结束后均需评估其凝血功能5项,包括血浆凝血酶原时间(PT)、D-二聚体(DD)、活化部分凝血酶原时间(APTT)、纤维蛋白原(FIB)、凝血酶时间(TT),以PT较正常值延长>3S、APTT较正常值延长>10S、FIB<2 g/l为异常标准。感染标准参考《医院感染诊断标准》中的规定,①腋温连续2 d>38 ℃,②存在咳嗽、腹泻、皮肤感染等症状,③实验室指标及影像学观察检测阳性,出现上述中的1项及以上者可确诊。
1.4 观察指标
比较两组短期内(治疗后33 d)临床疗效,并记录其治疗前、治疗后的血清生化指标(IGFBP-3、LDH、TNF-ɑ、TSGF)及免疫功能(CD3+、CD4+、CD8+、CD4+/CD8+)变化,并评估随访过程中的骨髓抑制、消化道反应、高血糖等不良反应发生情况。
1.5 数据分析
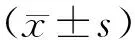
2 结果
2.1 临床疗效比较
治疗33 d后,VDLP组总有效率为82.93%,VP组为74.36%,差异无统计学意义(P>0.05),见表2。

表2 两组患儿临床疗效比较(例,%)
2.2 血清生化指标比较
治疗33 d后,两组患儿IGFBP-3、TNF-ɑ水平均较治疗前显著上升(P<0.05),而LDH、TSGF水平与治疗前比较均显著下降(P<0.05),且VDLP组变化幅度更大(P<0.05),见表3。
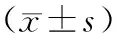
表3 两组患儿IGFBP-3、LDH、TNF-ɑ、TSGF水平比较
2.3 T淋巴细胞亚群比较
治疗33 d后,两组患儿CD3+、CD4+及CD4+/CD8+水平均较治疗前显著上升(P均<0.05),而CD8+水平较治疗前显著下降(P<0.05),且VDLP组变化幅度更大(P<0.05),见表4。
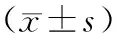
表4 两组患儿CD3+、CD4+、CD8+及CD4+/CD8+水平比较
2.4 不良反应比较
VDLP组化疗期间高血糖、凝血功能异常发生率明显高于VP组(P<0.05),末梢神经炎及便秘发生率明显低于VP组(P<0.05),其他不良反应发生率比较均无统计学意义(P均>0.05),见表5。

表5 两组不良反应比较(例,%)
3 讨论
目前,临床解释ALL病因尚不明确,可能与生物因素、物化因素、遗传因素等有关,治疗方式以化疗为主,联合化疗是其治疗核心并贯穿始末[8]。ALL患儿化疗过程包括诱导缓解、巩固强化、维持治疗及庇护预防4个步骤,其中诱导治疗指的是通过给予化疗药物治疗以达到完全缓解的效果,从而为患儿争取经造血干细胞移植而痊愈的机会,是提高长期无病生存率的关键,在此阶段治疗方案的选择关系到白血病细胞的杀伤情况,及耐药细胞株的产生[9]。但值得注意的是,考虑患儿年龄偏小,各方面生理机能尚未发育成熟,高强度的诱导化疗较易产生毒副作用,进而造成肝、肾、心脏等功能性损伤[10]。因此,在保证治疗疗效的同时选择何种安全性高的诱导缓解化疗方案一直是临床血液肿瘤领域的关注重点。
以往临床治疗ALL的联合化疗方案中以长春新碱和泼尼松组成的VP方案是其基础,但随着研究的不断深入,诸多报道显示,单用VP方案对儿童ALL的缓解率较为理想,可达到85%~95%,但针对成人的缓解率则仅为36%~67%,且无病生存期较短[11]。目前,国内外认为治疗ALL的诱导缓解方案需包括长春新碱及蒽环类似物,而以L-Asp为主的联合化疗方案更是为临床治疗带来新机遇[12]。本研究通过观察两组患儿治疗疗效,结果显示其无统计学意义,证实两种治疗方案治疗儿童ALL有效率相当,与以往研究报道一致[13]。
ALL的发病过程中免疫系统损害具有重要作用,而从细胞角度而言是其异常增殖及凋亡失控后的结果,而IGFBP-3对造血干细胞的增殖、分化及凋亡等具有一定调控作用,主要通过与胰岛素样生长因子-1进行竞争性结合,进而阻止其与相关蛋白的合成,抑制肿瘤细胞的生长分化[14]。LDH在人体内主要由白血病细胞等分泌,ALL患儿初诊时的LDH较健康正常人显著更高,则是因为白血病细胞负荷过重,导致其从肿瘤细胞内释放增多,可作为评估其疗效及预后的指标[15]。TNF-ɑ属于人体肿瘤免疫的关键因子,其基因多态性可调控细胞因子表达,进而影响ALL病情发展,聂钰君[16]学者研究发现与初诊患儿相比,完全缓解的患儿其血清中TNF-ɑ水平异常升高。TSGF是临床常见血清肿瘤标志物的一种,主要发挥促进恶性肿瘤细胞周围毛细血管异常增殖并释放的作用[17]。本研究与以往研究不同的是,通过观察分析以上指标变化,并从T细胞亚群的角度分析其免疫功能变化,旨在明确两种治疗方案的具体疗效差异,结果显示VDLP化疗方案更有利于患儿免疫功能的恢复。可能是因为,考虑淋巴系统中的肿瘤细胞无自身合成门冬酰胺的能力,需靠从细胞外摄取维持蛋白质的合成,而L-Asp属于生物酶抑制剂,可针对性催化水解血液中的门冬酰胺,从而减少此类氨基酸的释放,促使淋巴系统肿瘤细胞因缺乏必须氨基酸而出现生长抑制的情况,最终发挥杀伤白血病细胞的效果,有利于预后及各项血清指标的恢复。
另外,结果还显示VDLP组化疗期间高血糖、凝血功能异常发生率明显高于VP组,考虑是因为L-Asp药物本身影响凝血因子,或对胰岛素的合成及释放存在一定影响,用药后可导致胰岛素受体水平下降从而引发继发性高血糖,且与长春新碱、蒽环类药物等合用更存在加剧血糖升高的风险。但本研究因观察时间有限,未对其远期疗效做长期跟随调查,结果存在一定局限性。
综上所述,VDLP诱导缓解化疗治疗ALL患儿疗效理想,可有利于IGFBP-3、TNF-ɑ等血清指标的恢复,但治疗期间较易出现高血糖及凝血功能异常,需密切关注其相关指标变化,及时给予处理。

