肌肉衰减综合征对运动治疗老年慢性腰痛患者最小临床重要差异的影响
周琪,张文婷,于珉
(海军青岛特勤疗养中心疗养五科,山东青岛 266000)
肌肉衰减综合征是增龄相关性疾病,其特征是骨骼肌质量和力量的进行性和广泛性丧失,并可能出现诸如身体残疾、生活质量差和死亡等不良后果[1]。有关慢性腰痛(chronic low back pain, CLBP)和肌肉关系的研究[2]显示,CLBP与腰伸肌和多裂肌肌肉衰减综合征相关,腰痛复发率与肌肉损伤所致的脊柱稳定性受损有关。运动疗法治疗CLBP有较好的疗效,但运动疗法对伴有骨骼肌重量减少的CLBP患者疗效尚不明确。最小临床重要性差异(minimal clinically important difference,MCID)是患者认可的最小临床疗效评价问卷评分变化值,是评估治疗满意度的新型判定标准[3]。本研究旨在探讨肌肉衰减综合征对运动疗法治疗老年CLBP患者MCID的影响,现报告如下。
1 资料与方法
1.1 一般资料
选择2018年7月~2020年6月在本院就诊的CLBP患者作为研究对象。纳入标准:①年龄60~75岁,腰部疼痛不适时间>3个月;②X线、CT、双能X线骨密度检测仪和MRI检查未见可解释腰痛症状的器质性疾病;③VAS评分≥3分;④未接受其他治疗方法;⑤患者已签署研究知情同意书。排除标准:①腰部器质性病变、神经根受累或骨关节疾病导致的腰部疼痛;②急性LBP、需要治疗的下肢骨关节炎患者;③既往有腰部手术或下肢手术史者;④研究期间自行添加治疗药物,可能影响研究评定者;⑤精神疾病或严重认知功能障碍,研究依从性差、明确拒绝随访者。共纳入患者163例,其中男87例,女76例;年龄60~75岁,平均(68.03±5.24)岁。
1.2 研究方法
所有患者均采用运动疗法治疗,锻炼内容包括双桥运动、单桥运动、双膝屈曲双桥运动、反桥运动、髋膝关节屈曲反桥运动、单腿伸直反桥运动等,每日上、下午各完成2组,每组10次。所有患者均连续训练2个月。
记录患者的年龄、性别、身高、体质量、体质量指数、吸烟、饮酒、文化程度、骨骼肌指数(skeletal muscle index,SMI)、腰痛持续时间、VAS评分、罗兰莫里斯功能障碍指数(Roland-Morris disability duestionnaire,RMDQ)等临床资料。文化程度分为≤高中和≥大专。RMDQ用于评价腰痛患者测试前24 h内的状况,包括行走、站立、弯腰、卧床、穿衣、睡眠、生活自理、日常活动等8个方面,分值范围0~24分,得分越高说明功能障碍越严重。主要疗效评估指标为患者治疗前后VAS评分,次要评估指标为治疗前后RMDQ。参照有关文献报道,采用最小临床重要差异(minimal clinically important difference,MCID)确定干预的临床效果,以VAS降低2分和RMDQ评分降低30%,定义为MCID[4]。
肌肉衰减综合征诊断标准:采用Inbody 720生物电阻抗分析仪测量骨骼肌质量,根据四肢骨胳肌质量(kg)与身高(m)的平方比值计算SMI,参照中华医学会老年医学分会老年康复学组编制的《肌肉衰减综合征中国专家共识(草案)》,以男性SMI<7.0 kg/m2、女性SMI<5.4 kg/m2作为肌肉衰减综合征的诊断标准[5]。
1.3 统计学方法
采用SPSS 23.0软件包进行数据分析,计量资料采用“x2”表示,采用t检验;计数资料采用率或百分比表示,采用x2检验,多因素分析采用Logistic回归分析,P<0.05为差异有统计学意义。
2 结果
163例中,共71例检查出肌肉衰减综合征,占43.55%。肌肉衰减综合征患者的年龄、疼痛持续时间、VAS、RMDQ均显著高于非肌肉衰减综合征患者(P<0.05),体质量指数显著低于非肌肉衰减综合征患者(P<0.05),差异均有统计学意义;两组患者的性别差异无统计学意义(P>0.05),见表1。两组患者治疗后的VAS和RMDQ评分均较治疗前显著降低(P<0.05),且非肌肉衰减综合征组的MCID显著高于肌肉衰减综合征组,差异均有统计学意义(P<0.05),见表2。
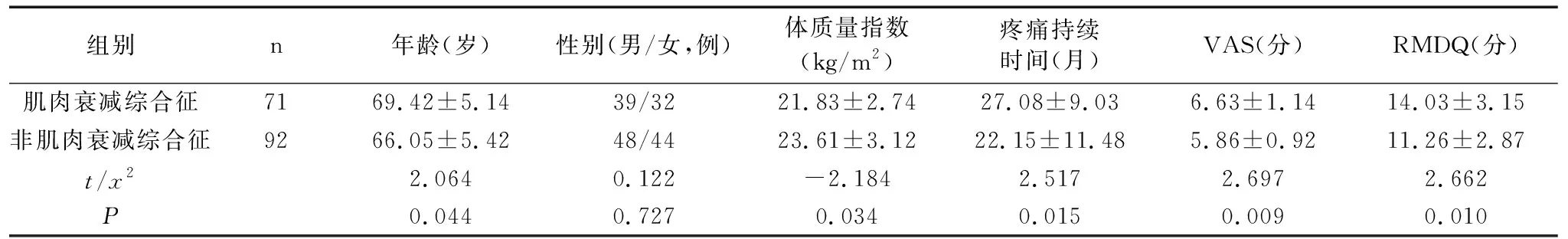
表1 肌肉衰减综合征和非肌肉衰减综合征患者的临床特征比较
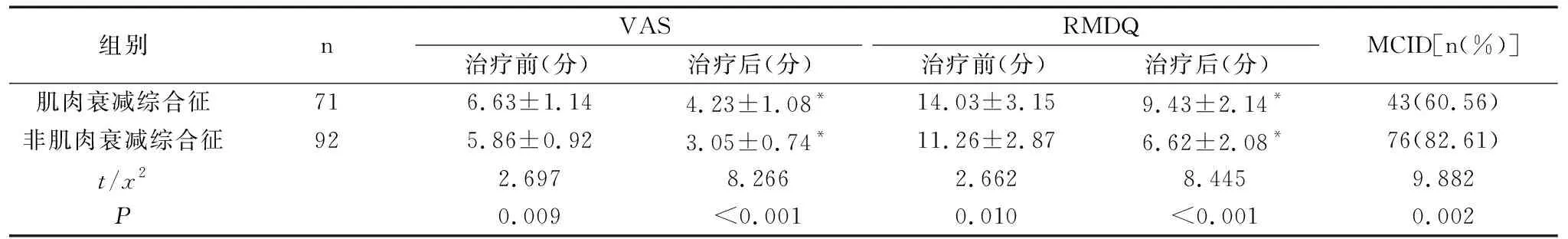
表2 肌肉衰减综合征和非肌肉衰减综合征患者的临床预后比较
单因素分析显示,MCID组和非MCID组患者的年龄、体质量指数、吸烟、文化程度、疼痛持续时间、基线VAS、基线RMDQ、肌肉衰减综合征等临床资料比较,差异有统计学意义(P<0.05),见表3。将单因素分析存在统计学意义的自变量引入多因素Logistic回归分析,结果显示,肌肉衰减综合征、年龄是MCID的限制性因素,文化程度是MCID的促进因素,P均<0.05,见表4。
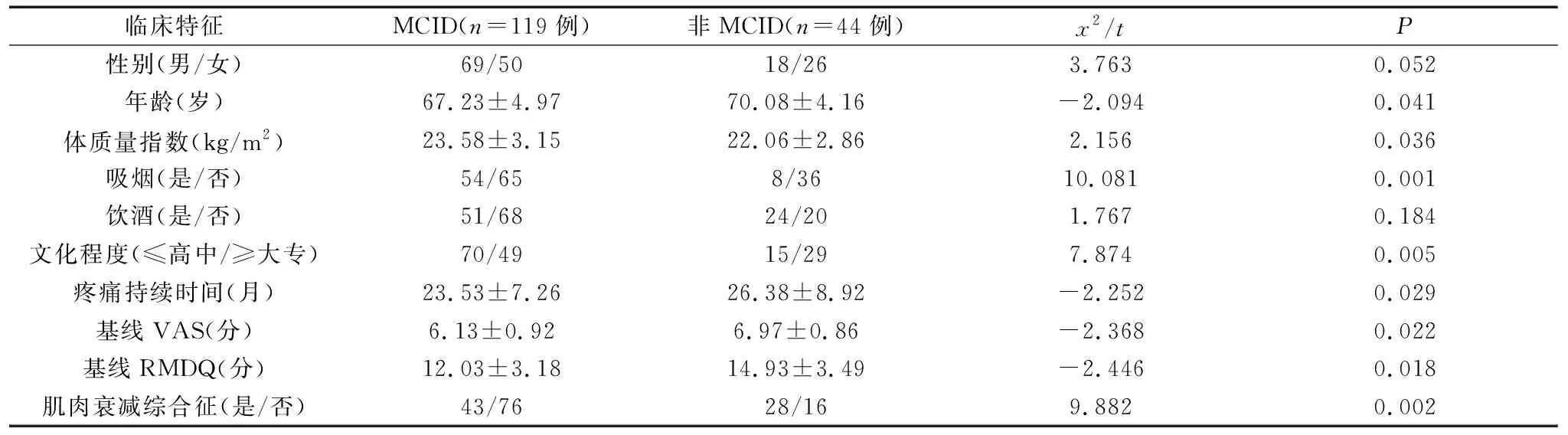
表3 MCID和非MCID患者临床特征比较

表4 肌肉衰减综合征影响临床疗效的多因素分析
3 讨论
肌肉衰减综合征表现为肌肉质量减少和功能减退,影响患者的肌肉功能、身体活动和生活质量,国际疾病分类(international Classification of diseases ,ICD)已将肌肉衰减综合征列为独立的疾病[6]。肌肉衰减综合征的特征是II型肌纤维萎缩和II型纤维卫星细胞含量的减少,有学者提出了某些导致肌肉衰减综合征的机制,如胰岛素样生长因子-1介导的促进肌卫星细胞增殖、炎性细胞因子(包括肿瘤坏死因子α和白细胞介素)、氧化应激、合成代谢激素(包括睾酮、雌激素和生长激素)等引起的慢性低度炎症[7]。因此,可以认为肌肉衰减综合征是一种受系统分子机制影响而非局部反应影响的多维度衰老现象,鉴于我国老龄化进程加速和老年人口数量的快速增长,一些研究人员试图阐明肌肉衰减综合征的机制,并开发有效的针对性干预措施。
肌肉衰减综合征在60岁以上人群中患病率为5%~13%,在80岁以上人群中发生率高达50%[8]。既往研究中,LBP患者中的肌肉衰减综合征发生率为25%~35%[9]。本研究发生率为43.55%,高于既往报道。肌肉衰减综合征发生率较高的原因,可能与患者入组年龄、种族等基线情况相关。本研究结果显示,虽然肌肉衰减综合征的发生率较高,但运动疗法仍可通过维持活动和增强身体功能以改善CLBP患者的症状和功能状态。目前,肌肉衰减综合征的机制与年龄相关性疼痛的关系尚未阐明。研究显示,运动锻炼是肌肉衰减综合征的有效干预方式,通过运动训练,可显著增强老年人的肌肉力量、肌肉体积及肌纤维横断面[10]。肌肉衰减综合征常伴抑郁、焦虑等不良情绪,CLBP患者抑郁、焦虑的发生率也高于正常人群,肌肉衰减综合征和CLBP对精神状态的负性影响具有协同作用,二者共同促进了患者负性情绪的发生,而负性情绪又导致疼痛敏感度增加。对此,运动疗法缓解患者抑郁、焦虑等精神状态的效果已得到证实[11]。脑源性神经营养因子(brain derived neurotrophic factor,BDNF)与骨骼肌肉衰减综合征相关,机体功能降低、骨骼肌质量降低的患者BDNF水平显著低于健康个体,而有氧运动可提高BDNF水平,改善肌肉衰减综合征状态[12]。综合本研究结果显示,对CLBP伴肌肉衰减综合征的患者而言,运动疗法是有效的干预方式。
本研究显示,肌肉衰减综合征是MCID的限制性因素,伴肌肉衰减综合征的患者MCID率更低。CLBP是常见的肌肉骨骼症状之一,引起腰痛的潜在原因包括椎间盘退变、小关节肥大、节段性不稳定和肌肉功能退变等。CLBP的患病率随着年龄的增长而增加,超过1/3的社区老年人出现腰痛,大多数老年CLBP患者被诊断为“非特异性LBP”,通常导致临床异质性和多因素的并发症。CLBP的发生可能涉及多种机制,包括腰椎、脊柱力学、关节突关节和椎旁肌的直接损伤,多数患者影像学检查结果与临床症状之间的相关性较差。既往有研究显示,背部肌肉退行性变是导致腰痛的重要原因,但相关研究关注的重点多为肌肉萎缩和脂肪浸润,较少涉及到肌肉功能性改变对CLBP的影响[13]。研究显示,背部肌肉退行性变可分为形态改变和功能减退,前者常以横截面积和脂肪浸润率进行评估,后者通过腰伸肌力量进行评估。根据肌肉衰减综合征亚洲工作组的研究显示,肌肉衰减综合征并不一定与背部肌肉退化呈相关性,认为肌肉衰减综合征和背部肌肉退化均可能是诱发腰痛的独立风险因素[14]。国外研究显示,肌肉衰减综合征和背部肌肉退化均可导致背部疼痛,而肌肉衰减综合征和非肌肉衰减综合征患者横截面积、脂肪浸润率等没有差异[15],进一步说明肌肉衰减综合征与背部肌肉退行性变没有直接关系,应被视为影响CLBP的独立因素。本研究中,肌肉衰减综合征患者的MCID发生率低于非肌肉衰减综合征患者,分析其原因,可能是运动疗法虽然对衰老性肌肉衰减综合征和CLBP均有治疗作用,但2个月的短期运动疗法不能完全逆转衰老性肌肉衰减综合征的影响,延长运动时间或增加运动强度是否能进一步改善肌肉衰减综合征患者的预后,还需进一步研究探讨。
综上所述,本研究结果显示,肌肉衰减综合征在老年CLBP患者中具有较高的患病率。无论患者是否合并肌肉衰减综合征,运动疗法均可显著改善患者的疼痛评分和功能状态。肌肉衰减综合征可影响运动疗法治疗CLBP的效果,临床应予高度重视,对合并肌肉衰减综合征的CLBP患者应考虑增加运动强度和延长运动干预的观察时间,以增强干预效果。

