哺乳动物卵巢储备形成中的DNA损伤修复
周志贤,朱芳,殷缓,苏叶,蔡海奕,符淳
哺乳动物的卵巢内原始卵泡的数量和质量构成了卵巢的储备,其生育能力和后代健康依赖于卵巢储备中卵泡数目和性成熟阶段高质量卵母细胞的充足供应[1]。因此,卵巢储备反映雌性哺乳动物的生殖潜能。卵巢储备形成过程中,生殖细胞处于DNA复制增殖和减数分裂重组的活跃期,易发生各种DNA损伤导致卵泡丢失。卵泡大量丢失导致卵巢储备功能低下,并与原发性卵巢功能不全(primary ovarian insufficiency,POI)、不孕和卵巢早衰等多种疾病相关[2]。在原始卵泡形成过程中,各种DNA损伤修复途径对维持生殖细胞基因组稳定有重大意义,也是保证充足的卵巢储备以维持女性生育能力和产生健康配子的重要机制。生殖细胞的发育作为一项复杂的生命活动,受到多种因素的调节和影响。一方面,生殖细胞发育中存在调节作用的DNA损伤修复机制尚不完全清楚。如:直接损伤逆转途径和非同源末端连接途径等DNA损伤修复途径是否调节原始卵泡形成还有待进一步探讨。另一方面,研究证实卵巢干细胞存在下,哺乳动物绵羊的成年卵巢中观察到新卵发生和原始卵泡形成[3]。本文主要综述卵巢储备形成中相关的DNA修复途径对生殖细胞生长发育的调节作用。
1 卵巢储备形成过程中的DNA损伤和修复途径
在原始卵泡的形成过程中,生殖细胞处于快速有丝分裂增殖和减数分裂重组的活跃期,在各种内外源性因素影响下易发生各种形式的DNA损伤。各种物理、化学和生物因素导致的DNA损伤的常见形式有:DNA 错配、缺失、链间交联(interstrand crosslink,ICL)、双键断裂(double-strand break,DSB)、复制叉停滞或断裂和DNA双螺旋结构扭曲等。在哺乳动物原始生殖细胞(primordial germ cell,PGC)增殖到原始卵泡组装形成的过程中,多条DNA修复途径参与维持生殖细胞基因组的稳定性[4]。主要包括:同源重组(homologous recombination,HR)途径、范可尼贫血(Fanconi anemia,FA)途径、错配修复(mismatch repair,MMR)途径、碱基切除修复(base excision repair,BER)途径和核苷酸切除修复(nucleotide excision repair,NER)途径。见表1和图1。

图1 原始卵泡形成过程中的DNA损伤修复途径

表1 原始卵泡形成过程中的DNA损伤修复途径
目前研究探讨哺乳动物原始卵泡形成过程大多采用小鼠模型。小鼠原始卵泡的发育约需要17 d,分为5个阶段[5-6],见图2。阶段①PGC增殖和多能性维持(胚胎5.5~7.5 d),BER途径开始促进生殖细胞多能性表达。阶段②PGC迁移到达性腺成为卵原细胞(胚胎8~10.5 d)。阶段③生殖细胞巢形成,生殖细胞数目达峰值(胚胎11~13.5 d)。此阶段中FA途径对减少生殖细胞凋亡和维持其基因组稳定有重要意义,NER途径协助FA途径修复损伤,BER途径发挥作用维持生殖细胞基因组稳定。阶段④减数分裂启动,DNA损伤高发(胚胎13.5 d开始)。此阶段中,HR途径对促进生殖细胞正确减数分裂、减少其凋亡和维持其基因组稳定至关重要。阶段⑤生殖细胞巢破裂,原始卵泡组装形成(出生后0~2 d)。最终生殖细胞巢内约1/3数量的生殖细胞被颗粒细胞环绕组装成原始卵泡,即生殖细胞最大损失阶段。
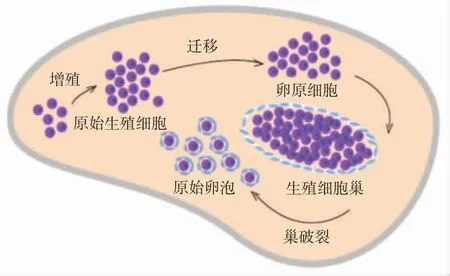
图2 卵巢储备形成过程(从原始生殖细胞到原始卵泡)
2 DNA损伤修复途径在卵巢储备形成中的作用
2.1 HR途径减数分裂重组过程诱导的生理性DSB由HR途径修复,形成交叉(crossover,CO)或非交叉(noncrossover,NCO)两种产物,见图3a[7]。HR途径修复DSB形成CO,对生殖细胞正确减数分裂产生功能性配子至关重要,是维持生殖细胞基因组稳定的重要机制。HR途径避免胞内DNA损伤积累,在减少生殖细胞凋亡和维持其基因组稳定方面发挥重要作用。HR途径保护复制叉(见图3b)[8-9]和重启停滞的复制叉(见图3c)[10],促进生殖细胞DNA合成。另外,HR途径DNA修复基因缺失与POI的基因组不稳定相关。
2.1.1 修复DSB促进生殖细胞减数分裂HR途径促进生殖细胞正确减数分裂,对产生功能性配子和维持生殖细胞基因组稳定至关重要。在减数分裂重组过程中,HR途径修复同源染色体上的DSB形成CO。研究表明,同源染色体对至少需获得1个CO,以确保其在第一次减数分裂后期正确分离[7]。这提示,HR途径促进生殖细胞减数分裂正确进行,对产生具有正确染色体数和正常功能的配子至关重要。另有研究发现Spo11缺陷小鼠由于DSB诱导缺陷和减数分裂重组缺陷,产生的配子无功能[11]。另外,卵母细胞减数分裂中染色体错误分离,导致后代非整倍体,是人类自然流产、不孕和出生缺陷的重要原因。研究表明,绝大多数非整倍体染色体是卵母细胞减数分裂过程中染色体分离错误所致[12]。这提示HR途径维持生殖细胞基因组稳定,对减少后代非整倍体事件发生有重要意义。
2.1.2 减少生殖细胞凋亡HR途径缺陷导致生殖细胞内DNA损伤累积,造成减数分裂停滞和基因组不稳定。生殖细胞因此提前经历凋亡,导致卵泡数量减少[13]。HR途径基因Brca2-/-小鼠观察到DNA修复反应减弱,其生殖细胞内存在明显的DSB积累和染色体错配,并且卵泡数量减少约一半[14]。HR途径基因Dmc1-/-不育小鼠也观察到DNA修复反应缺陷,其生殖细胞存在减数分裂抑制和凋亡加速[15]。这都提示,HR途径正确修复DNA损伤,是生殖细胞凋亡减少和维持基因组稳定的重要机制。
2.1.3 促进生殖细胞DNA复制HR途径保护和重启停滞复制叉,促进生殖细胞DNA完整复制。研究表明HR途径蛋白(BRCA1、BRCA2、RPA和RAD51)参与保护停滞的复制叉和新生DNA链;BRCA1和BRCA2参与重启复制叉,预防染色体畸变[16];RAD51和RPA促进复制叉重启和DNA合成[8]。这提示HR途径保护和重启复制叉,促进DNA合成,在促进生殖细胞增殖和维持其基因组完整方面发挥作用。
2.1.4 基因缺失与POI的基因组不稳定有关研究发现HR 途径基因(MCM8、MCM9、DMC1、BRCA2、STAG3、SMC1、REC8、RAD51、SYCE1、SYCP3和SPIDR)等的变异与POI的基因组不稳定显著关联[2]。对50例POI患者的全外显子测序鉴定出RAD51杂合突变,RAD51-/-细胞表现出DSB修复效率低下[17]。对1例POI患者家庭成员的全外显子测序鉴定出STAG3纯合突变[18]。对1例POI患者家庭成员的全外显子测序鉴定出MCM8纯合和杂合突变[19]。对14例POI患者的全外显子测序鉴定出MCM9纯合突变[20]。这提示,HR途径缺陷造成DNA损伤修复缺陷和DNA完整复制障碍可能与POI患者的生殖细胞基因组不稳定有关。
2.2 FA途径FA途径修复ICL(见图4)[21],形成DSB以激活HR途径。FA途径修复ICL,是减少生殖细胞凋亡和维持其基因组完整的重要机制。FA途径保护和促进复制叉重启(见图3b),有效促进生殖细胞增殖和维持其基因组完整。另外,FA途径基因缺失可能解释了POI的病因。

图3 HR途径修复DSB,保护和重启复制叉

图4 FA途径修复ICL
2.2.1 修复ICL减少生殖细胞凋亡研究表明FA途径修复ICL,是减少生殖细胞凋亡和维持其基因组稳定性的重要机制[22]。生殖细胞暴露于各种内外源因素下可产生ICL,这形成直接物理障碍造成复制叉停滞。FA途径缺陷情况下,生殖细胞内累积DNA损伤导致基因组不稳定,在进入减数分裂之前(胚胎10.5~12.5 d)发生凋亡,造成卵泡数目减少。研究发现,多数FA基因缺陷小鼠(Fanca-/-、Fancc-/-、Fancd1-/-、Fancd2-/-、Fance-/-、Fancf-/-、Fancg-/-、Fanci-/-、Fancl-/-、Fancm-/-、Fanco-/-、Fancp-/-、Fancr-/-、Fancu-/-、Fancv-/-和Fancw-/-)均表现出卵泡数量减少[23-24]。其中部分小鼠(Fanca-/-、Fancd1-/-、Fancd2-/-、Fanci-/-、Fancm-/-、Fanco-/-和Fancp-/-)表现出减数分裂前生殖细胞内DNA损伤累积和凋亡加速。Fanca+/-小鼠观察到DNA修复功能缺陷和对有害因素敏感,导致生殖细胞凋亡加速[25]。这些研究提示FA途径修复DNA损伤,在减少生殖细胞凋亡和维持其基因组稳定方面发挥重要作用。
2.2.2 促进生殖细胞增殖FA途径促进复制叉重启和生殖细胞DNA复制,有效促进生殖细胞增殖和维持其基因组完整。在停滞复制叉位点,FA途径蛋白(FANCD1/BRCA2、FANCD2、FANCI、FANCS/BRCA1和FANCR/RAD51)协同促进复制叉重启[26];FANCJ支持DNA复制[27];FANCM特异靶向FA核心与DNA结合以促进复制叉重启[28]。这提示FA途径在复制叉重启中发挥作用。FA途径缺陷使生殖细胞易发生复制叉停滞和基因组不稳定,从而阻碍了生殖细胞增殖。观察到Fancm缺陷小鼠复制叉重启障碍和基因组不稳定导致了细胞增殖减少和胚胎死亡率升高[29]。观察到Fanci-/-小鼠卵泡数量极少,表现为性腺功能减退甚至不孕[23]。观察到Fanca-/-和Fancc-/-小鼠生殖细胞减数分裂前增殖减少和染色体畸变[24]。这提示FA途径功能完整,在避免复制相关的基因组不稳定和促进生殖细胞增殖方面发挥作用。
2.2.3 基因缺失与POI的关系FA途径缺陷患者常表现为POI[24]。对50例汉族POI患者的全外显子测序结果显示,FANCA的杂合突变与POI相关[25]。相较于野生型小鼠Fanca+/-小鼠也表现为出生后原始卵泡丢失加速和生育力降低[25]。对10例POI患者的全外显子测序也鉴定出FANCM的两种杂合突变[30]。对1例POI患者家庭成员的全外显子测序鉴定出FANCD1纯合突变[31]。这提示,FA途径基因突变与POI有关。FA基因缺陷造成生殖细胞增殖减少和凋亡增多,可导致卵巢储备功能低下甚至不育,这可能部分解释了POI病因。另外,部分FA基因(FANCD1、FANCJ和FANCN)的杂合突变不足以发展出POI表型,但其表现出的基因组不稳定与癌症的风险增加有关[32-33]。
2.3 BER途径BER途径是生殖细胞表达多能性和维持基因组稳定的重要机制,对原始生殖细胞发育形成原始卵泡的正常进展十分重要。BER途径在胚胎7.25 d左右促进原始生殖细胞多能性基因的表达。在进入减数分裂前(约胚胎11.5 d),BER途径调节生殖细胞的全基因组的表观遗传编程过程,以促进生殖细胞分化和维持基因组稳定;其中包括亲本印记擦除、全基因组DNA去甲基化和大规模染色质重塑等[34]。该过程也可修复部分由DNA损伤修复缺陷造成的基因组不稳定。研究表明BER途径X射线修复交叉互补蛋白1(XRCC1)缺乏造成生殖细胞表观遗传缺陷,导致异常精子发生并且致男性不育[35]。但BER途径的表观遗传修饰与卵泡发育的关系有待进一步探讨。
2.4 MMR途径MMR途径维持生殖细胞正确减数分裂,促进生殖细胞发育和维持基因组稳定。MMR途径基因Mlh3和Msh5缺陷雄性小鼠中观察到CO形成障碍和减数分裂缺陷,表现为不育[36-37]。这提示,MMR途径缺陷情况下,生殖细胞可以因CO形成障碍导致减数分裂中断。MMR途径与卵泡发育的关系有待进一步探讨。另外,MMR途径可修复部分DNA损伤如碱基错配等,可能有利于维持生殖细胞基因组完整。对1例POI患者家庭成员的全外显子测序鉴定出MSH4纯合突变[38]。这提示,MMR途径缺陷造成的生殖细胞发育停滞和基因组不稳定可能与POI有关。
2.5 NER途径NER途径协助FA途径修复DNA损伤,去除ICL脱钩后残余的DNA加合物[21]。这提示NER途径协助FA途径修复损伤,可能间接作用于生殖细胞基因组完整的维持。研究表明NER途径缺陷造成基因组不完整与癌症的风险增加有关,NER途径DNA损伤特异结合蛋白2(DDB2)抑制卵巢癌干细胞的去分化从而抑制卵巢癌的进展[39]。对210例孟加拉国宫颈癌患者的研究中,发现NER途径基因ERCC4和XPC缺陷影响DNA修复能力并与宫颈癌高风险有关[40]。另外,NER途径与卵泡发育的关系有待进一步探讨。
3 结语
综上所述,多种DNA损伤修复途径在卵巢储备的形成中发挥作用。这些功能对于维持生殖细胞基因组稳定、减少生殖细胞凋亡、促进生殖细胞增殖和多能性表达以调节原始生殖细胞发育形成卵巢储备至关重要。其中,HR途径、FA途径和MMR途径的部分基因缺陷与POI发病有关。一些对POI遗传学病因机制的研究,已经鉴定出许多基因的变异与POI的基因组不稳定相关联[2,24,41],这些基因均参与DNA损伤修复反应,但其导致POI发病的具体风险还不清楚。DNA损伤修复机制的相关研究对于深入探讨POI的发病机制、早期发现潜在POI患者、筛查家庭性DNA修复相关疾病并制定长期管理方案具有重要意义。

