NaBr-CaBr2-H2O和KBr-CaBr2-H2O三元体系273.15 K相平衡实验及计算
张学平,崔瑞芝,桑世华
(1 成都理工大学材料与化学化工学院,四川成都 610059;2 四川文理学院化学化工学院,四川达州 635000;3 中国科学院青海盐湖研究所,中国科学院盐湖资源综合高效利用重点实验室,青海西宁 810008)
引言
在自然界中,水盐体系不仅广泛存在于海水和盐湖水中,还包含于四川盆地的地下卤水当中。四川盆地地下卤水具有分布广泛、资源丰富、品质优异的特征,构成我国重要的优势液态矿产资源。卤水中除含有大量的Na+外,还含有Li+、K+、Ca2+、Sr2+、Br-、I-等多种有用组分,因而成为重要的化工原料水[1]。特别是溴,为强分散性稀有元素,其在自然界当中不存在独立的矿物,分布于油气田地下卤水、盐湖卤水和海水当中,因而其来源依赖于液态矿产资源的开发。溴作为重要的化工原料,在阻燃剂、灭火剂、制冷剂、感光材料、医药、农药、油田等行业有广泛用途,是我国紧缺物资。因此,充分发挥四川盆地地下卤水溴资源特点,提高卤水溴资源综合利用水平对国民经济具有非常重要的意义[2]。
盐湖卤水资源开采主要采用相分离和萃取的方法,其无机盐提取工艺的开发离不开水盐体系相图[3]。同时,水盐体系相图可以用于确定无机盐的相分离条件和卤水资源回收技术,它也是综合开发利用各类盐湖和地下卤水资源的理论依据。因此,为了开发四川盆地地下卤水溴资源,研究含溴体系的水盐体系的相平衡具有重要意义。
对于含溴水盐体系相平衡,国内外学者从相平衡实验和溶解度模拟方面对其展开了广泛的研究,主要集中在Na-K-Mg-Ca-Br-SO4和Na-K-Mg-Sr-Br 体系及其子体系的研究。Christov[4-5]利用文献中可获得的盐矿物的实验溶解度数据构建化学模型,运用于多组分体系Na-K-Ca-Br-SO4和Na-KMg-Ca-Br 从低浓度到高浓度在0~100℃温度范围内的固液相平衡的计算。Meng 等[6-8]报道了三元体系NaBr-CaBr2-H2O 在288.15 K 和348 K 下,KBr-CaBr2-H2O 在348 K 下以及四元体系NaBr-KBr-CaBr2-H2O 在323 K 下的相平衡研究。Kartzmark[9]测定了InBr3-NaBr-H2O 体系25℃下的溶解度,证明溴化铟在该三元体系的固相中不形成结晶水合物,这与溴化铟在二元体系中会形成结晶水合物明显不同。Donchev 等[10]测定了NH4Br-CaBr2-H2O 体系25 和50℃下的溴矿溶解度,发现水合溴化钙在两个温度下的结晶区都很狭窄。Chernykh 等[11]测定了溴化锂、溴化钠和溴化铯分别在溴化铜的三元水溶体体系中25℃下的等温溶解度,发现溴化铜与溴化锂和溴化铯形成复盐,而不与溴化钠形成复盐。Gusev 等[12]通过等温饱和法测定了25℃下CuBr2-NR4Br-H2O(R=Me,Et,n-Bu)三元体系中的溶解度,发现四烷基铵盐的缔合和水盐体系中铜(Ⅱ)配合物的形成。本课题组[13]对CaBr2-SrBr2-H2O 三元体系的0、25 和50℃多温相平衡研究结果表明,该体系为简单共饱和型,固相中未形成任何复盐或固溶体。
四川盆地的伴生成矿带的地下卤水大部分都产于地下的50~3000 m 深处的卤水层中,其地下卤水的温度范围为289.3~357.2 K[14]。在实际开采过程中,随着卤水从地底下抽出,温度和压力逐渐降低。而利用多温相图,可以确定无机盐的最佳生产工艺[15]。因此,对不同温度下的水盐体系进行相平衡研究对卤水开发具有实际的指导意义。本文采用等温溶解平衡法对两个三元体系NaBr-CaBr2-H2O和KBr-CaBr2-H2O 在273.15 K 时的相平衡进行实验测定及溶解度模拟,绘制了实验相图,并与计算溶解度图进行对比。研究能够为含溴水盐体系溶解度研究提供基础数据,从而为四川盆地地下卤水溴资源的提取开发提供理论指导。
1 实 验
1.1 实验药品与仪器
NaBr(分析纯,质量分数99%)、KBr(分析纯,质量分数99%)、CaBr2·xH2O(分析纯,质量分数98%)等,阿拉丁试剂有限公司。超纯水(电阻率>18 MΩ·cm),由UPT-11-40L 型纯水仪(成都优普仪器有限公司)制备。
FA1104N 型电子天平(1 级标准校正),上海菁海仪器有限公司;HXC-500-8A 型低温恒温磁力搅拌器(温度精度±0.1 K),常州金坛精达仪器有限公司;101-2AB 型电热鼓风干燥器,天津泰斯特仪器有限公司;D8 ADVANCE 型布鲁克X 射线粉晶衍射仪,上海皆准仪器设备有限公司;5300V 型ICP-OES(电感耦合等离子体发射光谱仪),PerkinElmer 公司(德国)。
1.2 实验方法
1.3 分析方法
Br-含量采用AgNO3容量法,以铬酸钾作为指示剂,不确定度为0.3%;Ca2+含量采用EDTA 络合滴定法,以氯化铵-氨水作为缓冲溶液,pH=10,以铬黑T作为指示剂,不确定度为0.3%;Na+含量采用离子平衡差减法确定,并采用ICP-OES 进行验证,不确定度为0.5%;K+含量采用四苯硼钠返滴定法进行测定,不确定度为0.5%。每组样品进行三次平行实验,其误差不超过0.5%。
2 实验结果与讨论
2.1 三元体系NaBr-CaBr2-H2O
三元体系NaBr-CaBr2-H2O 273.15 K 相平衡数据列于表1 中。图1 为该三元体系273.15 K 时的相图。由图1可见,该三元体系相图为水合物型相图,无复盐和固溶体形成。相图中有一个共饱点E,饱和固相为NaBr·2H2O 和CaBr2·6H2O。共饱点E的液相组成[以质量分数w(b)表示]为w(CaBr2)=53.82%,w(NaBr)=1.56%。两条单变量溶解曲线AE和BE对应的饱和固相分别为NaBr·2H2O 和CaBr2·6H2O。从图1可以看出,由于同离子效应的存在,溴化钙对溴化钠有明显的盐析作用,其在固相结晶区上表现为:NaBr·2H2O 的结晶区ACE远大于CaBr2·6H2O 的结晶区BDE。即在273.15 K 等温蒸发过程中,NaBr·2H2O 更容易从不饱和液相中析出而得到分离。在溶解度曲线AE上,溴化钠的溶解度随溴化钙含量的增加不断减小,在共饱点E点达到最小值,其质量分数为1.56%。图2 为三元体系在273.15 K 下的共饱点E点的XRD 图,由图可知,共饱点E点对应的平衡固相为NaBr·2H2O 和CaBr2·6H2O,与湿渣法结果一致。
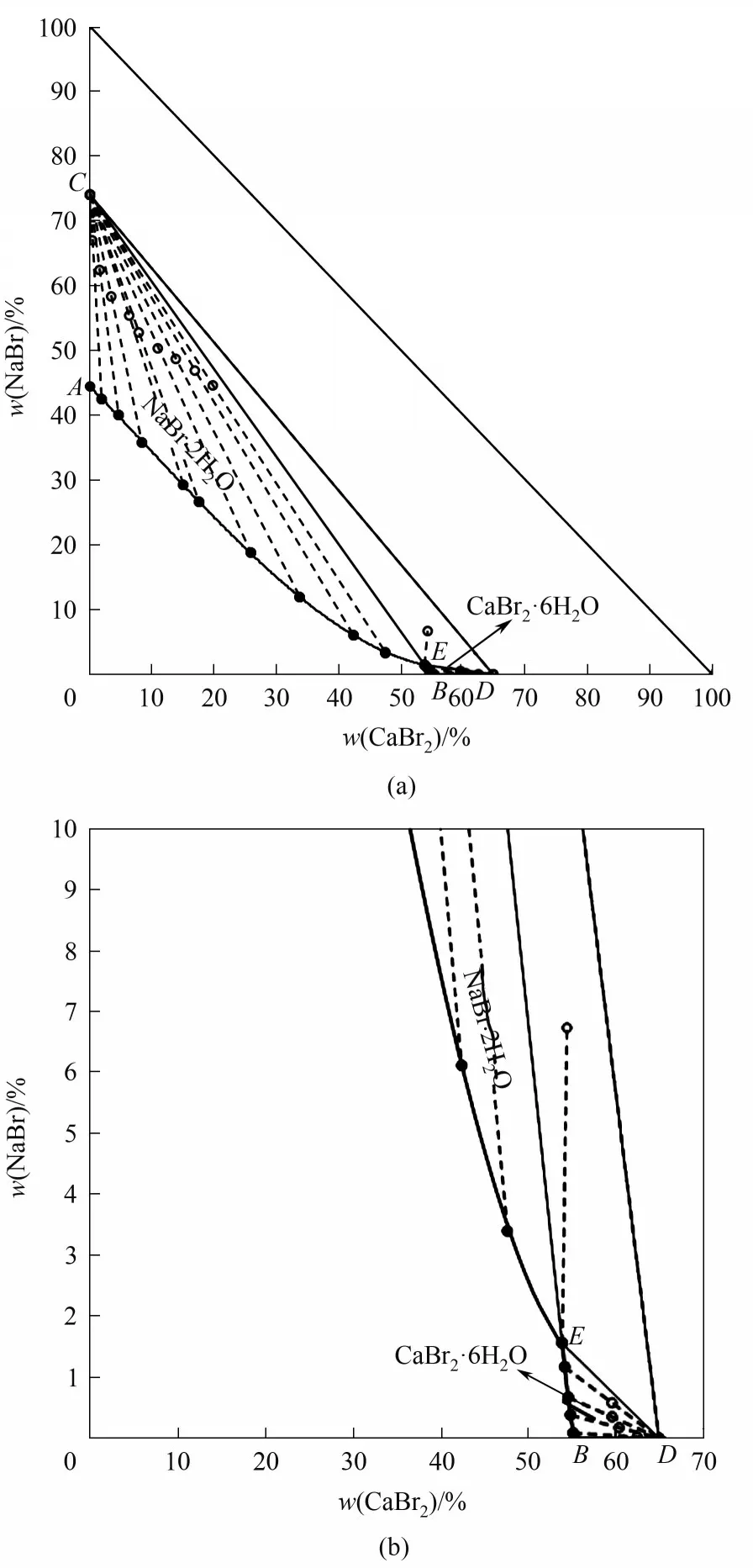
图1 三元体系NaBr-CaBr2-H2O在273.15 K下的相图(a)及局部放大图(b)Fig.1 Phase diagram of ternary system NaBr-CaBr2-H2O at 273.15 K(a)and partial enlarged diagram(b)
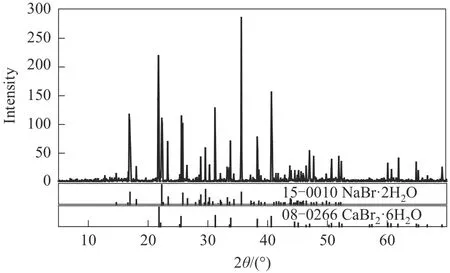
图2 三元体系NaBr-CaBr2-H2O在273.15 K下的共饱点E(NaBr·2H2O+CaBr2·6H2O)的XRD图Fig.2 XRD patterns of solid phases(NaBr·2H2O+CaBr2·6H2O)at the invariant point E of the ternary system NaBr-CaBr2-H2O at 273.15 K
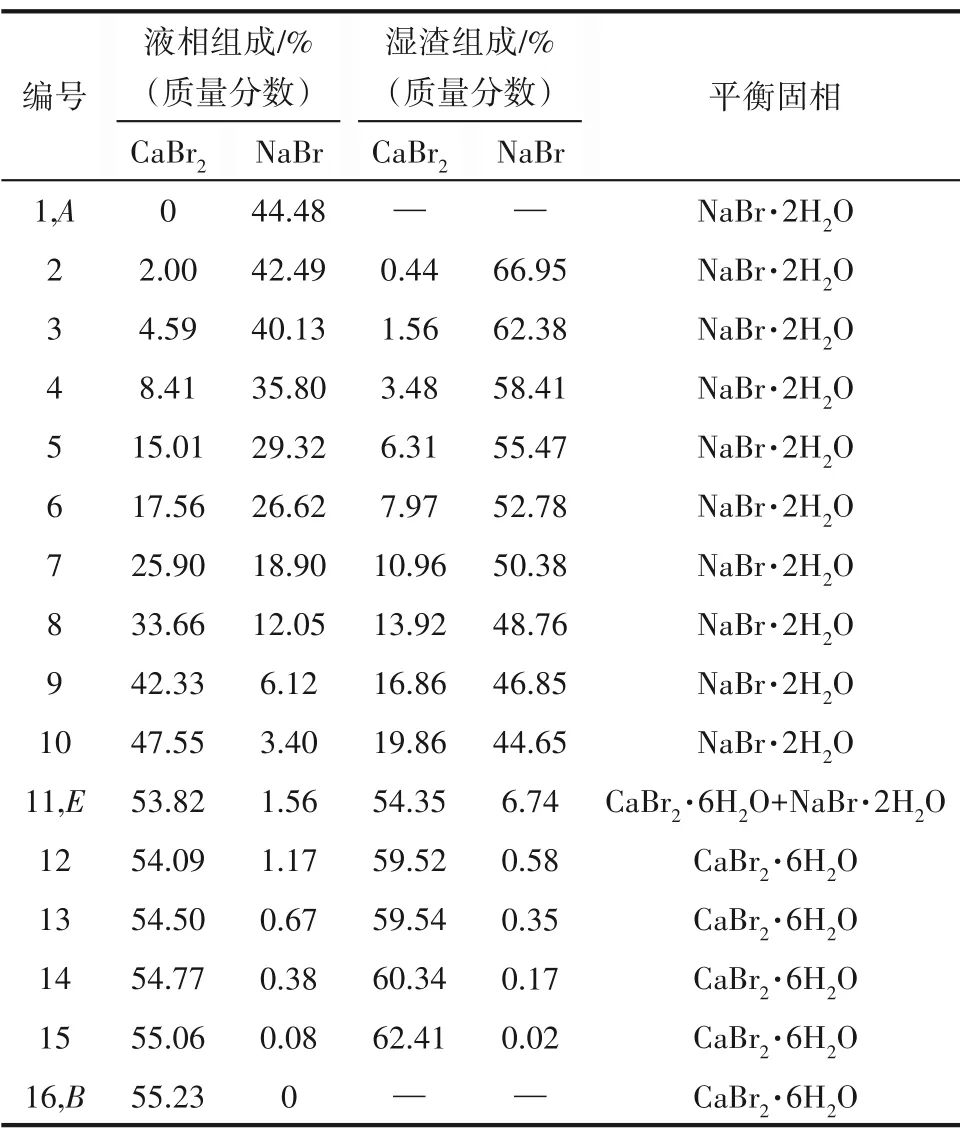
表1 三元体系NaBr-CaBr2-H2O在273.15 K下的溶解度数据Table 1 Solubility data of ternary system NaBr-CaBr2-H2O at 273.15 K
2.2 三元体系KBr-CaBr2-H2O
三元体系KBr-CaBr2-H2O 273.15 K 相平衡数据列于表2中。图3为该三元体系273.15 K时的相图。结果表明,该三元体系相图为水合物型相图,其平衡固相中无复盐和固溶体形成。该三元体系有一个共饱点E,其液相组成为w(CaBr2)=54.27%,w(KBr)=0.79%,对应的平衡固相为CaBr2·6H2O 和KBr。两条单变量曲线,分别为KBr 的溶解度曲线AE和CaBr2·6H2O 的溶解度曲线BE。从图3 可以看出,溴化钙对溴化钾表现出明显的盐析作用。在溶解度曲线AE上,溴化钾的溶解度随溴化钙含量的增加不断减小,在E点为最小值0.79%。两个结晶区,分别为KBr 的结晶区ACE和CaBr2·6H2O 的结晶区BDE。其中KBr 的结晶区远大于CaBr2·6H2O 的结晶区,说明溴化钙的溶解度大于溴化钾。图4为三元体系共饱点E点的XRD 图,通过与标准卡片对比发现,其结晶固相为CaBr2·6H2O 和KBr,与湿渣法结果 相对应。
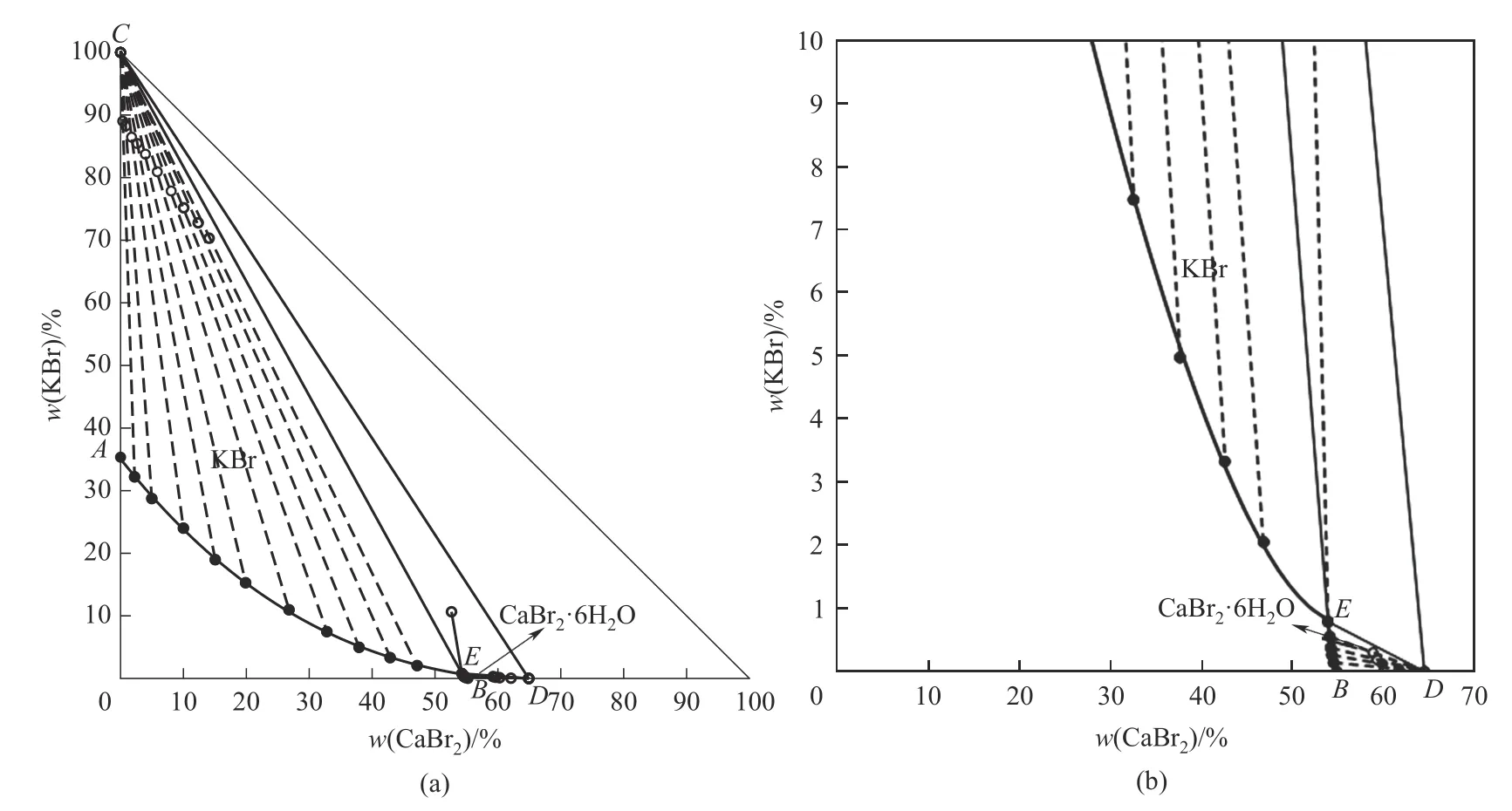
图3 三元体系KBr-CaBr2-H2O在273.15 K下的相图(a)及局部放大图(b)Fig.3 Phase diagram of ternary system KBr-CaBr2-H2O at 273.15 K(a)and partial enlarged diagram(b)
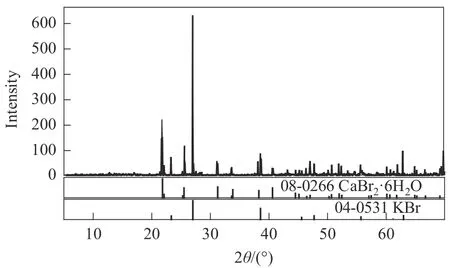
图4 三元体系KBr-CaBr2-H2O在273.15 K下的共饱点E(CaBr2·6H2O+KBr)的XRD图Fig.4 XRD patterns of solid phases(CaBr2·6H2O+KBr)at the invariant point E of the ternary system KBr-CaBr2-H2O at 273.15 K
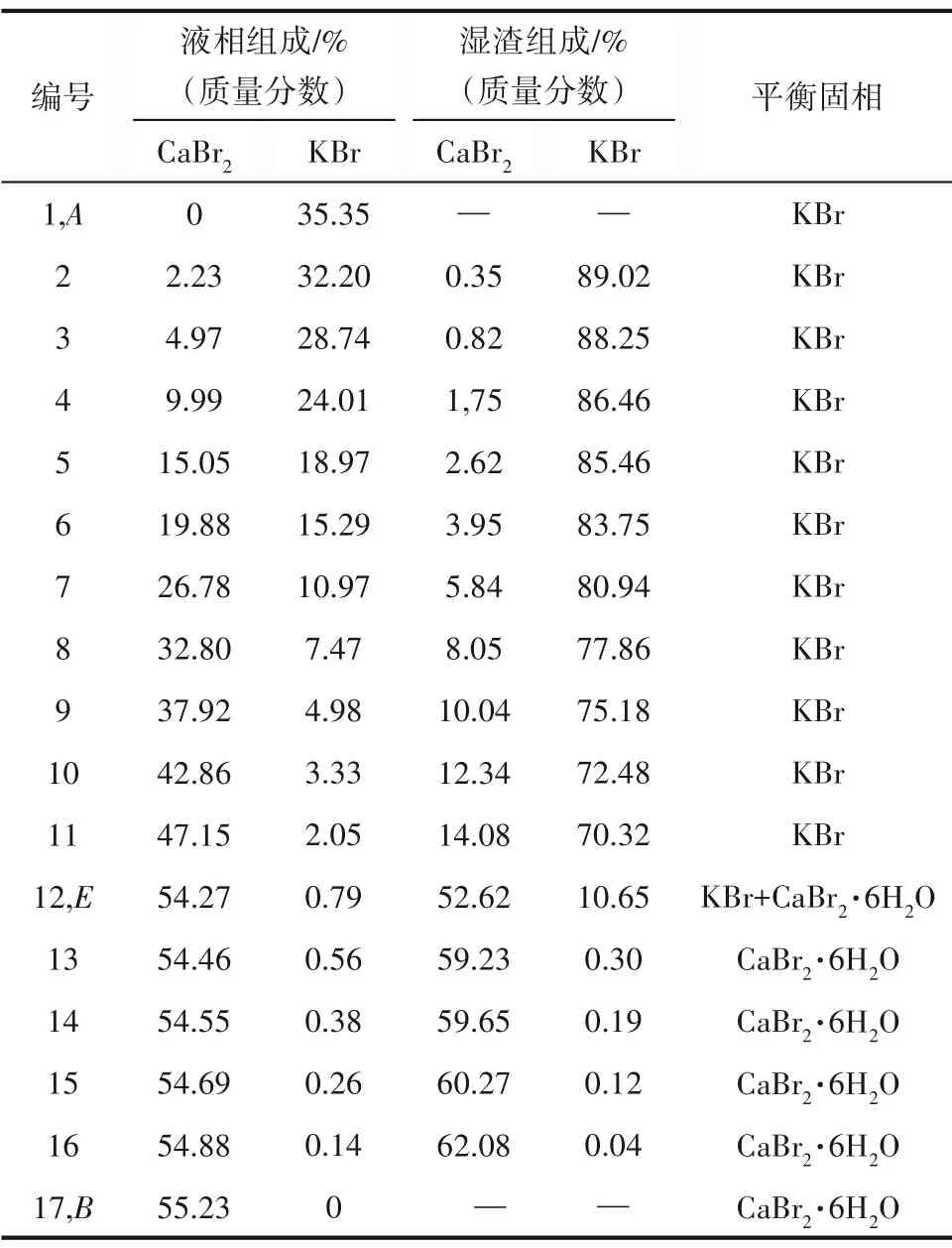
表2 三元体系KBr-CaBr2-H2O在273.15 K下的溶解度数据Table 2 Solubility data of ternary system KBr-CaBr2-H2O at 273.15 K
2.3 对比与讨论
组成三元体系NaBr-CaBr2-H2O 和KBr-CaBr2-H2O 的二元体系在273.15 K 的共饱点对比数据见表3。通过将二元体系的共饱点实验值与文献值进行比较,发现数据基本一致,表明本文的溶解度数据是可靠的。三元体系NaBr-CaBr2-H2O 和KBr-CaBr2-H2O 不同温度下的共饱点对比分别见表4 和表5。对比结果表明,溴化钙在两个体系中相同温度下的结晶形式相同,在298.15 K 及以下为CaBr2·6H2O,323.15 K 下为CaBr2·4H2O,348.15 K 下为CaBr2·2H2O。在三元体系NaBr-CaBr2-H2O 中,NaBr·2H2O在273.15 K时可在饱和浓度下稳定存在,而在288.15和298.15 K 条件下,液相中高浓度的溴化钙会使其脱水而转变为NaBr。但是,在323.15 和348.15 K 条件下,该三元体系的平衡固相中不存在NaBr·2H2O晶体,NaBr 结晶物在整个浓度范围内广泛存在。在三元体系KBr-CaBr2-H2O 中,溴化钾始终以无水盐的结晶形式广泛存在于273.15~348.15 K 温度范围内。

表3 273.15 K下的二元共饱点数据对比Table 3 Invariant point data of binary system at 273.15 K
表4 三元体系NaBr-CaBr2-H2O不同温度下的共饱点对比Table 4 Invariant points of ternary system NaBr-CaBr2-H2O at different temperatures

表5 三元体系KBr-CaBr2-H2O不同温度下的共饱点对比Table 5 Invariant points of ternary system KBr-CaBr2-H2O at different temperatures
3 溶解度计算
Pitzer 模型可以广泛地运用于水盐体系溶解度的预测[21-23]。本文基于Harvie 等[24]在Pitzer 模型[25]基础上整理得到的HW 公式对NaBr-CaBr2-H2O 和KBr-CaBr2-H2O 三元体系进行273.15 K 条件下的溶解度计算。以NaBr-CaBr2-H2O 三元体系为例,其计算的活度系数和渗透系数表达式如下:

对于1-1 或2-1 型电解质其需要的单盐参数(β0,β1,Cφ)如表6 所示、混合离子的相互作用参数(θ,Ψ)如表7 所示,盐的稳定溶解平衡常数(lnKa)如表8所示。选用粒子群算法对溶解度数据进行理论计算,三元体系NaBr-CaBr2-H2O 和KBr-CaBr2-H2O在273.15 K 的实验和理论计算溶解度数据分别见表9 和表10,绘制了273.15 K 条件下三元体系NaBr-CaBr2-H2O 和KBr-CaBr2-H2O 的实验和理论计算溶解度对比图,分别见图5 和图6。结果表明,计算溶解度和实验溶解度比较吻合,计算和实验溶解度曲线趋势基本相同。
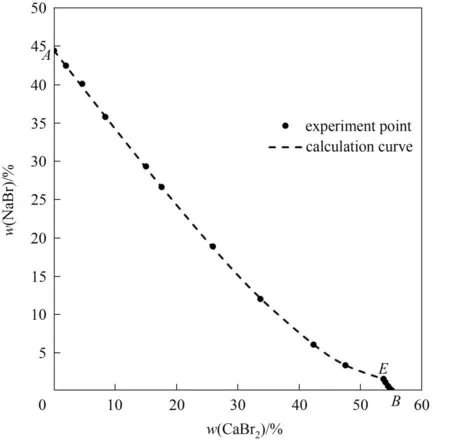
图5 三元体系NaBr-CaBr2-H2O在273.15 K下的计算与实验溶解度Fig.5 Solubility of calculation and experiment in the ternary system NaBr-CaBr2-H2O at 273.15 K
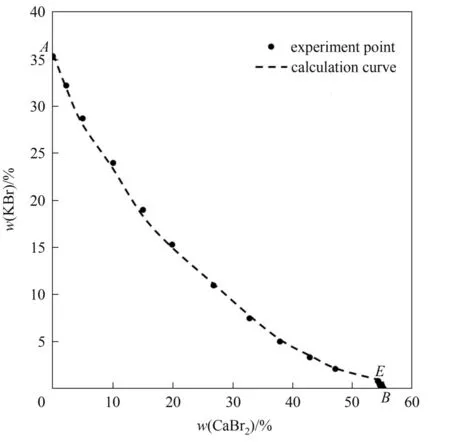
图6 三元体系KBr-CaBr2-H2O在273.15 K下的计算与实验溶解度Fig.6 Solubility of calculation and experiment in the ternary system KBr-CaBr2-H2O at 273.15 K
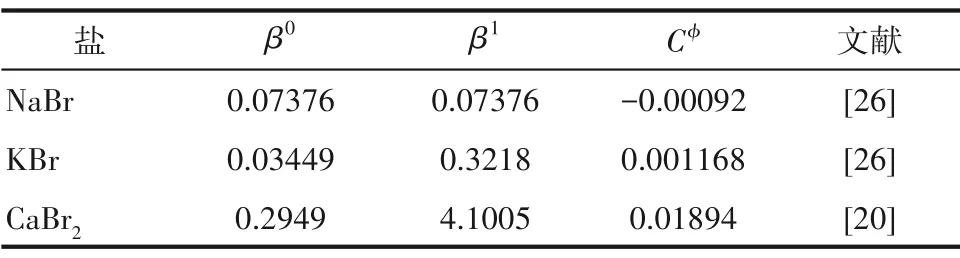
表6 273.15 K下Pitzer单盐参数值Table 6 The values of Pitzer parameter for single salt at 273.15 K
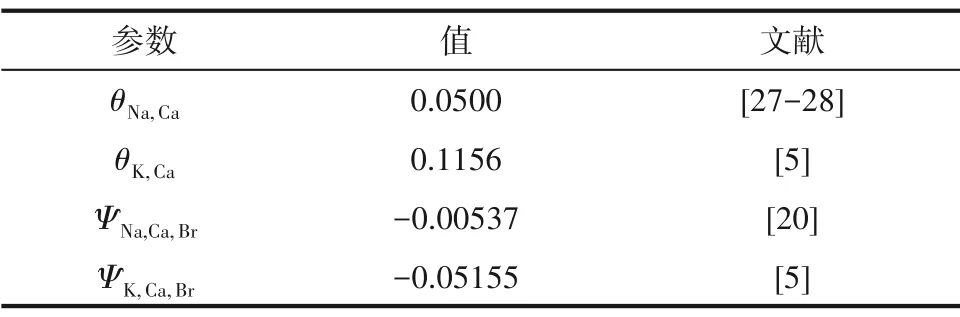
表7 273.15 K下的Pitzer 混合离子相互作用参数值Table 7 The values of Pitzer parameter for mixed ions interaction at 273.15 K
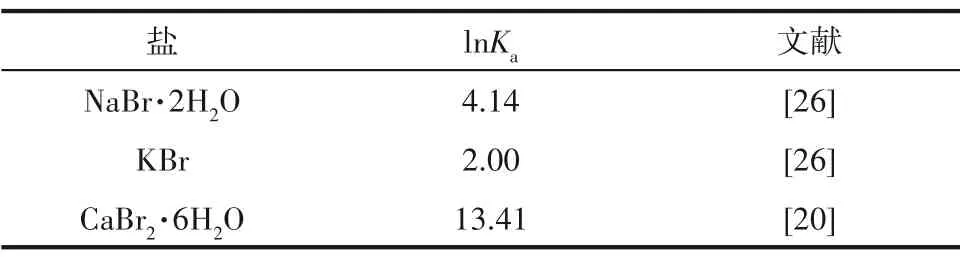
表8 273.15 K下盐的稳定溶解平衡常数值Table 8 The values of stable dissolution equilibrium constants for salts at 273.15 K
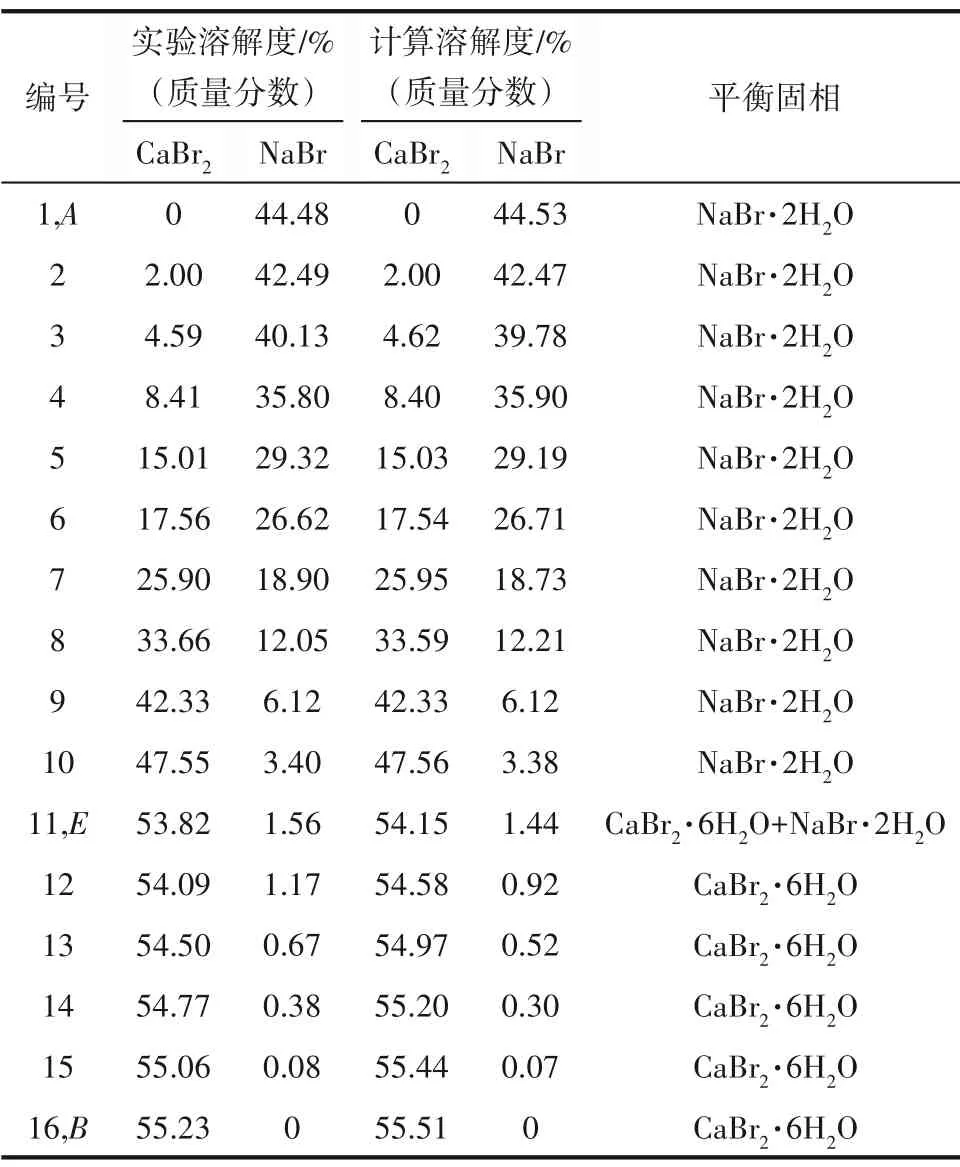
表9 三元体系NaBr-CaBr2-H2O在273.15 K下的实验和计算溶解度Table 9 The experimental and calculated solubility in the ternary system NaBr-CaBr2-H2O at 273.15 K
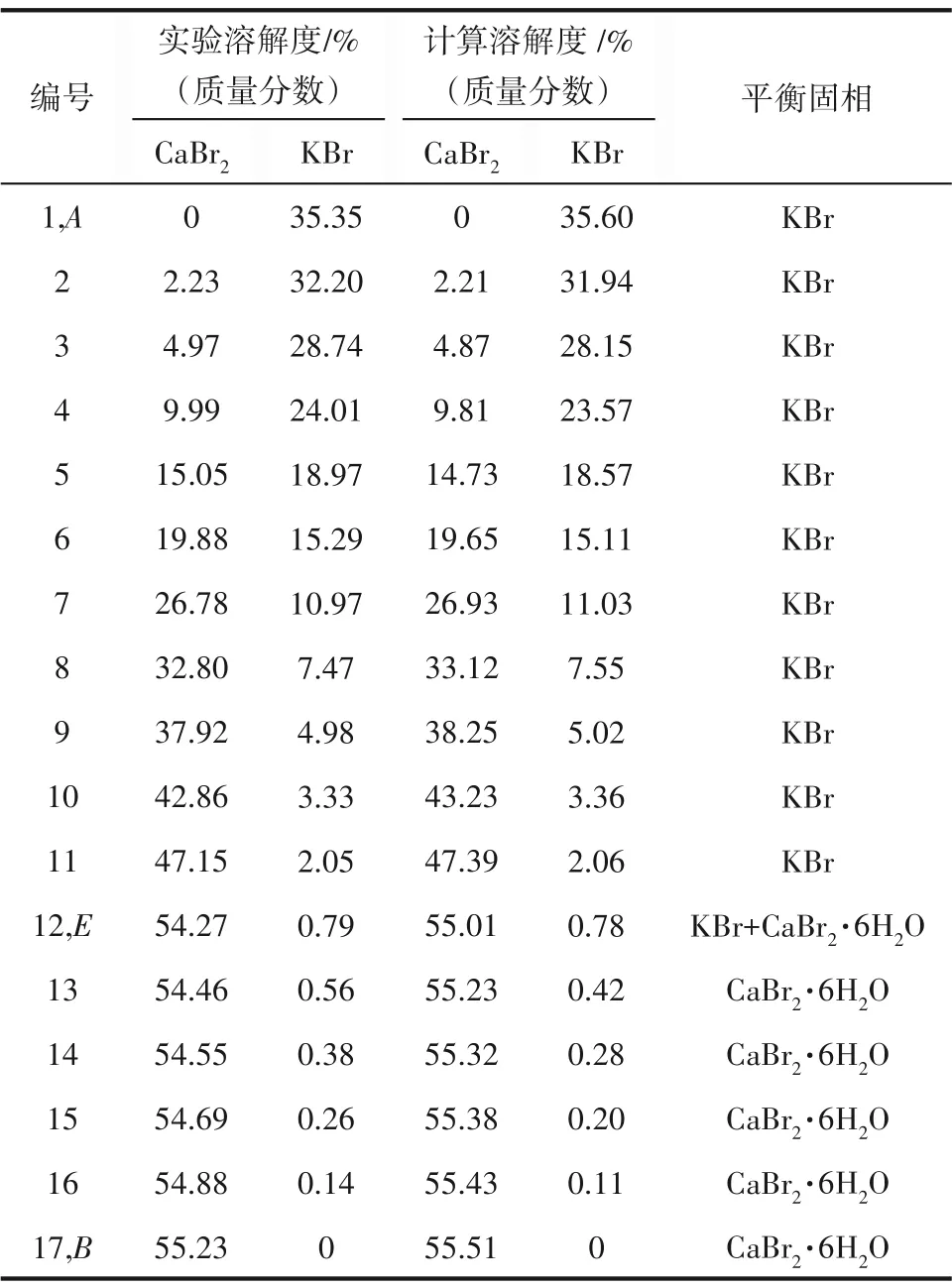
表10 三元体系KBr-CaBr2-H2O在273.15 K下的实验和计算溶解度Table 10 The experimental and calculated solubility in the ternary system KBr-CaBr2-H2O at 273.15 K
4 结论
采用等温溶解平衡法,研究了两个三元体系NaBr-CaBr2-H2O 和KBr-CaBr2-H2O 在273.15 K 时的等温固液相平衡,根据实验数据绘制了等温相图。确定了两个三元体系共饱点的液相组成和对应的平衡固相的结晶形式。两个三元体系均属于简单体系,其固相中无复盐和固溶体生成,相图中均含有一个共饱点、两条单变量溶解度曲线和两个单固相结晶区。在三元体系NaBr-CaBr2-H2O 和KBr-CaBr2-H2O 中,由于同离子效应,CaBr2对NaBr和KBr 均表现出明显的盐析作用。在文献报道的Pitzer 参数基础上,运用Pitzer 模型对溶解度进行模拟计算,计算结果与实验结果吻合较好,表明该参数在预测所研究体系的溶解度上具有良好的适用性。
符号说明
Aφ——Debye-Hückel参数
在新的发展形势下,广播电视媒体与互联网思维的融合是必然趋势,在二者融合的过程中,要相互汲取对方的优势,两者都需要进行改革和创新,实现求同存异,相互发展、相互补充的目的。新媒体形式重视的是信息建设,节目的方式与广播电视媒体类似,但也拥有完善的与用户互动的方法。而广播电视更加重视在信息方面的传播。所以,在广播电视与互联网媒体的融合中,就要借助新媒体的互动方法、广播电视的信息传播价值,为用户带来更好的信息接收体验和感受。
B——第二维里系数
I——离子强度,mol·kg-1
K——溶质的溶解平衡常数
m——溶液中溶质的浓度,mol·kg-1
Z——离子价态
β0,β1,Cφ——Pitzer单盐参数
γ——溶液中溶质的活度系数
θ——Pitzer二离子作用参数
Ф,ФФ——第二维里系数
φ——溶液中溶剂的渗透系数
Ψ——Pitzer三离子作用参数

