保留功能的胰腺肿瘤微创手术初步经验
吴嘉,韩方,张宇华,陈益臻,徐有耀,徐林伟
(中国科学院大学附属肿瘤医院/浙江省肿瘤医院 肝胆胰外科,浙江 杭州 310022)
胰腺良性或低度恶性肿瘤的传统治疗方案为手术切除,如肿瘤位于胰头部需行胰十二指肠切除,如肿瘤位于胰腺体尾部则需行胰体尾联合脾脏切除。虽然与恶性肿瘤的预后截然不同,但由于一同切除了其周围脏器,故对患者的远期生活质量造成了一定的影响。近年来,由于对局部解剖认识的加深,手术技术的进步和手术器械的革新,保留功能的胰腺肿瘤手术被提出并逐步开展[1]。Beger等[2]于1990年报道了在慢性胰腺炎和胰腺囊性疾病中应用保留十二指肠的胰头切除术。Zhou等[3]在2016年报道了腹腔镜保留十二指肠的胰头切除术。笔者所在团队自2016年开始使用腹腔镜和达芬奇机器人开展保留功能的胰腺肿瘤切除术,随着经验积累,我们发现相对于传统开腹手术,微创技术下行保留功能的胰腺肿瘤切除术具有创伤小、术后恢复快的优点,现报道如下。
1 资料和方法
1.1 一般资料
自2020 年9 月至2021 年5 月,18 例胰腺肿瘤患者接受微创(包括机器人和腹腔镜手术)功能保留胰腺手术,其中男8例,女10例;平均年龄(48.4±12.3)岁。4例因腹痛、发热等症状入院检查发现胰腺病灶,14例为年度体检或其他疾病检查过程中通过腹部B超或CT检查发现。术前均完成三大常规、生化、肿瘤标志物、凝血功能、术前传染病监测等常规检查,同时根据病情诊断需要开展全腹增强CT或MRI、MRCP、超声内镜等检查。
1.2 手术方式
通过术前肿瘤标志物及影像学检查来决定是否行保留功能的微创胰腺手术,根据肿瘤所在位置决定手术方式:(1)位于胰头部的采用保留十二指肠的胰头次全切除术;(2)位于胰腺颈部的采用胰腺中段切除术;(3)位于胰体尾部的采用保留脾脏的胰体尾切除术;(4)对于与主胰管有一定距离的胰腺病损采用局部切除;(5)对于胆总管下端癌和十二指肠乳头癌可采用保留幽门的胰十二指肠切除术;(6)对于累及胰头及胰体尾部的病变采用保留十二指肠及脾脏的全胰切除术。所有病例在标本切除后均采用术中快速冰冻明确诊断,如证实为非良性或非低度恶性肿瘤则按照恶性肿瘤治疗原则更改手术方案。
1.3 观察指标
手术时间、术中出血量、术后并发症、术后住院时间、新发糖尿病情况、外分泌功能需替代治疗。并发症定义采用国际胰腺外科研究组(ISGPS)制订的诊断标准[4-5]。
1.4 术后处理
术后予预防性使用抗生素、生长抑素或奥曲肽类药物抑制胰酶分泌、抑制胃酸、营养支持、补液等对症支持处理。术后第1、3、5、7天监测腹腔引流管淀粉酶情况。术后1周复查全腹增强CT观察腹腔情况。
2 结果
2.1 手术情况
18例患者均成功接受微创条件下的保留功能胰腺手术,其中应用机器人平台进行手术1例,应用腹腔镜平台进行手术17例,包括腹腔镜保留十二指肠胰头次全切除术、腹腔镜胰腺中段切除术、腹腔镜保留十二指肠及脾脏的全胰切除术(图1)等多种高难度保留功能的微创胰腺手术,手术时间(214.7±85.3)min,术中出血量为(205.3±114.6)mL,术后住院时间(14.2±8.7)d,各术式具体数据详见表1。
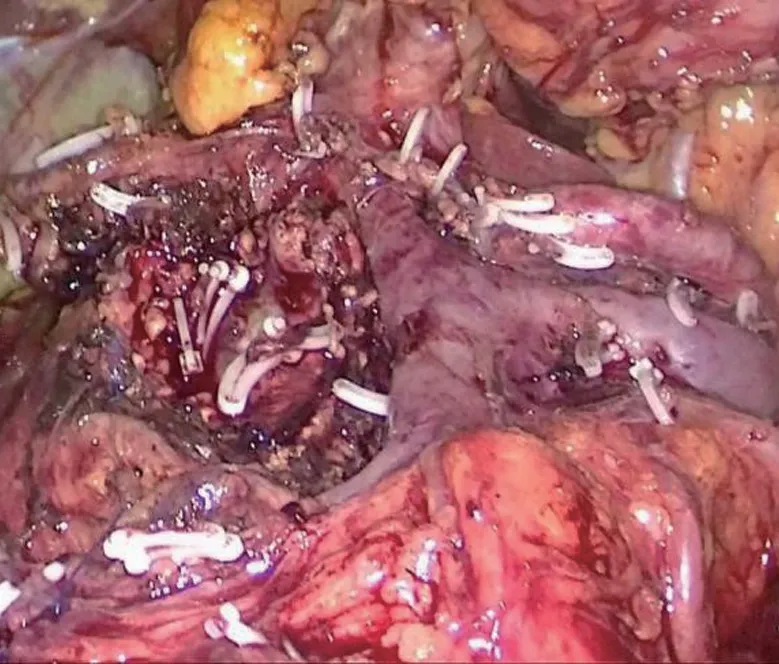
图1 腹腔镜保留十二指肠及脾脏的全胰切除术
2.2 术后情况
术后病理结果:浆液性囊腺瘤3例,黏液性囊腺瘤4例,混合型IPMN 1例,主胰管型IPMN 5例,神经内分泌肿瘤3例,实性假乳头状瘤2例。
术后并发症:胰瘘(ISGPS定义,B+C级)10例(55.6%),术后出血1例(5.6%),胃排空障碍2例(11.1%),除1例保留十二指肠及脾脏的全胰切除手术外,其余病例均无新发糖尿病和术后需外分泌替代治疗的情况。详见表1。
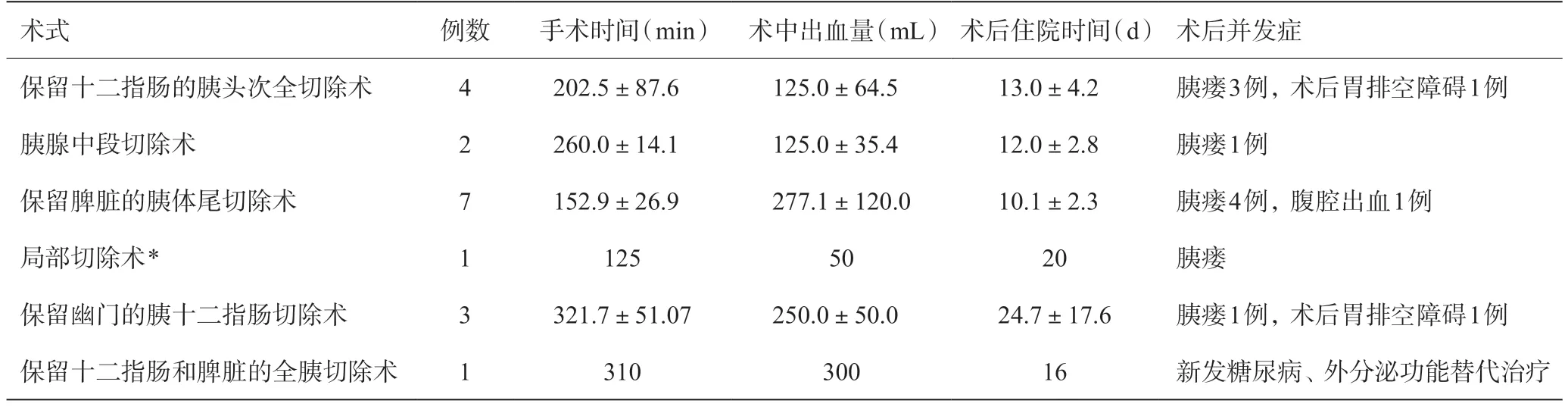
表1 保留功能的胰腺微创手术情况及术后并发症情况
3 讨论
我中心近1年内对18例良性和低度恶性的胰腺肿瘤实施保留功能的微创治疗。在功能保留方面,除1例保留十二指肠及脾脏的全胰切除手术外,其余患者均无新发糖尿病及术后需要外分泌替代治疗。并发症方面,文献报道行胰腺手术的总体胰瘘发生率在2%~20%之间[6-8],而本组资料中胰瘘(10/18)发生率超过50%,其中B级9 例,C级1 例。9 例B级胰瘘患者中8例是因留置腹腔引流管时长超过3周而判定,1例是因为腹腔积液并发感染行超声引导下穿刺置管引流管而判定。由于保留功能的手术过程中的特殊性,如行保留十二指肠胰头切除需要保留十二指肠周围及胆管周边的胰腺组织,以免损伤胰头前后方的血管弓导致十二指肠和胆总管的缺血,而这部分胰腺组织不与消化道进行吻合,所以必然会有胰瘘的产生;而对于局部切除的病例来说必然有生化漏的发生,如果涉及到主胰管损伤,引流量更大,引流管带管时间势必延长,因此增加了判定为B级胰瘘的比例。本组8例患者均在术后3周内带管出院,出院后无发热、腹痛等异常表现,3周后待引流量逐渐减少,复查腹部增强CT确认无积液情况下,通过逐步撤退引流管来达到窦道愈合的效果。
胰腺疾病涉及到良性和交界性的肿瘤性病变,术式涵盖了胰头、胰腺中段、胰腺体尾部等多个部位,尽管开展的病例数不多,但是我中心2016年已经开始开展腹腔镜保留脾脏的胰体尾切除术,在积累经验的基础上,今年连续开展了多种微创保留功能胰腺手术,体会如下。
3.1 腹腔镜保留十二指肠的胰头切除术
该技术最早由德国Beger教授在1972年创立[9],主要用于治疗胰头部良性疾病,如慢性胰腺炎,以及胰头部的良性及低度恶性肿瘤。在10 年前,国内学者已经在开放手术下开展这项技术[10-11]。该技术的要点为保留十二指肠的血管弓,十二指肠的血管弓可分为前弓和后弓,分别由胰十二指肠上动脉(SPDA)和胰十二指肠下动脉(IPDA)的分支汇合构成,其中由后弓分支还发出供应胆总管下端及十二指肠乳头的滋养血管(详见图2)。准确识别血管弓是防止损伤的关键,在前后弓附近,仅切断血管弓发往胰头的小分支,保留通往十二指肠的分支。在胆总管附近剥离胰腺组织时如不慎对胆管壁造成非穿透性热损伤,可以考虑留置T管。如十二指肠存在明显的缺血情况,需要改行胰十二指肠切除术。目前也有学者利用ICG荧光染色技术在术中显示胆总管,从而避免在剥离胆总管周边胰腺组织时损伤到胆总管[12];同时在切除胰头肿瘤后可以通过ICG的染色来观察十二指肠的血供情况[13]。
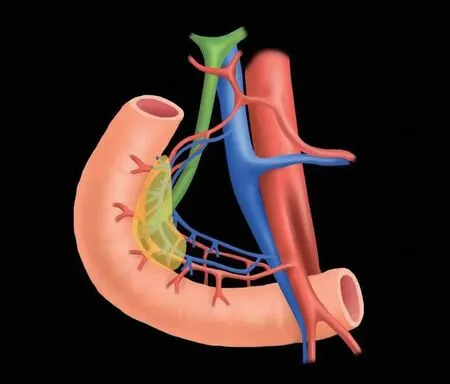
图2 理想状态下保留十二指肠的胰头切除术后的局部情况:前后弓发往胰头的分支均被切断,发往十二指肠的分支均保留,胆总管下端部分胰腺组织保留,胰十二指肠后下动脉(PSPDA)发出的乳头动脉完整保留。
3.2 腹腔镜胰腺中段切除术
该手术是所有功能保留手术中难度较大的手术,文献报道胰腺中段切除术后的胰瘘发生率多高于传统术式,最高为62%,平均可达27%[14-16]。我们分析主要原因是需要两次离断胰腺,两个断端都容易发生胰瘘,且远端胰腺因胰管较细,实施导管对黏膜的胰肠吻合难度较大,因此发生胰瘘的几率较大。在处理胰腺远端残端时,有学者认为胰胃吻合术后胰瘘发生率低[17]。但也有研究发现胰胃吻合术和胰肠吻合术在术后发生胰瘘方面并无差异[18]。也有少部分学者通过所谓“三明治技术”来完成胰腺两个断端的双吻合技术来完成消化道重建[19]。我们认为,只有选择自己熟悉的胰肠吻合方式才能减少术后胰瘘发生率。关于近端残胰的处理,将在保留脾脏的胰体尾切除段落中讨论。
3.3 腹腔镜保留脾脏胰体尾切除术
腹腔镜保留脾脏胰体尾切除术可以被认为是一种微创保留功能胰腺切除术的入门手术。该手术可以分为Kimura法和Warshaw法,本组7 例患者均采用Kimura法完成手术。与Warshaw法不同,Kimura法仅离断脾脏血管与胰腺的穿支血管,最大程度地保留了脾脏的血供,相比Warshaw法可以明显减少脾脏梗死发生的几率。周尊强等[20]研究发现,与Warshaw法相比,Kimura法不仅减少了术后脾梗死的发生率,也缩短了术后脾梗死的恢复时间。腹腔镜下行该手术的优点是对于胰腺后方的穿支血管的辨别更加清楚,可以逐个夹闭。我们一般采用足侧视野下打开胰腺颈部下缘后腹膜,显露胰后隧道,切割闭合器离断胰腺颈部后向左侧继续打开后腹膜至胰尾部,分离胰腺与脾静脉的穿支并夹闭离断,而后将胰腺组织牵拉向足侧打开胰腺上缘后腹膜,向足侧牵拉远端胰腺的力量便于我们更加好地分离胰腺与脾动脉之间的细小分支。残胰的处理,我们曾尝试多种方法来进行处理,包括切割闭合器离断,超声刀离断后再使用Prolene线进行连续缝合关闭,也有联合应用闭合器离断后再行缝合加固。也曾尝试使用胰腺残端与大网膜缝合固定以促进胰腺残端愈合,但经过数例尝试发现,网膜在引流管区域容易导致引流管的堵塞。也有学者[21]尝试通过内镜下经十二指肠乳头放置胰管支架来预防胰体尾切除后胰瘘的问题,发现内镜下经十二指肠乳头放置胰管支架比胰周放置引流管临床有效率高(91%vs75%),同时可以明显减少住院时间,但该文献中涉及的病例仅11 例,由于ERCP水平的差异,该技术在不同中心的可推广性有限。目前我们通常通过增加引流管放置的方式来减少术后胰瘘导致的液体积聚,如通过左侧Trocar孔在残胰上缘放置带有线性沟槽的负压引流管,在残胰旁经右侧Trocar孔放置多孔引流管一根,通过这种多部位的引流来预防胰瘘发生时液体的积聚。
3.4 微创胰腺肿瘤的局部切除
对于一些良性或低度恶性的肿瘤来说,如果直径较小,远离主胰管可以考虑行腹腔镜或机器人局部切除术。但是局部切除术后胰瘘的高发生率确实是必须面对的问题。Jin等[22]回顾性对比了31 例机器人胰腺剜除术和25例开放胰腺剜除术,两组胰瘘发生率和并发症发生率差异无统计学意义(38.7%vs52.0%,P=0.32),但机器人组手术时间更短、术中出血更少。同样,Tian等[23]通过应用倾向配比评分(PSM)比较了各60 例的机器人和开放剜除术治疗直径小于2 cm的胰腺神经内分泌肿瘤结果显示两组胰瘘发生率无统计学差异(10%vs17%,P=0.28),Dindo-Clavien III~V级并发症发生率和术后住院时间无明显差别,但机器人组术中出血更少,手术时间更短。根据2019年发布的《机器人手术国际共识》[24],建议机器人胰腺剜除术一般适用于直径小于2 cm、距离主胰管至少2 mm的胰腺良性、交界性和低度恶性肿瘤。尤其对于处于学习曲线早期的学者来说,把握好机器人手术指征显得尤为重要。
对于有技术积累的胰腺中心来说,腹腔镜保留功能的胰腺手术可以作为良性和低度恶性肿瘤的首选治疗方式,但是胰瘘作为一个术后常见的并发症也更需要被重视,如何减少保留功能的胰腺手术后的胰瘘发生率是一个需要进一步研究的问题。在腹腔镜基础上,可以逐步开展达芬奇机器人手术,但是病例选择上需要由简到难,循序渐进。

