腹腔镜胰十二指肠切除术中转开腹的原因及处理方法
陈俊予,王海彪,乐乾尊,陈佰文,李宏
(宁波市医疗中心李惠利医院 肝胆胰外科,浙江 宁波 315000)
随着微创技术以及腹腔镜器械的不断发展,腹腔镜下胰十二指肠切除术(laparoscopic pancreaticoduodenectomy,LPD)应运而生。与开腹胰十二指肠切除术相比,LPD具有相当多的优势,比如术后恢复较快、住院时间较短等[1]。自1994 年Gagner等[2]首次报道LPD以来,经过20多年的发展,LPD逐渐在较大型的医院展开,但LPD具有较大的难度,对术者有着很高的要求。LPD过程中存在许多不确定因素,而这可能就会增加手术难度及危险性,及时中转开腹是有必要的。宁波市医疗中心李惠利医院2017年10月至2020年10月施行LPD 82例,有7例行中转开腹手术,现将中转开腹原因及处理方法总结分析如下。
1 临床资料
1.1 一般资料
82 例患者行LPD,所有LPD均由2 位经验丰富的主任医师主刀。其中75 例顺利完成LPD,另7 例中转开腹,中转率8.5%。7例中转开腹的患者中,男4例,女3例;年龄58~71岁。
1.2 胰十二指肠切除术手术方法
1.2.1 LPD的手术方法:全麻后,患者取仰卧位,常规消毒铺巾,取脐下正中切口约1 cm,放置气腹针,置腹压14 mmHg(1 mmHg=0.133 kPa),再进鞘管,探查腹腔无明显转移后,常规5孔法放置Trocar,打开胃结肠韧带,暴露胰腺钩突,进入胰腺后方,见肠系膜上静脉前方可安全通过,行胰十二指肠切除术。做十二指肠右侧Kocher切口,将十二指肠连同胰头向左侧翻起至下腔静脉前方,游离胃体中部、大弯及小弯侧,离断胃体中部。于胆囊管上水平离断肝总管及胆囊床,再于胰颈部离断胰腺,于屈氏韧带约15 cm处离断空肠,切除十二指肠,最后于钩突处离断,移除标本,放入标本袋。做绕脐部切口,长约5 cm,将标本取出,并送快速病理切片,病理结果提示切缘阴性后行Child式吻合,检查创面无明显出血后,常规放置腹腔引流管2根,关闭腹腔,结束手术。
1.2.2 中转开腹的手术方法:手术过程中如遇见腹腔镜下无法处理的情况,及时中转开腹,做上腹部肋缘下反L形切口,逐层进入腹腔后,妥善处理腹腔内情况后行胰十二指肠切除术。
1.3 结果
中转开腹手术总体情况:7例中转开腹行胰十二指肠切除术,手术时间4~10 h,术中出血量400~1 800 mL,术中输血量0~800 mL。术中发现肿块位于胰头部位6例,胆总管下段1例,术后病理证实胰腺恶性肿瘤6例,胆管下段肿瘤1例,肿块直径1.5~5.0 cm,术前进行新辅助化疗的2例。
中转开腹原因及处理方法:(1)3例为难以控制的大出血,其中2例为肠系膜上静脉及其分支出血,1例为门静脉出血,中转开腹经过缝扎及血管切除重建成功止血。(2)1例为肝动脉形成假性动脉瘤,中转开腹后切除。(3)3例为肿块与周围组织粘连明显,中转开腹后1例进行了联合血管切除重建,2例在仔细游离后将病灶与血管分离。见表1。
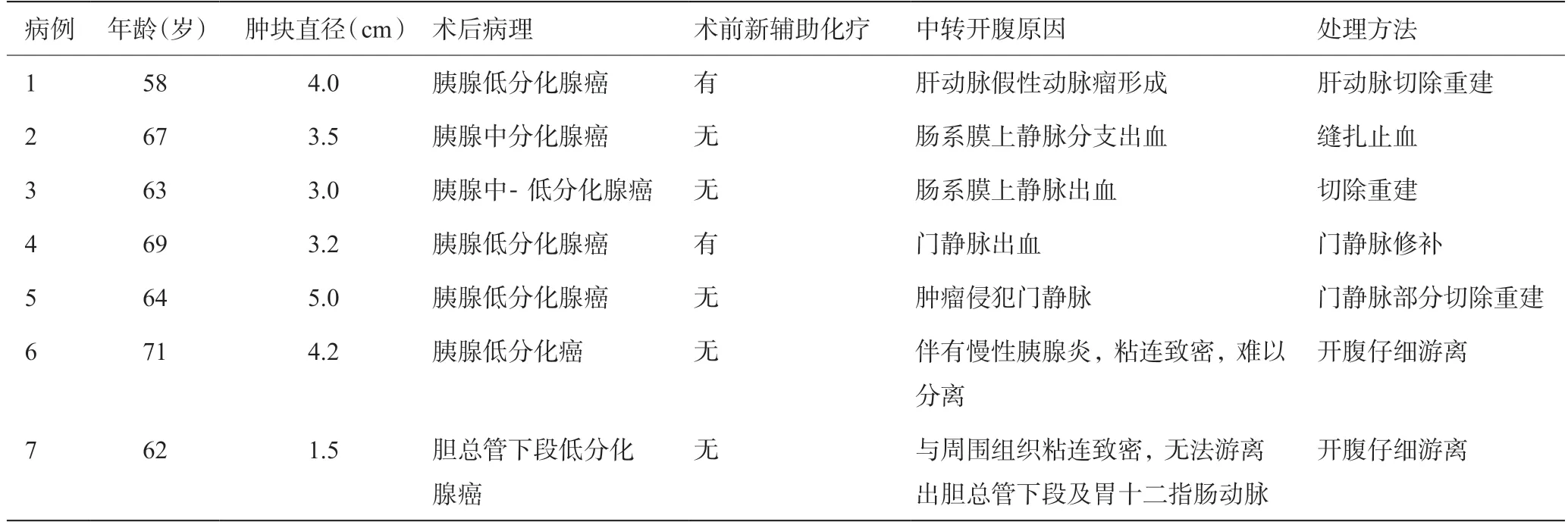
表1 LPD中转开腹患者临床资料及中转原因
2 讨论
LPD手术难度高、风险大、学习曲线长,有文献指出其学习曲线的峰值为40 例及104 例[13]。LPD手术过程中必要时应及时中转开腹,而术中难以控制的出血及粘连较重是中转开腹的主要原因。
2.1 术中难以控制的出血
胰十二指肠手术由于涉及的血管较多,术中出血的可能性较大。而LPD手术由于完全依赖于腔镜器械,术者无法灵活应用自己的双手,操作完全依赖于腔镜器械,更易导致止血不确切,增加出血风险[3]。本组中1例患者是在分离胆总管时不小心损伤肝动脉,术中及时发现,予5-0线缝合后未见明显出血,但在准备结束手术检查腹腔时发现肝动脉形成假性动脉瘤,考虑术后出血风险较大,遂中转开腹行肝动脉瘤切除+肝动脉重建术。有2例是在处理肠系膜上静脉周围时发生出血,出血量较大,腔镜下难以止血,中转开腹后1 例行肠系膜上静脉切除重建,1例在缝扎后止血。最后1例是由于术中损伤门静脉侧壁,出血汹涌,腔镜下难以快速找到出血点,予纱布填塞后迅速开放进腹,找到出血点后进行门静脉修补。通过上述病例,我们总结经验如下:(1)在清扫肝门周围淋巴结及分离胆总管时极易损伤肝动脉及其属支,损伤后即使成功缝合也可能因为损伤动脉从而形成假性动脉瘤,在结束手术之前应当再次检查。(2)对于胰腺钩突部位及胰头部汇入肠系膜上静脉及门静脉的小分支,在牵拉时应当轻柔,因为这些血管的血管壁较薄,一旦用力牵拉极有可能造成血管撕裂出血,且血管断裂后头部易回缩,回缩后出血汹涌,我们通常难以找到出血点,被迫中转开腹。对于此处血管,通常我们认为可不必完全分离,小的血管可直接用超声刀离断,较大的血管可以用Hem-o-lock夹闭。(3)本组2例患者在行新辅助化疗后进行手术,有文献指出在新辅助化疗会诱导肿瘤周围组织纤维化及炎症水肿[4-5],术中表现为组织质韧易出血,且出血后不易止血,进而影响手术视野,因此这类患者在行LPD时可能因为手术难度的增加从而加大中转开腹概率。(4)对于术中小的出血,在超声刀止血效果不佳的情况下我们更推荐使用氩气刀止血。因为电凝虽有较好的止血效果,但其缺点明显[6],而氩气刀的优势在于减少组织碳化,另外由于电极和组织之间并未接触,不会产生粘连现象,止血过程烟雾产生少,视野受影响小[7],有利于进行下一步操作。
2.2 肿块与周围组织粘连致密
另外一个导致中转开腹的原因是术中发现肿瘤侵犯周围组织,粘连严重,强行分离可能导致大出血或者肿瘤不能完整切除。如果术前影像表明肿瘤侵犯血管,则提示该患者行LPD手术难度较大,术中可能中转开腹。但是术前影像学检查只能提供参考,术中对胰周血管的评估更为重要[8-9]。很多学者认为这种粘连仅仅是因为肿瘤局部蔓延所导致的炎症性粘连[10-11],手术中我们也发现有一部分肿块是可以经过仔细分离,然后完整剥离。另外对于复杂的LPD手术,不必拘泥于固定的手术流程,先处理简单的部分,在门静脉-肠系膜上静脉远、近端预先置入血管阻断带或用哈巴狗夹闭,使术中出血变为可控,必要时可行小切口辅助,即牟一平教授所提出的“Easy First”策略[12]。对于手术过程中由于分离粘连所造成的出血,我们一般先采用氩气刀止血,在氩气刀效果不佳的情况下我们认为缝合通常比Hem-o-lock夹闭更为有效,切忌因出血导致慌乱而盲目上血管夹,助手应手持吸引器配合主刀,找到出血点后以5-0线缝扎。若以上方法仍无法处理周围粘连,应及时中转开腹,切勿等到出血难以控制时再中转开腹。本组中转开腹的患者中3 例因为术中发现粘连难以分离及时中转开腹,其中1 例中转开腹后进行了血管切除重建,另外2 例中转开腹后经过仔细分离切除肿块。
还有值得注意的一点,位于胰腺头部的恶性肿瘤中转开腹率较高,而十二指肠及胆总管下段的肿瘤中转开腹率较低,可能的原因是胰腺肿瘤恶性程度较高,发现时均处于比较晚期的阶段,且肿瘤较大,与周围组织血管粘连较其他部位肿瘤严重,因此我们对胰头部大于3 cm的肿瘤应将其视为潜在的开腹风险。
总之,我们在LDP手术过程中难以避免的会遇到问题,为保证患者术中及术后的安全,在遇到腹腔镜下难以解决的困难时,应当及时中转开腹手术。

