残余胆囊结石6例诊治分析
邵惠江,鲁葆春,阮新贤,沈志宏
(绍兴市人民医院 肝胆胰外科,浙江 绍兴 312099)
残余胆囊结石(residual gallbladder stones,RGS)是指胆囊切除术后,因胆囊管残留过长而形成“小胆囊”,进而产生结石,并发急慢性炎症的临床少见并发症[1]。近年来,由于胆囊结石高发以及胆囊切除术的普及,RGS已成为临床一个不可忽视的问题。绍兴市人民医院2016年10月至2019年12月共收治RGS患者6例,现将诊治体会报道如下。
1 资料和方法
1.1 一般资料
本组患者6例,男4例,女2例,年龄50~75岁,平均(61.3±9.3)岁。所有患者首次手术时均以急性胆囊炎入院而行急诊手术,在本院治疗4例,外院2例;4 例行开腹胆囊切除术,2 例行腹腔镜胆囊切除术。5 例在术后7~25 年出现不同程度的右上腹痛,伴或不伴右肩或腰背部放射痛;1例无症状患者为术后14年体检发现。
1.2 术前诊断
2例患者行腹部B超检查,其中1例证实为RGS;所有患者行腹部增强CT检查,均证实为RGS(图1);3例进一步行MRCP检查,其中2例确诊(图2),而1例未发现明显异常。
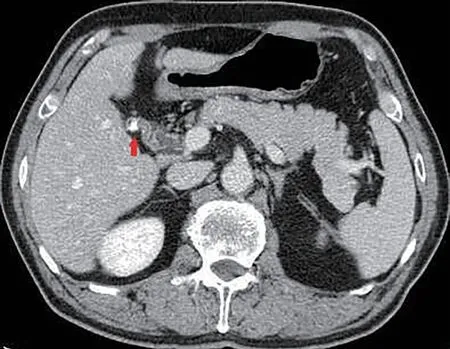
图1 所有病例腹部增强CT能清晰显示残余胆囊、结石及周围结构。
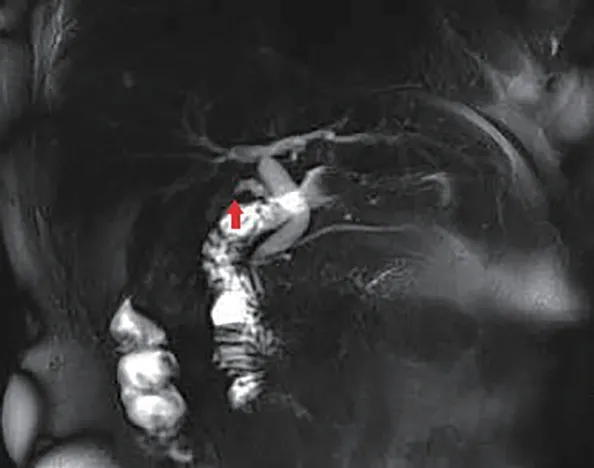
图2 病例1:MRCP图像显示残余胆囊。
所有患者再次手术前均确诊为RGS伴急慢性炎症,其中2例合并有胆总管结石。
1.3 手术方式
2例行腹腔镜残余胆囊切除。1例因合并胆总管结石伴胆管炎,且术中炎症粘连明显,行腹腔镜中转开腹残余胆囊切除加胆总管切开取石T管引流术。1例先行ERCP胆道取石,后行腹腔镜残余胆囊切除,因术中胆囊管与胆总管汇合部结石嵌顿,中转开腹行胆总管切开协助取石加残余胆囊切除术(图3)。1例因腹腔粘连较重而中转开腹行残余胆囊切除术。1例因相对高龄且有结肠癌手术史而拒绝接受手术治疗。所有腹腔镜手术患者脐部首孔均在直视下逐层进腹,术中以超声刀分离腹腔粘连。
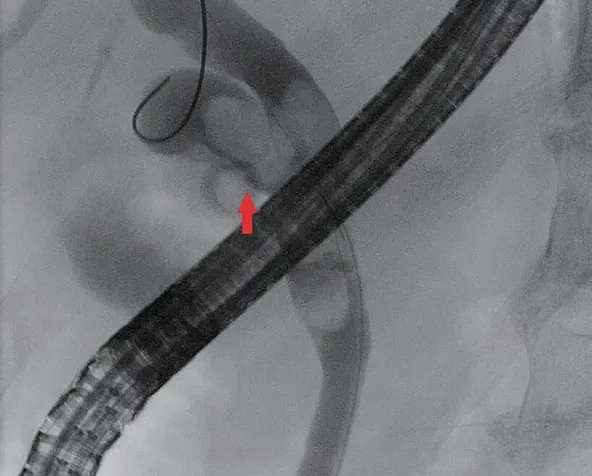
图3 病例4:ERCP取石时,发现残余胆囊与胆总管汇合部宽大,内有结石嵌顿。
5 例手术患者术中均证实有残余胆囊或胆囊管存在,内含大小不等的结石数枚。1例患者胆囊窝内有一4.0 cm×3.0 cm炎性包块,内含胶样渗出物,并与残余胆囊管相连;1例患者发现残余胆囊管汇入右肝管;1例患者残余胆囊与胆总管汇合部扩张明显,并有一直径1.0 cm结石嵌顿,残余胆囊肿胀伴白色胆汁。5例手术患者术前诊断、手术方式与术中情况如表1所示。
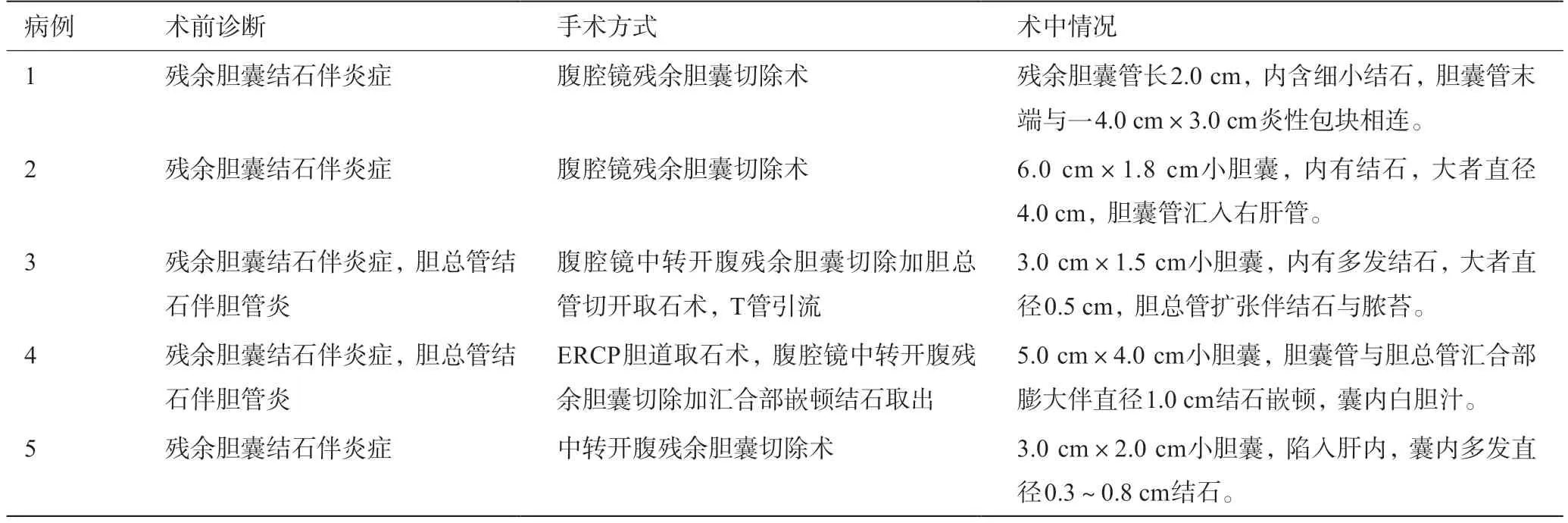
表1 5例手术治疗的RGS患者术前诊断、手术方式与术中情况
2 结果
5例患者手术过程顺利,围手术期无严重并发症出现,术后住院时间为4~13 d,平均(7.6±3.6)d。5例手术患者术后均获得随访,随访时间为4~43个月,平均(19.8±14.7)个月,随访期间无结石复发及其他肝胆系统相关疾病出现。
3 讨论
胆囊切除术后,遗留的胆囊壶腹或过长的胆囊管可形成“小胆囊”,腔内可残留或再生结石而出现临床症状,常需再次手术治疗[1-2]。早年,关于RGS的报道相对较多。2013年,邹康[3]统计发现,胆囊切除术后残余胆囊的总体发生率高达5.36%。近年来,随着腹腔镜胆囊切除术的广泛开展,相关手术器械不断改良,手术技术不断提高,加之腔镜视野的放大效应,使胆囊切除手术的解剖更加精细,RGS总体发生率下降,相关文献报道也相对减少。RGS常伴炎症反应,可反复发作,给患者带来痛苦,本组除1例无症状患者外,其余5例均有不同程度的急慢性炎症表现,与首次胆囊切除前类似。个别胆道结石可继发于RGS而出现梗阻性胆管炎表现,本组中2例患者合并胆道结石,考虑RGS来源。贾宝兴等[4]曾报道52 例残余胆囊患者,其中1 例发生癌变,推测与残余胆囊伴结石直接相关。虽然RGS为胆囊切除术后相对少见的并发症,但往往给患者带来二次手术创伤,甚至增加癌变风险,需引起术者重视。
3.1 RGS的诊断
RGS的临床表现主要为有胆囊切除史的患者出现反复发作的右上腹痛或不适,可伴有右肩或腰背部放射痛,常被误认为胆囊切除后综合征而被忽视[5]。腹部彩超因无创便捷等优势,可作为首选的筛查手段,检查影像常提示胆囊窝内一圆形类胆囊回声或无回声区[6]。对于初筛疑似患者,可进一步行腹部增强CT、MRCP或ERCP明确。文献报道,MRCP和ERCP是诊断残余胆囊最有效的手段,其中MRCP的检查成功率在95%以上[7-8]。我们的经验是,腹部增强CT在诊断残余胆囊或结石方面,同样具有重要的临床价值,尤其在CT动静脉期,发现或鉴别残余胆囊癌变的患者更具优越性。本组6例患者,均经腹部增强CT确诊,影像表现主要为原胆囊窝处有形似胆囊的厚壁囊状结构或残留的管状结构,囊内或管内可见高密度结石影,周围炎性病灶及相关结构显示也较为清晰。
3.2 RGS的治疗
再次手术是治疗RGS的主要方法。结合本组病例经验,我们认为“彻底切除残余胆囊,清除周围炎性病灶,积极处理相关合并症,预防残余胆囊再生”是手术治疗的总原则。手术方式可根据不同情况,采用开腹或腹腔镜下进行,孙勇等[9]认为,腹腔镜下切除残余胆囊是安全可行的。笔者认为,对于一般的RGS患者,腹腔镜手术可作为首选的方法,若术中条件不允许,再及时中转开腹。本组手术治疗的5例患者均首选腹腔镜方法,其中2例获得成功;其余3例因腹腔粘连严重,或合并胆道结石伴感染,或残余胆囊颈结石嵌顿等原因而中转开腹。由于考虑是再次手术,我们均采用直视下逐层进入脐孔的方式建立气腹,置入镜头后根据腹腔内粘连情况再作操作孔,并以超声刀分离粘连组织,可较大限度避免误伤腹腔脏器。
3.3 RGS的发生原因与预防
引起RGS的原因较多,结合文献复习与本组经验,我们总结如下:(1)急性胆囊炎与急诊手术。胆囊急性炎症时,胆囊周围组织充血水肿、渗出粘连明显,手术过程常容易出血,造成解剖困难和视野不清[1]。本组6例患者首次手术时,均以急性胆囊炎入院而行急诊手术。(2)胆囊管变异。胆囊管过长,胆囊管与胆总管粘连并行,胆囊管异常汇入等,往往是胆囊管残留形成“小胆囊”,是最终继发结石和炎症反应的解剖基础[10]。本组中5例手术患者,其中1例残留的胆囊管长达2 cm,1例胆囊管异常汇入右肝管,考虑与本次RGS发生密切相关。(3)术者心态。近年来,随着胆囊切除术,尤其是腹腔镜胆囊切除术的广泛开展,对于胆管损伤的过分强调,使许多术者对此产生了“畏惧”心理,出于安全考虑,他们往往更愿意贴近胆囊壶腹部去离断胆囊管,给远期RGS的发生埋下隐患。本组中2 例患者首次手术在基层医院急诊实施,推测与此因素相关。
RGS常常是多因素共同作用的结果,针对不同原因,采用合理方法,是减少和杜绝此类情况发生的重要手段。根据上述原因,我们总结经验如下:(1)针对急性胆囊炎选择合适的手术时机。尽量在炎症发作72 h内完成急诊手术;超过72 h的患者,可采取保守治疗控制感染,并于1~3 个月后择期手术;感染控制困难者,可选择PTGD引流,待炎症消退后再行手术。(2)建议胆囊管全程暴露。尤其对于腹腔镜手术的患者,最好做到胆囊管相对“骨骼化”。术者可用电凝钩充分打开胆囊三角前后腹膜,吸引器吸尽三角内脂肪与渗血,“掏空”胆囊三角,暴露胆囊管至胆总管汇合部。对于三角内不易分离的坚韧纤维组织,可用电凝钩或超声刀将其挑起后离断。部分患者胆囊动脉较短,会牵拉胆囊壶腹,造成胆囊管皱缩扭曲,不利舒展游离。对于此类情况,优先离断胆囊动脉尤为重要,最好选用0.5 cm组织夹夹闭动脉,避免影响后续胆囊管解剖与夹闭。(3)近胆总管离断胆囊管。一般认为,在胆囊切除时保留胆囊管长度在0.3~0.5 cm[9],但在急性炎症时,伴有结石嵌顿的胆囊管会异常膨大,在腹腔镜条件下,其保留的长度较难把握。结合腹腔镜胆囊切除经验,我们认为,在解剖清晰的前提下,可在靠近胆总管附近以组织剪直接离断胆囊管,并以4-0 Prolene线连续缝合残端,避免直接组织夹夹闭造成胆囊管残腔过大。(4)腹腔镜下汇合部附近结石的处理。腹腔镜下胆囊管夹闭后,胆囊管与胆总管汇合部附近结石残留,是造成RGS以及继发胆总管结石的另一重要原因。对于汇合部附近结石,我们认为,可先剪开远端胆囊管,用吸引器由下至上逆行推挤胆总管,通过增高的胆道压力及逆流的胆汁将结石冲离汇合部附近,再用分离钳由汇合部逐步逆行钳夹推挤结石至剪开的胆囊管处。理想状态为先见到结石或胆泥流出,随后为清亮胆汁。对于汇合部嵌顿无法推动的结石,及时中转开腹是必要的,强行钳夹推挤势必会造成汇合部胆管损伤,造成不必要的后果。本组中有1 例患者汇合部结石嵌顿,腹腔镜下无法推动,后中转开腹,打开胆总管前壁,由胆总管内侧逆行推出结石,并缝合胆囊管残端。
RGS临床相对少见,但随着胆囊切除术,尤其是腹腔镜胆囊切除术的广泛开展,其发生率仍不容忽视。合理的手术方案,必要的手术技巧,良好的手术心态,及时的中转开腹意识对预防RGS发生尤为重要。

