菲氏军团菌引起炎症性疾病机制的研究进展
赵 茗,谢立新(综述),王常乐(审校)
(1.河北医科大学第三医院骨与软组织肿瘤科,河北 石家庄 050051;2. 河北医科大学教学实验中心病原生物学实验室,河北 石家庄 050017;3.河北医科大学基础医学院病原生物学教研室,河北 石家庄 050017)
菲氏军团菌是军团菌属家族中的主要病原体之一,可感染人体呼吸系统并引起炎症性疾病[1]。已有报道显示,人体吸入被菲氏军团菌污染的气溶胶或湿润空气后,可引起高热、咳嗽、寒战、肌痛、胸痛、恶心呕吐等临床症状[1-2],但对其引起疾病的机制尚未充分了解与认识。因此,本综述结合已发表的相关研究,围绕菲氏军团菌的主要致病因子特征、菲氏军团菌致病因子与其诱导宿主免疫反应,以及菲氏军团菌感染、免疫反应与炎症性疾病三者之间的关系等内容,对该菌引起炎症性疾病的致病机制进行初步分析与探讨。
1 菲氏军团菌及其主要致病因子特征
菲氏军团菌是革兰阴性杆菌,属非嗜肺军团菌。目前,国内外关于菲氏军团菌的研究尚处于起步阶段,其危害尚不容小觑。因其血清1群(ATCC 35072,庞提阿克热菲氏军团菌,Legionella feeleii Pontiac fever,LfPF)1981年在加拿大自动汽车工厂导致大规模庞提阿克热(Pontiac fever)爆发而首次被报道并引发广泛关注[3-4]。此外,LfPF也曾被报道出感染2例免疫功能缺陷患者,引起二者肺炎并导致其中1例患者死亡[1,5]。相继,菲氏血清2群军团菌(ATCC 35849,军团病菲氏军团菌,L. feeleii Legionnaires′ disease,LfLD)同样在临床多次被证实能够引起人体军团病(Legionnaires′ disease)并导致死亡[1,4]。目前,菲氏军团菌引起庞提阿克热或军团病的致病机制尚未阐明,对其生物学特性与毒力因子性状的研究也多为观测性实验结果。研究报道,将细菌浓度为109/mL菲氏军团菌液注射至豚鼠体内,该菌能够表现出对宿主动物的致死能力。然而,当其被暴露在一系列导致细菌毒力因子活性减弱的不利因素后,豚鼠不再死亡[1]。基于已发表菲氏军团菌致病因子的研究报道,对菲氏军团菌宿主细胞内增殖、鞭毛及其毒力特性、胞内多糖物质等主要致病因子特征进行阐述与分析。
1.1宿主细胞内增殖 军团菌属胞内寄生菌,能够在不同宿主细胞内生长繁殖,不同种类的军团菌种表现出在哺乳动物巨噬细胞、上皮细胞及阿米巴原虫内不同的增殖能力[5]。其中,嗜肺军团菌、菲氏军团菌、橡树岭军团菌、杜莫军团菌、博杰曼军团菌及约旦军团菌在宿主细胞质内增殖时,可形成不同形态的胞内菌落[1]。
Dot/Icm IVB型分泌系统(type IVB secretion system)存在于军团菌属中的不同菌种内[6-7],能够调节并转运细菌毒性蛋白或DNA至宿主细胞质,从而增强军团菌的致病效应。但当该系统中的dotA基因缺失时,军团菌丧失胞内增殖及致病能力[8-9]。已发表研究显示:嗜肺军团菌可利用鞭毛、外膜蛋白等结构物质,侵袭宿主细胞[10]。被宿主细胞膜包裹后,可在胞质中形成含军团菌的囊泡样吞噬小体(Legionella-containing vacuole,LCV)[9]。LCV中的嗜肺军团菌可利用Dot/Icm IVB型分泌系统将其合成的约330多个毒力因子(效应蛋白)转运至宿主细胞内,这些效应蛋白间彼此分工协作,调节宿主细胞信号通路,共同影响着LCV在细胞质中的运输[9,11]。
Qiu等[9]在其综述中指出,嗜肺军团菌可将其合成的LidA、SidD、SidE、SidM、LepB、RalF等效应蛋白转运至LCV表面,继而募集在内质网参与细胞囊泡转运的宿主Sec22b蛋白、调节从内质网转运至高尔基体GTPase家族中的Rab1酶和Arf1蛋白,以及宿主自噬蛋白Atg7、Atg8,并固定这些宿主蛋白在LCV表面,将LCV加工成类似于宿主细胞中的内质网结构。再被核糖体进一步修饰后,进而躲避宿主细胞溶酶体降解,使得嗜肺军团菌在LCV中大量生长繁殖,最终,破坏宿主细胞膜,继而开始新一轮感染[2,9,11]。Weber等[12]研究证实,与野生型嗜肺军团菌相比,dotA基因缺陷型菌株在感染哺乳动物类巨噬细胞后,不能够在宿主细胞内增殖,且不可有效募集Sec22蛋白及Rab1酶[12-13]。由此可知,LCV在效应蛋白的作用下,在宿主胞浆内被修饰成更近似于细胞原有细胞器的囊泡样结构,从而逃避免疫系统监视,避免包含嗜肺军团菌的吞噬小体被宿主细胞转运并融合至溶酶体,以便细菌在胞质内存活与繁殖。
菲氏军团菌同样可在人体肺部巨噬细胞和阿米巴原虫中生长繁殖,并显示出较强的增殖能力。已有研究证实,在37 ℃环境中,LfPF和LfLD能够在U937人源、J774鼠源巨噬细胞系、A549、HeLa上皮细胞系、及卡式棘阿米巴原虫内生长增殖[3-5]。然而,菲氏军团菌在宿主细胞内的增殖机制尚未解析与阐明,该菌是否同样可利用Dot/Icm IVB型分泌系统将其分泌的毒力因子转运至LCV表面,通过募集宿主蛋白将LCV修饰,从而逃避被宿主免疫系统清除尚需进一步研究与证实。作为菲氏军团菌的重要致病因子特征之一,其在宿主细胞内增殖的详细机制,仍需进一步研究与证实。尤其深入探究与解析该菌的Dot/Icm IVB型分泌系统,或能为全面认识其致病特征提供有效帮助。
1.2鞭毛及其毒力特性 鞭毛是细菌的附属结构,主要由基础小体、钩状体、及丝状体三部分构成[14]。细菌在其胞质内形成鞭毛的过程中,一种类似Ⅲ型分泌系统的特殊蛋白输出装置发挥着关键作用,能够将鞭毛钩状体和丝状体结构蛋白运送至菌体细胞外[10,14]。一般来说,鞭毛可帮助细菌躲避不利的自然环境条件,调节趋化细菌向营养丰富及有利生存的地域,同时提高细菌的毒力及致病特性[1,10]。已有文献证实鞭毛与细菌的毒力相关,即其有助于病原体对人类上皮细胞的黏附,以及提高对小鼠MODE-K、Cl11、和CRL-2947上皮细胞系的侵入能力[15]。
军团菌属中的大多数病原体都可将鞭毛作为其引起宿主疾病的武器。研究证实,flaA基因编码的FlaA蛋白是能够影响军团菌致病效应的重要毒力因子之一[16-17]。flaA基因缺陷型军团菌株显著降低其对真核细胞的感染能力。已发表研究结果显示,将LfLD培养在固体培养基于25 ℃和30 ℃环境中,负染法电子显微镜下可观察到该菌呈平滑波浪状的单极鞭毛。然而,将LfPF置于相同培养条件下,却无鞭毛产生[4]。Appelt等[10]研究报道,Western blot分析FlaA蛋白在菲氏军团菌 ATCC 35849(LfLD)中呈阳性,但在菲氏军团菌ATCC 35072(LfPF)中呈阴性。此外,在电子显微镜观察中同样发现菲氏军团菌 ATCC 35849(LfLD)具有鞭毛结构。基于上述区别,相对比于LfPF,鞭毛能够增强LfLD对宿主上皮细胞的侵袭能力,同时促进人和小鼠巨噬细胞对LfLD的内在化,即相同数目LfPF与LfLD感染宿主细胞,LfLD进入宿主细胞质(LCV内)数量多于LfPF[1,4]。
虽然鞭毛已被证实在促进LfLD进入宿主细胞中发挥了关键作用,但将该菌培养在25 ℃和37 ℃环境后,却发现其在不同的温度中形成不同形态的鞭毛[4]。Wang等[4]推测LfLD被培养在较高温度后,其鞭毛蛋白在菌体外的结构排列与正常相比可能存在一定差异。同时,其在研究中同样证实,电镜下观察分别在不同温度中培养的LfLD和嗜肺军团菌JR32菌株的鞭毛,25 ℃数量最多,30 ℃居中,37 ℃最少[4]。
鞭毛蛋白作为细菌重要致病毒力因子之一,能够引起宿主细胞病变和诱导细胞因子释放。研究报道显示,两株运动阳性的野生型军团菌中分离纯化的鞭毛蛋白,可引发宿主细胞死亡并诱导白细胞介素1β炎性细胞因子释放,但当这2株细菌直接感染宿主细胞时却无该现象的发生[1]。在嗜肺军团菌中,flaA基因缺陷型菌株在诱导小鼠骨髓源性巨噬细胞死亡方面有明显缺陷[16-17]。菲氏军团菌的相关研究报道中也发现了类似的结果,鞭毛阳性LfLD比鞭毛阴性LfPF对宿主细胞表现出更为强烈的致病特性,引起大约70%人源或93%鼠源巨噬细胞死亡[4]。虽然鞭毛能够增强细菌的毒力效应,但LfPF和LfLD均能够在人源宿主细胞中生长繁殖,并表现出较强的胞内增殖能力[4]。因此,鞭毛的有无不会影响菲氏军团菌在宿主细胞质内的繁殖。虽然LfLD和嗜肺军团菌JR32菌株均具有鞭毛,但LfLD在感染宿主细胞初始阶段表现出比嗜肺军团菌JR32菌株更易被宿主细胞内在化[4]。因此推断,LfLD可能携带或编码一些嗜肺军团菌不具表达的毒力蛋白,可增强其侵入宿主细胞的效应,但其更易被宿主细胞内在化的具体原因尚需进一步探究与证实。
鞭毛作为菲氏军团菌目前较为了解的致病因子,尤以对比LfPF与LfLD的毒力特征之后,其在增强菲氏军团菌侵袭宿主细胞及诱导宿主细胞死亡等方面发挥关键作用,但其毒力特征的详细作用机制仍需深层次研究与阐明。
1.3胞外多糖(exopolysaccharide,EPS)物质 革兰阴性菌能够分泌EPS物质。EPS可增强细菌对营养物质的获取,促使菌体黏附在物体表面,并保护细菌不受外界环境中有害物质的伤害[18]。EPS物质通常以荚膜或黏液的方式释放至菌体外,是许多细菌共有的现象。这类物质不仅可改变菌落的透明度和形态,还可以增强细菌的致病性,诸如增强创伤弧菌抵抗小鼠血液清除的能力,提升铜绿假单胞菌对囊性纤维化患者肺炎的发病率和致死率[1]。
菲氏军团菌ATCC 35072(LfPF)可分泌EPS类物质,该类物质被认为是决定其菌落变异的重要原因[5]。研究发现,将LfPF培养在缓冲液-活性炭-酵母提取物琼脂平板后,可分离出两种不同类型的菌落,尤以颜色、透明度和菌落形态等方面显示出较大差异。其中,一种为白色粗糙型,另一种为棕色半透明型。两种菌落与另一株菲氏军团菌(ATCC 35849,LfLD)的菌落相对比后发现,白色粗糙型菌落是菲氏军团菌形成的新型菌落。透射电子显微镜下观察形成两种不同菌落的细菌显示,白色粗糙型菌落菲氏军团菌(white rugose L. feeleii,WRLf)的周围可见能够被钌红染色的胞外多糖,即WRLf可向菌体外周释放EPS类物质。但在棕色半透明型菌落菲氏军团菌(brown translucent L. feeleii,BTLf)的周围没有该物质的存在。
EPS类物质的有无对WRLf和BTLf毒力性状的影响,在经过一系列相关试验研究中逐步获得证实:该物质可抵抗人类血清杀菌作用,同时在增强人源巨噬细胞、上皮细胞对WRLf的内在化发挥重要作用,即相同数目WRLf和BTLf感染宿主细胞后,WRLf侵入细胞质(LCV内)的数量多于BTLf[5]。动物体内感染实验同样对EPS类物质的致病性作出了研究与分析。文献显示,ddY小鼠经鼻腔内接种WRLf和BTLf细菌悬液,并在感染24 h和48 h后将其处死。将被WRLf和BTLf感染的小鼠肺脏分离取出,经制成组织匀浆液涂在BCYE平板后,两种细菌菌落的数量均少于实验初始小鼠鼻腔注射细菌量。这些研究结果表明EPS类物质的致病性或不足以导致ddY小鼠患病及死亡[1]。作为模拟人类被病原体感染的模型,3周龄豚鼠被WRLf和BTLf感染后,体温均有明显升高,但BTLf 和WRLf 分别使得豚鼠体温在感染24 h和48 h后达到顶峰[5]。
上述研究首次报道EPS类物质或是引起菲氏军团菌(LfPF)产生不同类型菌落变异现象的原因,同时提示WRLf和BTLf对豚鼠有不同的致热作用。但作为菲氏军团菌的重要致病因子之一,EPS类物质在增强该菌对宿主细胞的侵袭以及抵抗人类血清杀菌作用的详细机制尚需深入解析与阐释。
2 菲氏军团菌致病因子与诱导宿主免疫反应
人体固有免疫系统在监测细菌入侵和感染机体方面发挥着关键作用,同时对启动、调节宿主适应性免疫应答,协同效应T细胞和抗体发挥免疫效应具有重要作用[19-21]。病原体感染人体后,其致病因子可被巨噬细胞、上皮细胞表面受体蛋白识别,触发宿主细胞免疫反应,诱导炎性细胞因子释放及宿主细胞死亡,从而限制并清除病原体的进一步感染,发挥保护宿主的作用(图1)[22]。因此,固有免疫系统是人体防御病原体侵袭与感染的第一道防线[21]。已有研究证实,细菌鞭毛蛋白被宿主NLRC4或NAIP5受体识别后,触发一系列细胞内信号级联反应,引起白细胞介素1β、白细胞介素18炎性细胞因子释放及小鼠骨髓巨噬细胞焦亡[19,22-25]。其它研究表明,该致病蛋白也可被连接到TLR5受体,通过激活TLR5-MyD88-核因子κB途径诱导人巨噬或上皮细胞中白细胞介素6和白细胞介素8等炎性因子释放[20]。
鞭毛作为菲氏军团菌的主要致病因子之一,其外部是由具有致病性的丝状鞭毛蛋白组成[1,4]。相对比无鞭毛的LfPF来说,LfLD感染U937、A549人源细胞系后,可诱导宿主细胞释放大量白细胞介素6和白细胞介素8[4],但其感染宿主细胞刺激炎性因子释放的途径尚未阐明。深入研究菲氏军团菌的致病因子与其诱导的宿主免疫反应,尤以探究其在感染宿主后,诱导机体免疫系统对其识别及释放炎性蛋白信号等的机制与通路,或为深入解析该菌引起人体呼吸系统炎症性疾病的致病机制提供可靠实验基础。
3 菲氏军团菌感染、免疫反应与炎症性疾病
菲氏军团菌感染人体后可引起呼吸系统炎症性疾病,即军团菌病。基于本文上述已系统阐述的菲氏军团菌致病因子,及感染宿主后其致病因子诱导宿主产生的免疫应答反应,菲氏军团菌、免疫反应与炎症性疾病三者之间的关系或为:菲氏军团菌感染宿主细胞后,其致病因子导致宿主细胞死亡、组织损伤,激活宿主免疫应答对其清除,导致炎症性疾病的发生。且当不同血清群菲氏军团菌表达毒力更强致病因子时(例如LfLD携带鞭毛),又可刺激宿主细胞释放过量炎性细胞因子,进而加剧宿主炎症性疾病的发展(图1)。
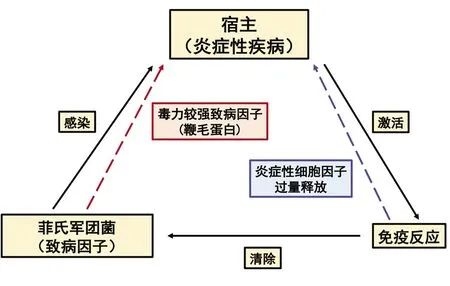
图1 菲氏军团菌感染、宿主免疫反应及炎症性疾病间的相互关系
3.1炎症性疾病种类 军团菌病主要包含两种不同的临床类型。一种为轻微的,自限性流感样疾病,称为庞提阿克热;另一种是致死性,非典型社区获得性肺炎,称为军团病[1]。庞提阿克热的潜伏期和病程均较为短暂,无肺炎症状,病死率为零。文献报道,嗜肺军团菌、米克戴德军团菌、阿尼沙军团菌、菲氏军团菌、长滩军团菌和马塞切尼军团菌可引起人类庞提阿克热[4,10]。庞提阿克热的病程虽表现剧烈且侵袭率高,但直到现在,还没有从庞提阿克热患者体内分离出军团菌的临床报道。
军团病是一种致命性社区获得性肺炎(community-acquired pneumonia,CAP),1976年美国退伍军人协会成员间首次引起大规模爆发[1,2,9]。军团病的潜伏时间较长,侵袭率低于庞提阿克热,患者如未及时接受有效治疗,病死率可从10%升至27%。嗜肺军团菌是引起军团病的主要病原体,占据临床病例中的90%以上,随后是长滩、波兹曼、米克戴德、杜莫氏、菲氏、沃氏、阿尼沙军团菌[1-2]。2015年,纽约市爆发军团病,导致138例患病,16例死亡[26]。已有文献报道均提到,军团病可不经人与人之间传播[9,27]。然而,2016年葡萄牙一则临床案例首次强有力证实军团病可通过人-人之间传播[28]。因此,基于上述已有报道,菲氏军团菌可引起人体庞提阿克热和军团病两种呼吸系统炎症性疾病。
3.2炎症性疾病致病机制 军团菌属引起人体军团菌病的致病机制尚需进一步解析与阐明。已发表文献显示,嗜肺军团菌引起庞提阿克热的原因可能为该菌在人体内释放的毒素,或感染人体呼吸系统后,其致病因子引起机体强烈免疫反应所致[1]。阿尼沙军团菌感染人体引起庞提阿克热的案例分析显示,该菌在人源吞噬细胞中的增殖缺陷或为导致庞提阿克热发生发展的重要原因[1]。然而,基于目前研究现状,LfPF表现出与上述两种军团菌引起庞提阿克热的不同方式。LfPF致病因子的毒力效应弱于嗜肺军团菌,且形成一种新型菌落,但其可在宿主细胞内生长繁殖并表现出较强增殖能力[4-5]。虽然LfPF感染宿主细胞后,其诱导细胞因子释放与细胞死亡的能力弱于LfLD,但同样可导致白细胞介素6及白细胞介素8炎性细胞因子释放及人源宿主细胞死亡[4]。此外,EPS类物质也曾被怀疑可能与菲氏军团菌引起庞提阿克热有关,但被WRLf和BTLf感染的豚鼠都出现高热症状[5],提示EPS类物质可能不是引起庞提阿克热疾病的必要因素。庞提阿克热患者无肺部感染症状且该病属自限性疾病,或与LfPF不具鞭毛且其致病性相对较弱有关,同时也可阐释该病原体不会像LfLD引起健康人群较为严重的炎症性疾病。因此,LfPF引起庞提阿克热的发病机制可能归因于其在人肺巨噬细胞、上皮细胞中的胞内增殖,以及感染人体后引起的宿主免疫反应,但LfPF诱导宿主免疫应答的机制与具体过程尚需解释阐明。
已有文献推测,LfLD或可分泌一些蛋白酶类物质,继而能够破坏宿主肺部组织并引起肺部炎症反应[4]。因此,Wang等[1]将LfPF、LfLD和嗜肺军团菌JR32菌株培养在含1%脱脂牛乳琼脂平板,放置于37 ℃环境。结果显示,除嗜肺军团菌JR32菌株外,LfPF和LfLD均不能分解脱脂牛乳中的蛋白质,提示两种菲氏军团菌或在分泌外切蛋白酶方面存在缺陷。炎性细胞因子的分泌对肺部细胞、组织可谓是一把双刃剑。当其适度产生时,可在宿主免疫反应中发挥有效作用。一旦外界因素刺激炎性细胞因子释放过量,便可成为“致病因子”继而加剧肺组织损伤并导致肺部炎症进一步发展。此外,携带较强致病毒力因子的胞内寄生病原体引起宿主肺上皮组织的直接损伤,也被认为是肺炎发生的重要机制之一[1]。
尽管胞内增殖被怀疑是菲氏军团菌引起人体呼吸系统炎症性疾病的原因之一,但作为一种重要的毒力致病因子,鞭毛在导致病情更为严重且引起人体死亡的疾病(如军团病)中或发挥重要作用。如同菲氏军团菌LfLD,相对LfPF而言,该菌具有较强侵入宿主细胞的能力,且可诱导大量细胞死亡。在感染宿主细胞后,其鞭毛又可导致大量炎性细胞因子释放,进而引起对人体损伤更为严重的军团病[4]。因此,菲氏军团菌引起人体肺部致死性炎症性疾病的致病机制或是由两部分因素组成,一方面为细菌毒力因子的较强致病效应,另一方面为炎性细胞因子的过量释放。
4 小 结
基于当前研究现状,本篇综述详细阐述了菲氏军团菌的致病因子、宿主免疫反应、以及该菌引起的炎症性疾病三者之间的关系,初步总结与分析了菲氏军团菌引起炎症性疾病的致病机制。菲氏军团菌能够引起人体庞提阿克热和军团病,被认为是军团菌家族中的重要病原体之一。目前,专注于探究和阐释菲氏军团菌致病机制的研究少之又少。前期相关研究中已明确阐明和分析由于鞭毛的有无,LfPF和LfLD对宿主细胞的毒力效应和诱导宿主免疫反应的差别,以及LfPF中EPS类物质的致病特征。虽然被用于研究的菲氏军团菌株数目有限,但LfPF和LfLD均属于相同军团菌种,且能够导致不同类型军团菌病。因此,二者是研究非嗜肺军团菌引起人体炎症性疾病致病机制的典型代表。
在未来研究中,应更为广泛收集菲氏军团菌株,尤以临床分离菌株为主要代表。同时,制备dotA和flaA基因缺陷型菲氏军团菌,与野生型菌株一并用于野生型及免疫受体缺陷型动物感染实验,以进一步探究该病原体毒力因子的致病效应,以及诱导宿主引起的免疫反应,从而全面、详细阐释该菌引起炎症性疾病的致病机制。此外,dotA基因缺陷型菲氏军团菌可进一步证实,该菌是否可在感染宿主细胞后利用Dot/Icm IVB型分泌系统在宿主细胞内生长繁殖。
综上所述,在今后的研究中,应继续深入分析菲氏军团菌引起炎症性疾病的致病因子特征以及刺激宿主对其产生的免疫应答,继而进一步阐明军团菌病的发病机制。

