IVIM技术成像量化参数与前列腺癌病理特征的关系及联合诊断研究
黄继伟,李健斐,王 佳,刘郭坤,李建丽,王玉芳
(1.河北省邯郸市中医院 CT/MRI室,河北 邯郸 056001;2.河北省邯郸市中心医院CT/MRI室,河北 邯郸 056001)
前列腺癌(prostate cancer,PC)是一种较特殊的恶性肿瘤疾病,早期诊断、早期治疗是提升患者生存率的关键环节。临床数据显示,70%~75%PC发生在外周带,25%~30%发生在移行带[1]。尽管近年随影像学技术发展,磁共振成像(magnetic resonance imaging,MRI)在PC诊断、病情评估发挥显著优势,但移行带组织成分复杂且常伴良性前列腺增生,因此如何有效诊断、鉴别诊断移行带PC是临床急需解决问题之一[2]。小视野体素内不相干运动(intravoxel incoherent motion,IVIM)是在DWI成像技术基础上通过扫描多个b值获取水分子扩散数据并通过双指数数学模型计算公式得出对应伪扩散系数(pseudo diffusion coefficient,D*)、灌注分数(perfusion fraction,f)、扩散系数(diffusion coefficient,D)、表观扩散系数(apparent diffusion coefficient,ADC)等量化参数[3]。理论上,与MRI常规序列对比,IVIM检测技术能更全面、更精准地反映生物组织中水分子真实扩散运动情况,同时能有效获取组织灌注信息,或对提高PC鉴别诊断价值具有积极意义[4]。本研究旨在探讨IVIM技术成像量化参数与PC病理特征的关系,为临床完善诊疗机制提供参考。现报告如下。
1 资 料 与 方 法
1.1一般资料 选取2017年1月—2020年7月河北省邯郸市中心医院收治的PC患者62例作为观察组,良性前列腺增生症患者62例作为对照组。纳入标准:①经病理诊断确诊;②入组前未经内分泌治疗、放化疗等任何相关治疗;③MRI检查后1个月内获取病理结果;④患者及家属知情同意并签署知情同意书。排除标准:①伴其他原发性恶性肿瘤疾病者;②有血液系统疾病者;③入组前4周内有前列腺手术史、前列腺穿刺史者。2组年龄、吸烟史、饮酒史、体重指数、血脂异常分布、合并疾病差异均无统计学意义(P>0.05),具有可比性。见表1。
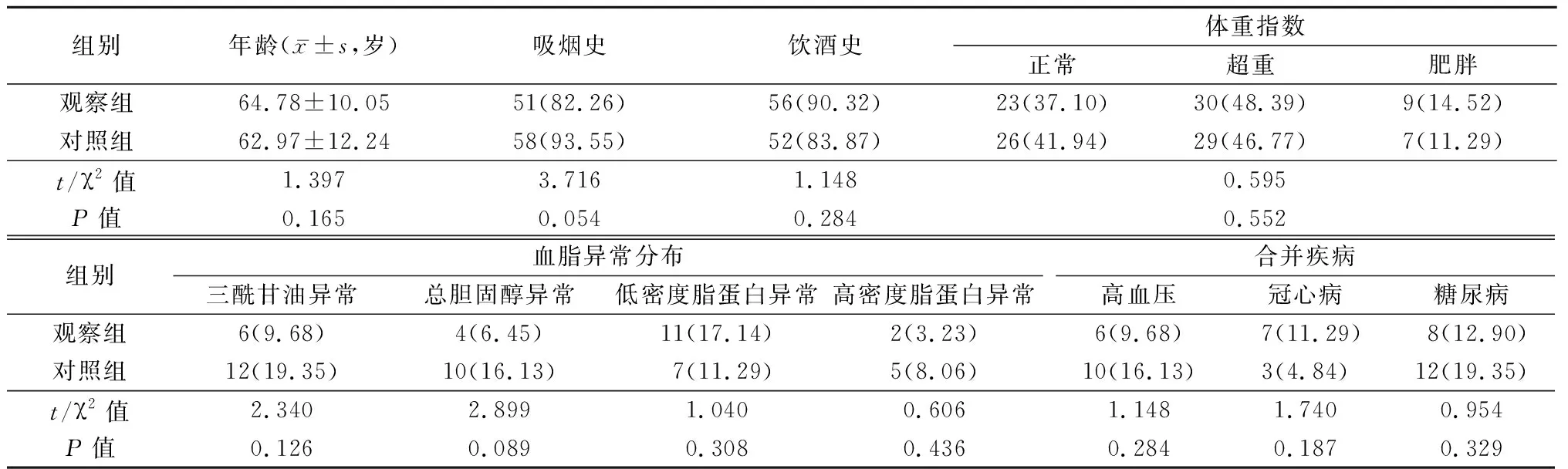
表1 2组一般资料比较Table 1 Comparison of general information between two groups (n=62,例数,%)
1.2方法 GE3.0T磁共振成像系统,配8通道腹部相控阵线圈;扫描范围包括前列腺、双侧精囊腺。首先常规MRI扫描:轴位T1WI、轴位FS-T2WI、矢状位T2WI扫描;轴位FS-T2WI参数:TE 85 ms、TR 5 300 ms、层厚3.0 mm、间距0.6 mm,FOV 230 mm×230 mm,矩阵256×256,NEX 1;IVIM技术:轴位,参数设置:TE 95 ms、TR 3 900 ms、层厚2.0 mm、间距0.24 mm,FOV 280 mm×280 mm,矩阵160×160,NEX 4,取7个b值分别为0、50、100、150、200、400、600 s/mm,扫描时间5 min 10 s。扫描时将整个前列腺分成12个区,即外周带左右基底部、中间部、尖部,中央区左右基底部、中间部、尖部,获取数据导入系统软件ivimMain,双指数模型处理,得到D*、f、D、ADC数据。
1.3观察指标 ①比较2组IVIM技术成像量化参数。②分析IVIM技术成像量化参数诊断前列腺癌的价值。③比较不同病理特征[肿瘤大小、前列腺特异抗原(prostate specific antigen,PSA)水平、2016版肾癌WHO泌尿课程/国际泌尿病理协会(2016 renal cancer WHO urology course/international association of urological pathology,ISUP)分级[5]、D′Amico危险度、肿瘤T分期、Gleason评分]患者IVIM技术成像量化参数。ISUP分级标准:Ⅰ级,未见核仁;Ⅱ级,可见核仁;Ⅲ级,低倍镜可见核仁;Ⅳ级,低倍镜见多形性或见梭形细胞、横纹肌样分化、多核巨细胞。Gleason评分:2~4分为高分化癌;5~7分为中分化癌;8~10分为低/未分化癌。D′Amico危险度:根据血清PSA水平、Gleason评分、肿瘤T分期分低危、中危、高危。④分析IVIM技术成像量化参数与病理特征的相关性。
1.4统计学方法 应用SPSS 19.0统计学软件处理数据。计数资料比较采用χ2检验,计量资料比较采用独立样本t检验、单因素方差分析;诊断效能分析采用受试者工作特征(receiver operating characteristic,ROC)曲线,获取曲线下面积(area under the curve,AUC)、95%可信区间(95%CI)、敏感度、特异度及cut-off值,不同预测方案间曲线下面积比较采用DeLong 检验,返回预测概率Logit(p),将其作为独立检验变量;Spearman秩相关系数、Pearson相关系数分析相关性。P<0.05为差异有统计学意义。
2 结 果
2.12组IVIM技术成像量化参数比较 观察组D、ADC低于对照组,差异有统计学意义(P<0.05);2组D*、f差异无统计学意义(P>0.05)。见表2。

表2 2组IVIM技术成像量化参数比较Table 2 Comparison of imaging quantitative parameters of IVIM technology between two groups
2.2IVIM技术成像量化参数诊断前列腺癌的价值 ROC分析结果显示,D、ADC诊断PC的AUC值分别为0.800、0.773;D、ADC联合诊断PC的AUC值为0.865,返回预测概率Logit(p)作为独立检验变量,结果显示,联合诊断的AUC值大于单一参数单独检测(P<0.05)。见图1,表3。

图1 IVIM技术成像量化参数诊断前列腺癌的ROC曲线Figure 1 The ROC curve of quantitative parameters of IVIM technology in the diagnosis of prostate cancer

表3 IVIM技术成像量化参数诊断前列腺癌的价值Table 3 The value of quantitative parameters of IVIM technology in the diagnosis of prostate cancer
2.3IVIM技术成像量化参数与病理特征的相关性 采用Spearman分析发现,D(rs=-0.649,P<0.001)、ADC(rs=-0.700,P<0.001)与ISUP分级呈负相关,D(rs=-0.784,P<0.001)、ADC(rs=-0.712,P<0.001)与D′Amico危险度呈负相关,D(rs=-0.559,P<0.001)、ADC(rs=-0.583,<0.001)与肿瘤T分期呈负相关;采用Pearson分析发现,D(r=-0.594,P<0.001)、ADC(r=-0.653,P<0.001)与Gleason评分呈负相关。见图2~9。

图2 D与ISUP分级的关系Figure 2 The relationship between D and ISUP grade图3 ADC与ISUP分级的关系Figure 3 The relationship between ADC and ISUP grade图4 D与D'Amico危险度的关系Figure 4 Relationship between D and D′Amico risk图5 ADC与D′Amico危险度的关系Figure 5 Relationship between ADC and D′Amico risk图6 D与肿瘤T分期的关系Figure 6 Relationship between D and T stage of tumor图7 ADC与肿瘤T分期的关系Figure 7 Relationship between ADC and T stage of tumor图8 D与Gleason评分的关系Figure 8 Relationship between D and Gleason score图9 ADC与Gleason评分的关系Figure 9 Relationship between ADC and Gleason score
2.4不同病理特征患者IVIM技术成像量化参数比较 不同ISUP分级、D′Amico危险度、肿瘤T分期、Gleason评分患者D、ADC差异有统计学意义(P<0.05);不同肿瘤大小、PSA水平患者D、ADC差异无统计学意义(P>0.05)。见表4。

表4 不同病理特征患者IVIM技术成像量化参数比较Table 4 Comparison of quantitative parameters of IVIM technology in patients with different pathological characteristics
3 讨 论
PC是中老年男性群体常见恶性肿瘤疾病,近年其发病率、病死率逐年升高[6]。如何提高PC早期确诊率,为临床有效治疗赢取最佳时机是确保治疗效果、提高生存率的关键环节。
鉴于血流灌注情况是临床鉴别PC及良性前列腺增生症的一项重要指标,MRI是当前辅助诊断PC的最佳影像学技术,但近年随此技术广泛应用发现,部分患者仅凭常规序列诊断困难[7]。IVIM技术是近年新兴的一项MRI技术,同样能无创、定量评价组织中水分子扩散、微血管灌注情况,但常规MRI序列的定量参数ADC值是于假设组织中水分子扩散是随意、简单的分子运动前提下获取,此显然难以真实反映组织中水分子运动状态,而IVIM技术通过描述多个不同b值下的水分子扩散数据,并借助双指数数学模型计算对应参数值有助于更准确、全面反映组织内水分子真实扩散状态。本研究结果发现,2组D*、f参数值间差异无统计学意义(P>0.05),与丁玉芹等[8]在IVIM技术诊断肾癌中的报道近似。分析可能原因是恶性组织生长及侵袭依赖于血管新生,而新生血管成熟度较低,畅通性差致毛细血管血流速度并未显著增加[9];同时IVIM所检测灌注状态中不仅包含微血管血流灌注还涉及腺体分泌、腺管中液体流动信息等,D*、f参数值可能偏离实际情况[10]。本研究结果发现,观察组D、ADC低于对照组(P<0.05),此特征符合以往报道[11-12]中恶性细胞增殖的生物学特性,随PC中恶性细胞增殖,病灶组织密度升高,同时细胞核质占比增加,间隙缩小致水分子扩散受限,因此,D、ADC值降低。此外,D值低于ADC值,反映IVIM技术可排除组织内微循环灌注对检测结果的影响,可更真实地反映细胞内外水分子扩散运动状态。进一步ROC分析显示,D值<1.06×10-3mm2/s或(和)ADC值≤1.19×10-3mm2/s时提示PC发生概率较高,二者联合诊断PC的敏感度为82.26%,特异度为77.42%,具有较高诊断价值,可为临床鉴别诊断提供一定参考。
此外,能有效、客观评价PC病理特征对指导临床完善治疗方案亦具有重要意义[13-14]。目前D′Amico危险度、Gleason评分是目前临床常用PC病理学分级系统,同时还包括ISUP分级、肿瘤T分期等均可为临床评价PC病理特征提供参考,但上述评价工具共性是易受操作者主观因素影响,缺乏客观性[15-17]。本研究结果显示,不同ISUP分级、D′Amico危险度、肿瘤T分期、Gleason评分患者间D、ADC值差异有统计学意义(P<0.05),说明D、ADC值可能与PC病理特征存在关联性。分析主要原因为ISUP分级、D′Amico危险度、肿瘤T分期、Gleason评分越高反映的PC恶性程度越高,恶性细胞增殖活跃可致细胞间隙缩小,影响水分子扩散,或可为临床评价PC病理特征提供新视角。相关性分析发现,D、ADC与ISUP分级、Gleason评分、D′Amico危险度、肿瘤T分期呈负相关(P<0.05),证实D、ADC与PC病理特征关系密切,可为临床早期评价PC病理特征提供数据参考。但本研究不足之处在于首次对IVIM技术成像量化参数与PC病理特征间关系进行探究,且样本量较少可能缺乏代表性,需后期进一步深入探究。
综上所述,IVIM技术成像量化参数中D、ADC诊断PC的敏感度、特异度较高,参数值与病理特征关系密切,二者联合不仅可进一步提高诊断效能,还能为临床评价病理特征提供参考,便于治疗方案的制定。

