藜麦酸奶混菌发酵工艺优化及品质与风味评价
常嘉乐,张 婷,袁亚宏,岳田利
(西北农林科技大学食品科学与工程学院,农业部农产品质量安全风险评估实验室(杨凌),陕西杨凌 712100)
藜麦(Chenopodium quinoaWilld),双子叶藜科藜属植物,原产于南美洲安第斯山区,是一种营养丰富的假谷物。相比于其他谷物,藜麦的蛋白质含量更加丰富,各类氨基酸比例均衡,营养价值可以媲美牛奶。此外,藜麦以其无麸质的优势,可以作为原料为乳糜泻患者提供更多的营养和合适的食品[1]。作为“功能性食品”的典型代表,藜麦已经被证实对儿童、老人以及乳糖不耐症、贫血、糖尿病、肥胖等患者大有益处[2]。
酸奶是牛奶经过乳酸菌发酵而成,风味独特、营养丰富,具有改善肠道微环境的作用,尤其适合乳糖不耐受者食用。随着酸奶消费市场的逐步扩大,酸奶工艺和类型也在不断优化改进,除传统工艺下的酸奶配方外,水果酸奶[3]、药食同源添加酸奶[4]以及谷物酸奶如紫薯燕麦酸奶[5]、黑小麦芽酸奶[6]等也逐渐出现在市场上。相比单一菌种发酵,混菌发酵会产生更多的氨基酸[7]以及更多种类的风味物质[7−8],提高产品品质,赋予产品更加丰富的感官体验。目前,有研究采用直投式发酵剂对藜麦浆和牛奶进行共发酵[9−13],而鲜少使用自制发酵剂。虽然有采用嗜热链球菌和保加利亚乳杆菌自制发酵剂,将藜麦烘炒后打粉蒸制与牛奶共发酵,对其工艺进行优化[14],但未进行更深入的评价。
为促进我国藜麦产业的开发与发展,丰富藜麦产品类型,本研究以藜麦膨化粉和牛奶为原料,采用嗜热链球菌、保加利亚乳杆菌和动物双歧杆菌混合自制发酵剂,并将单因素实验与正交试验相结合优化其参数。在最优发酵工艺下,动态监测藜麦添加对酸奶发酵期、后熟期和贮藏期活菌数和酸度变化的影响;评价藜麦酸奶成品的基础营养指标、有机酸以及挥发性风味物质的成分及含量,以期为进一步开发藜麦深加工产品提供理论参考和工艺支撑。
1 材料与方法
1.1 材料与仪器
鲜牛奶 购于当地超市(蛋白质3.24 g/100 g,脂肪3.14 g/100 g,乳糖4.83 g/100 g,非乳脂固体8.85 g/100 g);膨化藜麦粉 由挤压膨化机进行加工;蔗糖(研磨成粉) 购于当地超市;食品级琼脂 石狮市高新琼脂食品有限公司;脱脂乳粉 伊利股份有限公司;MRS肉汤 北京陆桥技术股份有限公司;发酵菌种:嗜热链球菌(Streptococcus thermophilus)6063、德氏乳杆菌保加利亚亚种(保加利亚乳杆菌Lactobacillus bulgaricus)6064、动物双歧杆菌乳亚种(动物双歧杆菌Bifidobacterium animal)B-15 −80 ℃保存于西北农林科技大学健康食品制造与安全控制实验室。
YT-CJ-2ND型超净工作台 北京亚泰科隆仪器技术有限公司;ZXSD-A1160生化培养箱 上海智城分析仪器制造有限公司;TA.XT PLUS/50物性测试仪 英国Stable Microsystem公司;冷冻高速离心机 安徽中科中佳科学仪器有限公司;FW-400AD高速研磨机 天津鑫博得仪器有限公司。
1.2 实验方法
1.2.1 藜麦酸奶制作工艺 将甘油管保藏菌种接种于MRS液体培养基中,36 ℃静置培养24 h(动物双歧杆菌需在厌氧环境下),活化两代。将活化两代的菌体用无菌生理盐水清洗后,接种于脱脂复原乳中,43 ℃培养24 h,至酸乳凝固,制成母发酵剂。将母发酵剂接入脱脂牛奶中,43 ℃培养6~7 h,直至酸乳凝固制成工作发酵剂备用。
将洗净烘干藜麦粉碎过40目筛,按照张婷等[15]的工艺对藜麦粉进行挤压膨化。冷却后由高速研磨机粉碎,过120目筛,作为添加主料备用。
1.2.2 最佳菌种配比 为确定三种乳酸菌发酵藜麦酸奶的最佳配比,进行随机试验,将市售牛奶与7%(w/v)蔗糖粉、3%(w/v)藜麦粉、0.1%(w/v)琼脂混合均匀,按照表1中的比例,以2%(v/v)的接种总量进行接种,于43 ℃发酵7 h后再4 ℃后熟12 h。以持水力、酸度、感官、硬度、稠度、总活菌数为评价指标,采用主成分分析法计算综合评分,以综合评分确定最佳菌种配比。
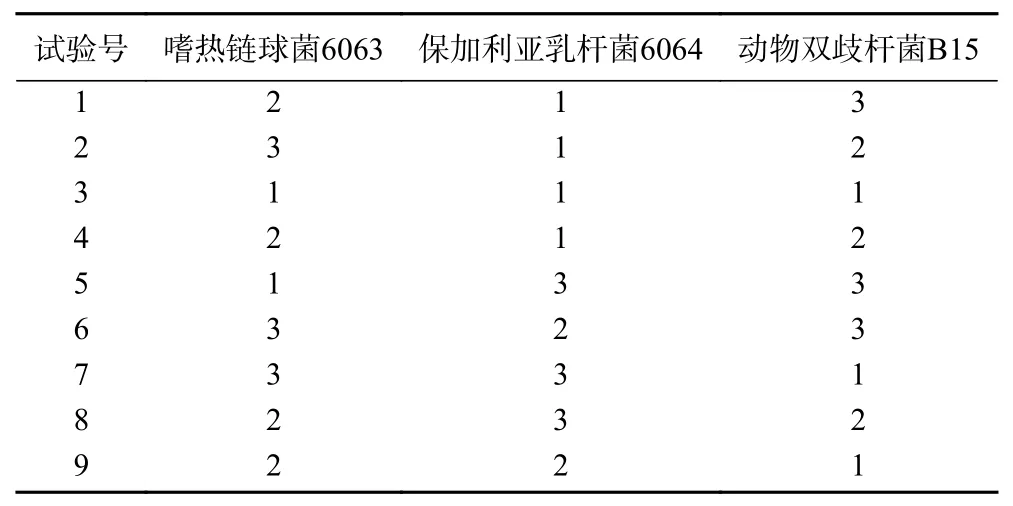
表 1 藜麦酸奶菌种体积比例组合Table 1 Volume proportional of three lactic acid bacteria in quinoa yoghurt
1.2.3 单因素实验 按照图1所示工艺对酸奶进行发酵,分别考察接菌量(1%、2%、3%、4%、5%)、藜麦添加量(1%、3%、5%、7%、9%)、发酵温度(37、39、41、43、45 ℃)对藜麦酸奶酸度和稠度的影响,其中各因素固定水平为接菌量3%,藜麦添加量3%,发酵温度41 ℃。此外,蔗糖添加量为7%,琼脂添加量为0.1%。
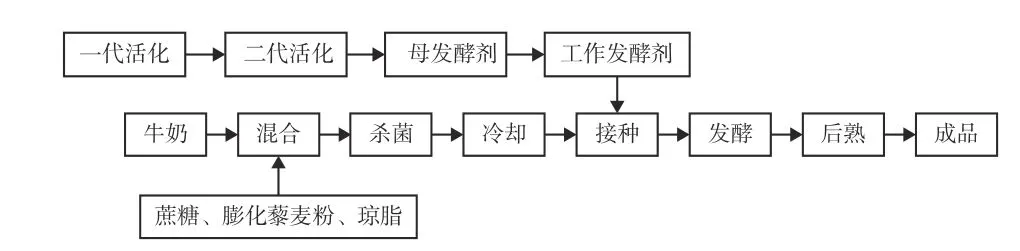
图 1 藜麦酸奶制作工艺Fig.1 Production process of quinoa yogurt
1.2.4 正交试验 结合单因素实验结果,采用图1所示工艺发酵酸奶,选取发酵温度、接种量、藜麦添加量作为评价因素,以酸度和稠度为评价指标,设计正交试验,因素与水平见表2。

表 2 正交试验L8(27)因素水平表Table 2 Factors and levels table for L8 (27) orthogonal experiment
1.2.5 指标测定方法
1.2.5.1 持水力 称取一定质量的酸奶,记为m1,4 ℃条件下,4000 r/min离心20 min,弃上清,在称量酸奶质量,记为m2[16]。持水力计算公式如下:

式中:m1—所称重酸奶的质量,g;m2—弃去上清后沉淀的质量,g。
1.2.5.2 酸度 参照GB 4789.35—2010《食品安全国家标准食品酸度的测定》[17]方法进行测定。配制NaOH溶液并标定后,以酚酞为指示剂,采用酸碱滴定法对酸奶样品的酸度进行测定。
1.2.5.3 感官评价 制定感官评价评分标准表,如表3。请10位专业感官人员(5男5女)对酸奶进行观察和品尝,并打分。

表 3 藜麦酸奶感官评分标准表Table 3 Sensory evaluation standard for quinoa yoghurt
1.2.5.4 稠度与硬度 采用TA.XT PLUS/50物性测试仪测定,使用压盘型探头(d=35 mm);受压应力测试;测试速率:1.0 mm/s;提升速率:1.0 mm/s;测试深度:30.0 mm;数据采集速率:200 pps。
1.2.5.5 活菌数测定 测定参照GB 4789.35-2010《食品安全国家标准,食品微生物学检验,乳酸菌检验》[18]。将制得的酸奶样品进行梯度稀释后,采用平板倾注法,37 ℃恒温培养48 h,测定所得产品的乳酸菌活菌数。
1.2.6 蛋白质含量测定 采用聂昌宏等[19]的方法并稍作修改,用考马斯亮蓝G-250法测定所得产品的蛋白质含量。取0.15 mL样品与0.85 mL超纯水,震荡摇匀,加入5 mL考马斯亮蓝G-250溶液,充分混合,反应2 min后,在595 nm处测定吸光值。将结果与标准曲线(y=0.0064x+0.1068,R2=0.9955)进行对比,最终得到藜麦酸奶的蛋白质含量。
1.2.7 多酚含量测定 提取方法:采用醇提法提取藜麦酸奶中总多酚,2.5 g藜麦酸奶与4 mL 60%乙醇混合,涡旋振荡使之均匀混合,在60 ℃条件下避光水浴30 min。结束后在5000 r/min离心3 min,弃去沉淀,上清液为所提取总酚。锡纸包裹,4 ℃低温保藏备用。
多酚测定方法:采用闫利萍等[20]的方法并稍作修改,使用福林酚法测定。取50 μL预先提取好的样品,与1 mL超纯水,125 μL福林酚试剂混合均匀,静置避光反应8 min,再加入375 μL 7.5%的Na2CO3溶液和950 μL超纯水使体系达到2.5 mL,避光反应2 h,在765 nm处测定吸光值,将结果与标准曲线(y=2.1013x−0.0088,R2=0.994)进行对比,最终得到藜麦酸奶的总酚含量。
1.2.8 黄酮含量测定 黄酮提取方法同多酚提取。
黄酮含量测定:采用丁润梅等[21]的方法并稍作修改,使用亚硝酸钠-氯化铝法测定。取250 μL预先提取好的样品与1.1 mL 0.45%亚硝酸钠溶液震荡混匀,反应5 min,体系与150 μL10%的氯化铝溶液震荡混匀,反应5 min,再加入2%氢氧化钠溶液1 mL,充分混匀避光反应6 min,在510 nm处测定吸光值,将结果与标准曲线(y=0.7416x+0.032,R2=0.9915)进行对比,最终得到藜麦酸奶的总黄酮含量。
1.2.9 有机酸含量测定 样品前处理参照王雪艳[22]方法稍作修改,准确称取2.500 g藜麦酸奶,10000 r/min离心10 min,上清液与丙酮1:1混合,震荡提取1 min,使蛋白质充分沉淀,10000 r/min离心10 min,取上清液过0.22 μm有机滤膜后进行色谱分析。
色谱条件参照李维妮等[23]的方法,采用高效液相色谱法。
1.2.10 香气成分富集及测定 香气富集参照葛武鹏等[24]的方法稍作修改,香气成分富集采用顶空固相微萃取(head-space solid phase microextraction,HSSPME)。准确称取5.00 g酸奶,加入5 mL超纯水、2.00 g氯化钠、15 μL 0.0409 mg/mL的2-辛醇,均匀混合。在45 ℃条件下平衡30 min,插入经老化的萃取头进样瓶中,顶空吸附30 min,之后解析测定。
色谱条件及质谱条件均参照李维妮等[23]的方法。
定性和定量方法:定性分析:选取色谱图中各个物质峰,匹配NIST 14数据库中各物质的保留时间,选择匹配度大于85的物质作为有效的香气成分。定量分析:各物质峰面积比等于物质浓度比。选择各物质的保留峰面积,对比2-辛醇的出峰面积,计算每种香气成分的相对含量,每个样品重复3次取平均值。
1.3 数据分析
所有实验数据平行进行三次,使用Minitab 18、软件SPSS 20.0对实验数据进行方差分析等,使用Excel进行基础算术计算,使用origin 95进行图表绘制。
2 结果分析
2.1 最佳菌种配比
三种乳酸菌的9种随机配比组合及指标测定结果如表4所示。由表4可以看出,第3组菌种配比的藜麦酸奶持水力最高,第5组最低,两组差值接近10%;各组配比中,第1组酸度最高,达到80.27 °T,而第8组酸度最低,仅为55.84 °T;9组配比的感官评分均在67.2~74.4分之间,其中第5组感官评分最高,第8组感官评分最低;就硬度和稠度而言,均为第4组最优,而第9组品质较差;第5组配比的活菌数最优,达到2.63×108CFU/mL,远高于其他配比组别,而第1组和第2组的配比下,活菌数含量较少。
采用主成分分析法对酸奶的6个指标进行综合考量,利用软件SPSS 20.0对数据进行标准化处理,结果如表5、表6可知。提取主成分特征值、贡献率与累计贡献率如表5所示。
由表5可知,提取两个主成分的累计方差贡献率达87.663%,说明提取两个主成分即可代表藜麦酸奶的大部分信息。
表6 中是藜麦酸奶各指标的特征向量,各个值的高低可反映对应指标在主成分中的重要程度。由表6中信息可知,主成分1主要综合了稠度、硬度和酸度,贡献值分别达到0.949、0.935和0.902;主成分2为活菌数,贡献值达到0.931。根据矩阵系数和标准化后的数据可得到两个主成分的得分函数表达式:
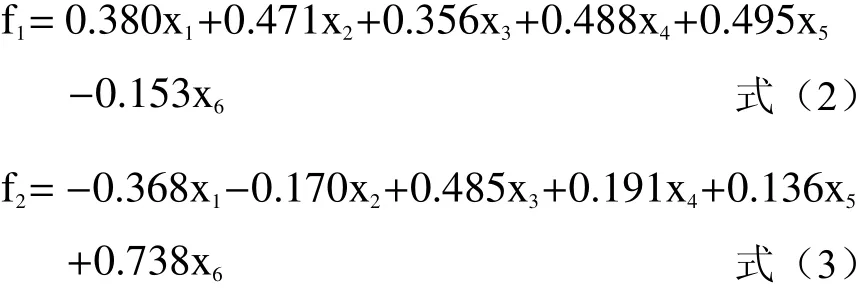
以每个主成分对应特征值的方差贡献率作为权重建立综合评价模型,表达式为:
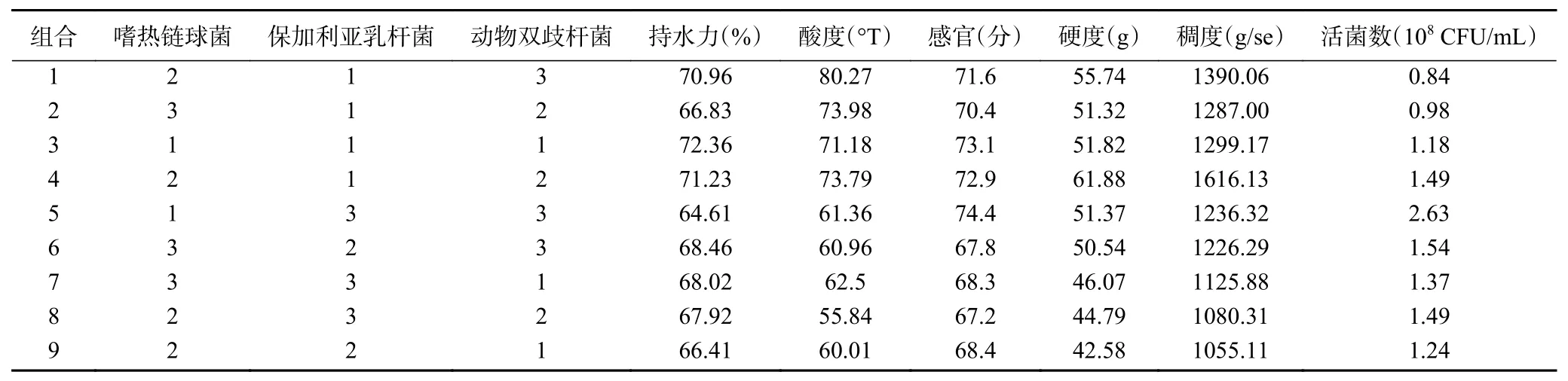
表 4 藜麦酸奶不同菌种配比试验Table 4 Experiments on the different proportions of quinoa yoghurt strains
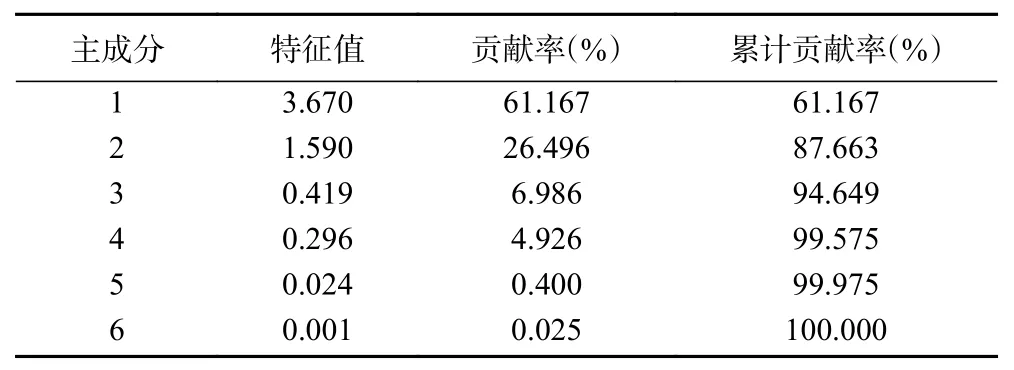
表 5 提取主成分特征值及贡献率Table 5 Extraction of principal component eigenvalues and contribution rate
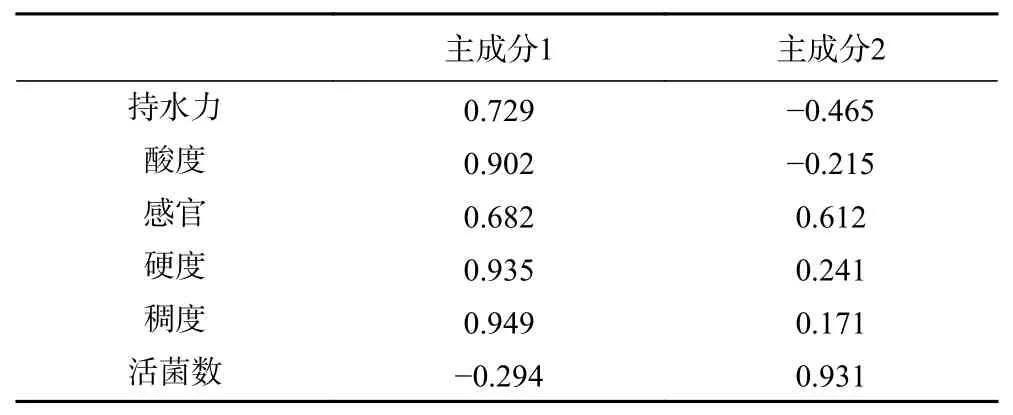
表 6 主要指标的特征向量Table 6 Eigenvectors of principal components

式中,x1~x6—标准化值;An—第n主成分特征向量对应相关系数;γn—第n主成分的特征值,由表5知γ1=3.67,γ2=1.59;α1—第n因子得分;F—综合评价指标。由此计算出9组随机试验藜麦酸奶产品的综合得分和排序结果如表7所示。
由表7可知,第4组综合评分最高,为6.96分,对应至表4中的菌种配比为嗜热链球菌:保加利亚乳杆菌:动物双歧杆菌=2:1:2,故该组合为最佳菌种配比组合。
2.2 单因素实验结果
由于主成分分析结果表明,主成分1贡献率最高为61.167%(主成分2为26.496%),且主成分1中稠度、硬度和酸度贡献值较大,分别为0.949、0.935和0.902;又因质构指标中酸奶的稠度和硬度趋势一致,硬度越大,稠度越大。因此,选择稠度和酸度为工艺优化评价指标,评价酸奶品质。
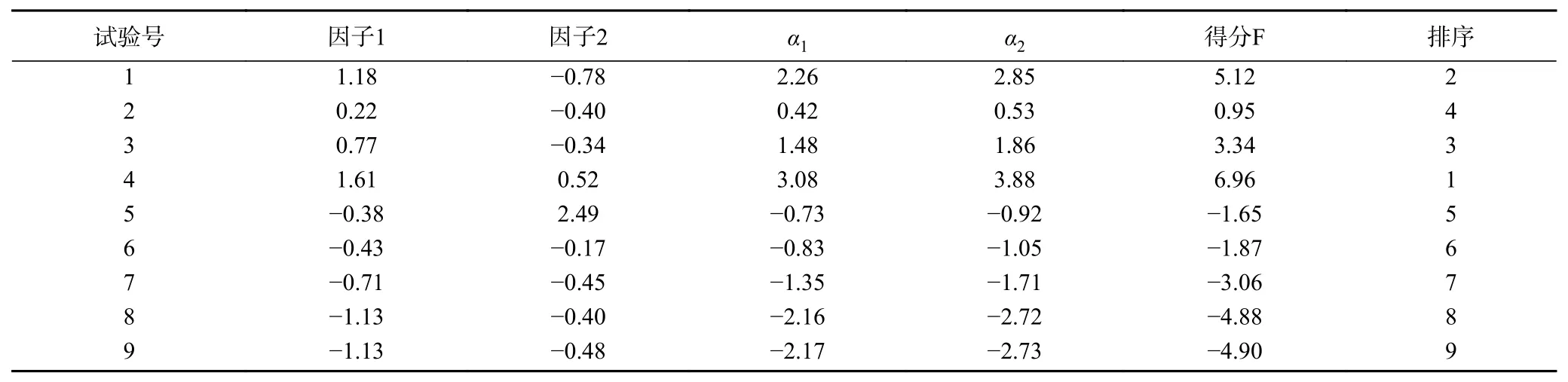
表 7 规格化特征向量及F值Table 7 The standardized eigenvector and F value
2.2.1 接菌量对藜麦酸奶品质的影响 由图2可知,随着菌种添加量的增加,稠度和酸度均呈现先增加有逐渐平稳的趋势。当菌种添加量过低时,藜麦酸奶发酵不充足,产酸不足,所以酸度较低,也因此导致蛋白质凝聚不足,整个酸奶体系不够稳定,粘稠度不足[25]。随着接菌量的增加,藜麦酸奶的酸度和稠度增加到一定程度不再明显变化,主要是由于菌种加入过多后,产酸量过高,会对菌种的生长和代谢造成抑制。结合考虑实际生产的菌种成本,故正交优化试验选择菌种添加量为2%和3%。
2.2.2 藜麦添加量对藜麦酸奶品质的影响 由图3可知,随着藜麦添加量的增大,藜麦酸奶稠度整体呈现下降趋势。当藜麦添加量为3%或5%时,藜麦酸奶的酸度处于较高水平,当藜麦添加量继续增大时,酸度开始下降。因此,正交优化试验选择藜麦添加量为3%、5%。
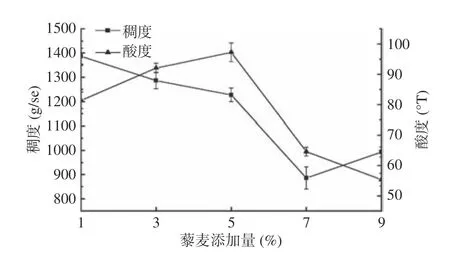
图 3 藜麦添加量对藜麦酸奶品质的影响Fig.3 Effect of quinoa additive amount on the quality of quinoa yogurt
2.2.3 发酵温度对藜麦酸奶品质的影响 由图4可知,随着发酵温度的增加,藜麦酸奶的酸度和稠度均呈现先增加后降低的趋势。当温度达到41 ℃时,藜麦酸奶的酸度和稠度达到较优水平。当温度继续上升后,酸奶品质略微上升后开始下降。当温度过低时,乳酸菌活力不足,酸奶发酵不完全,从而导致藜麦酸奶的稠度和酸度均无法达到要求。而当温度过高后,则会导致发酵过度,出现乳清析出[26]。所以正交优化试验发酵温度为41 ℃和43 ℃。
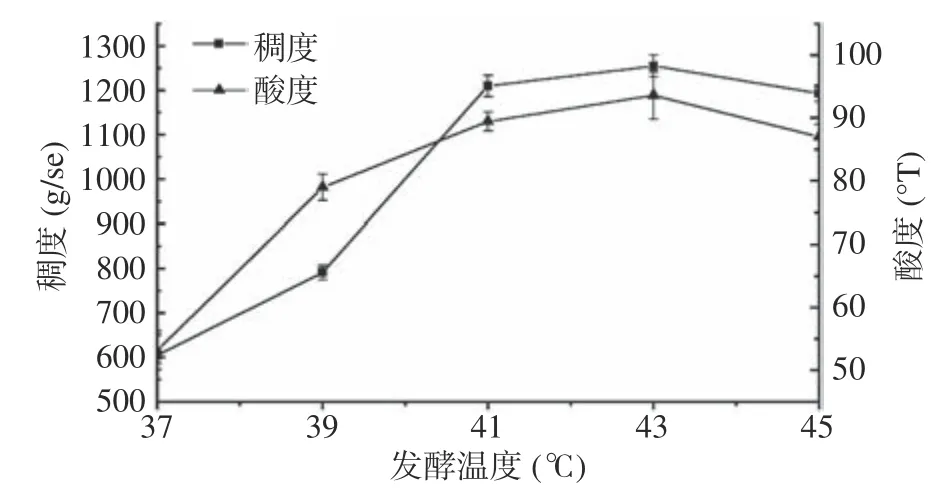
图 4 发酵温度对藜麦酸奶品质的影响Fig.4 Effect of fermentation temperature on the quality of quinoa yogurt
2.3 正交试验
基于单因素实验结果,最终选择正交试验因素水平为:A接种量:2%、3%,B藜麦添加量:3%、5%,C发酵温度:41、43 ℃。
由表8可知,对藜麦酸奶稠度影响因素依次为:B(藜麦添加量)>A(接种量)>AB(藜麦添加量×接种量)>C(发酵温度)。对藜麦酸奶酸度影响因素依次为:B(藜麦添加量)>BC(藜麦添加量×发酵温度)>C(发酵温度)>A(接种量)。由表9可知,藜麦添加量对藜麦酸奶的稠度影响显著。由表10方差分析结果,藜麦添加量对藜麦酸奶的酸度影响极显著,接种量、藜麦添加量×发酵温度以及三个因素的交互作用均对藜麦酸奶酸度影响显著。综上,选择最优水平为藜麦添加量为5%,接种量为2%。由于藜麦添加量与发酵温度对藜麦酸奶酸度影响排在第二位是较重要的因素,为考虑他们的搭配问题,因此列出B、C二元表。
由此表11可以看出,B2C1所对应的藜麦酸奶酸度值最大,为最优搭配。再结合以稠度为指标选取B2水平最优,最终确定藜麦酸奶生产工艺中发酵温度为41 ℃。
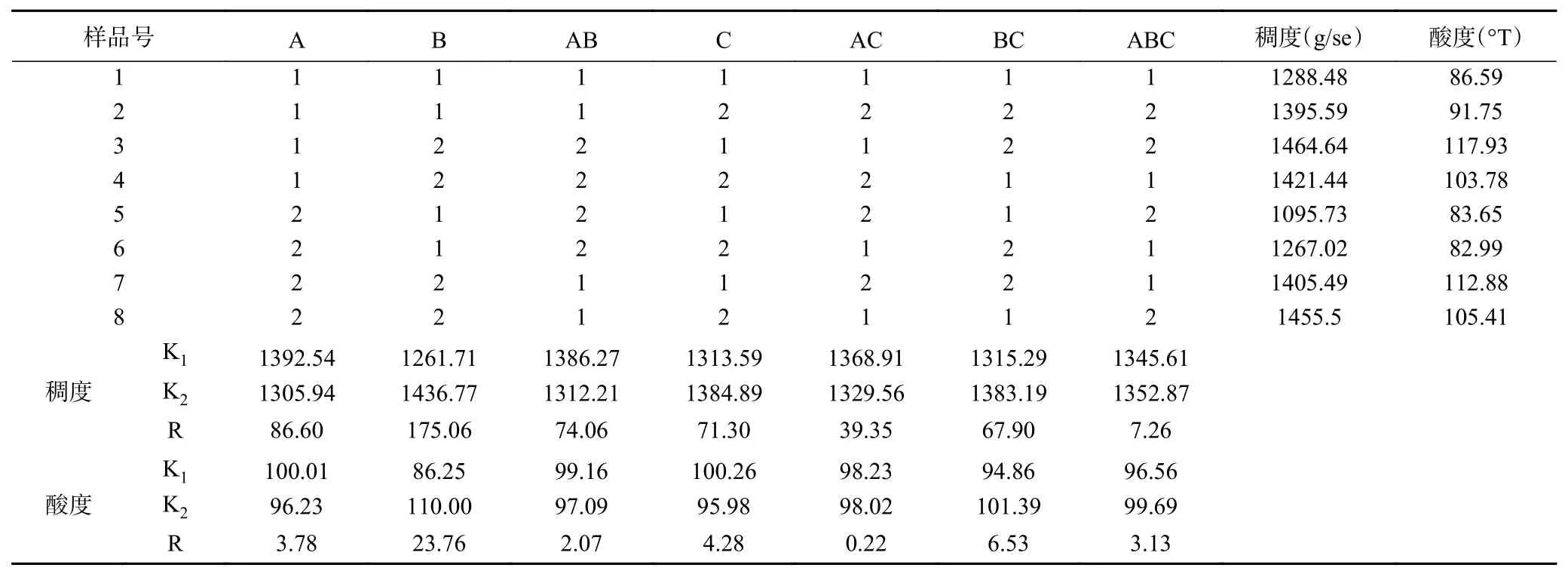
表 8 L8(27)正交试验表及极差分析结果Table 8 L8 (27) orthogonal experimental and range analysis results

表 9 藜麦酸奶稠度的方差分析Table 9 Variance analysis on consistency of quinoa yogurt
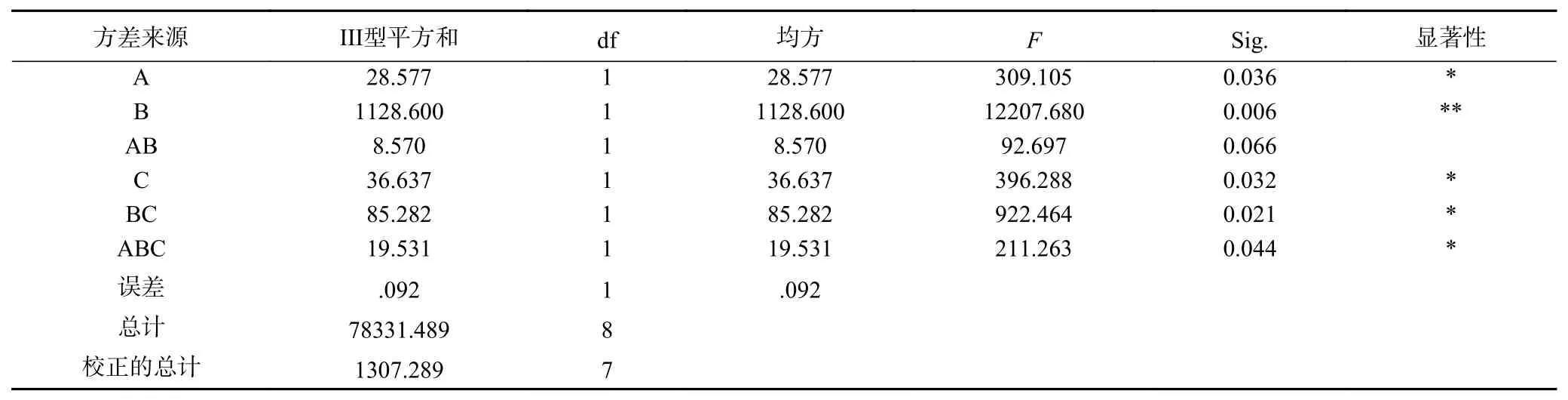
表 10 藜麦酸奶酸度的方差分析Table 10 Variance analysis on acidity of quinoa yogurt
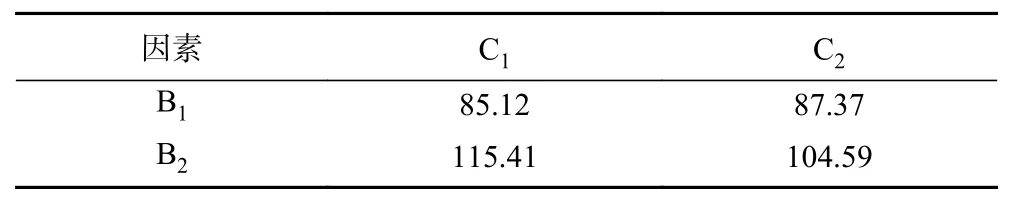
表 11 酸度B、C二元表Table 11 B-C binary table of acidity
综合分析后,最终确定藜麦酸奶的工艺参数为发酵剂添加量2%(v/v),挤压膨化藜麦粉添加量5%(w/v),发酵温度41 ℃;添加7%(w/v)蔗糖和0.1%(w/v)琼脂,发酵7 h,并于4 ℃条件下后熟12 h即为藜麦酸奶成品。
2.4 营养评价
由图5可知,藜麦的加入使得酸奶营养品质极显著提高。图5a为藜麦酸奶和纯酸奶中多酚和黄酮含量的对比,藜麦酸奶中多酚含量为0.16 mg没食子酸/g,比纯酸奶中(0.06 mg没食子酸/g)提高了166.67%。目前在藜麦中已经发现20多种游离的或共轭形式的酚类化合物,主要为酚酸及其衍生物,以及槲皮素、山奈酚等黄酮类化合物及其糖苷[2,27]。藜麦酸奶中黄酮含量为0.50 mg芦丁/g,比纯酸奶中(0.13 mg芦丁/g)提高了284.62%。李多[28]对藜麦糠的成分进行分析,发现藜麦糠中黄酮含量为8.02±0.02 mg/g,略高于多酚含量,与本实验中黄酮含量高于多酚含量结论一致。图5b为蛋白质含量的对比,藜麦酸奶中蛋白质含量为3.19 μg/mL,纯酸奶中蛋白质含量为1.69 μg/mL,提高了88.67%。
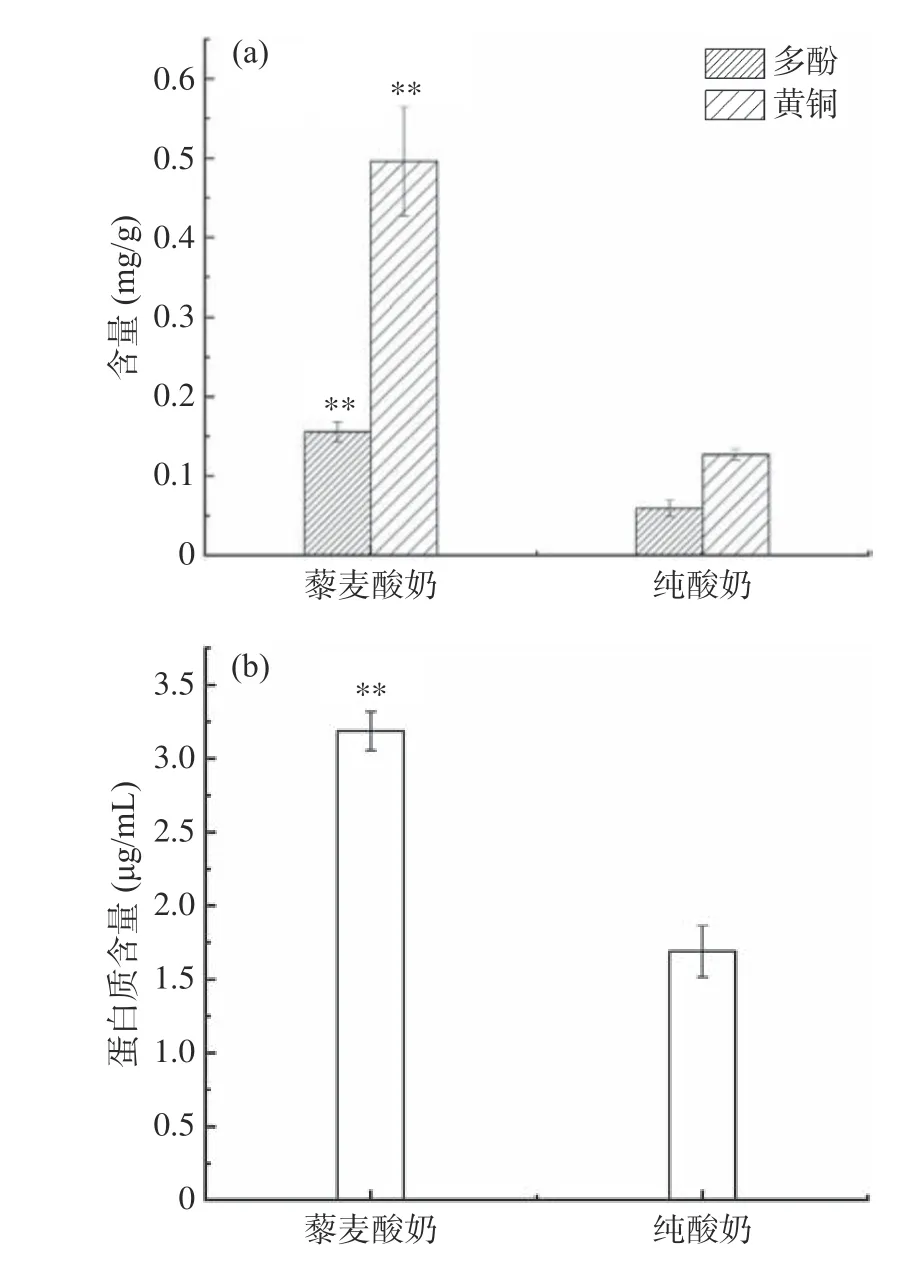
图 5 藜麦酸奶营养成分Fig.5 Nutritional content of quinoa yogurt
2.5 发酵、后熟和贮藏期活菌数及酸度变化
接入混合菌种的第0~7 h为酸奶的发酵期,于41 ℃条件下进行;第7~19 h为后熟期,之后的21 d为酸奶的贮藏期,均在4 ℃条件下进行。
由图6a可知,在整个发酵时期,藜麦酸奶和纯酸奶的酸度增长较快,发酵期结束时,两种酸奶的酸度均已达到70 °T,符合国家标准[29]。当进入后熟期后,两种酸奶酸度仍呈现增长趋势,但增长速率明显减缓。当进入贮藏期时(图6b),两种酸奶的酸度均出现继续增长的现象,主要是由于酸奶在4 ℃条件下低温贮藏,乳酸菌仍具有活力,继续生长繁殖,利用残糖发酵产生乳酸,使得酸度继续升高,这一过程为后酸化[30]。从发酵开始到贮藏21 d结束的整个过程中,藜麦酸奶的可滴定酸度均高于纯酸奶,膨化藜麦粉的存在使得牛奶的基质组成的变化影响了有机酸的分布,尤其是乳酸的含量,可滴定酸度更高[31]。
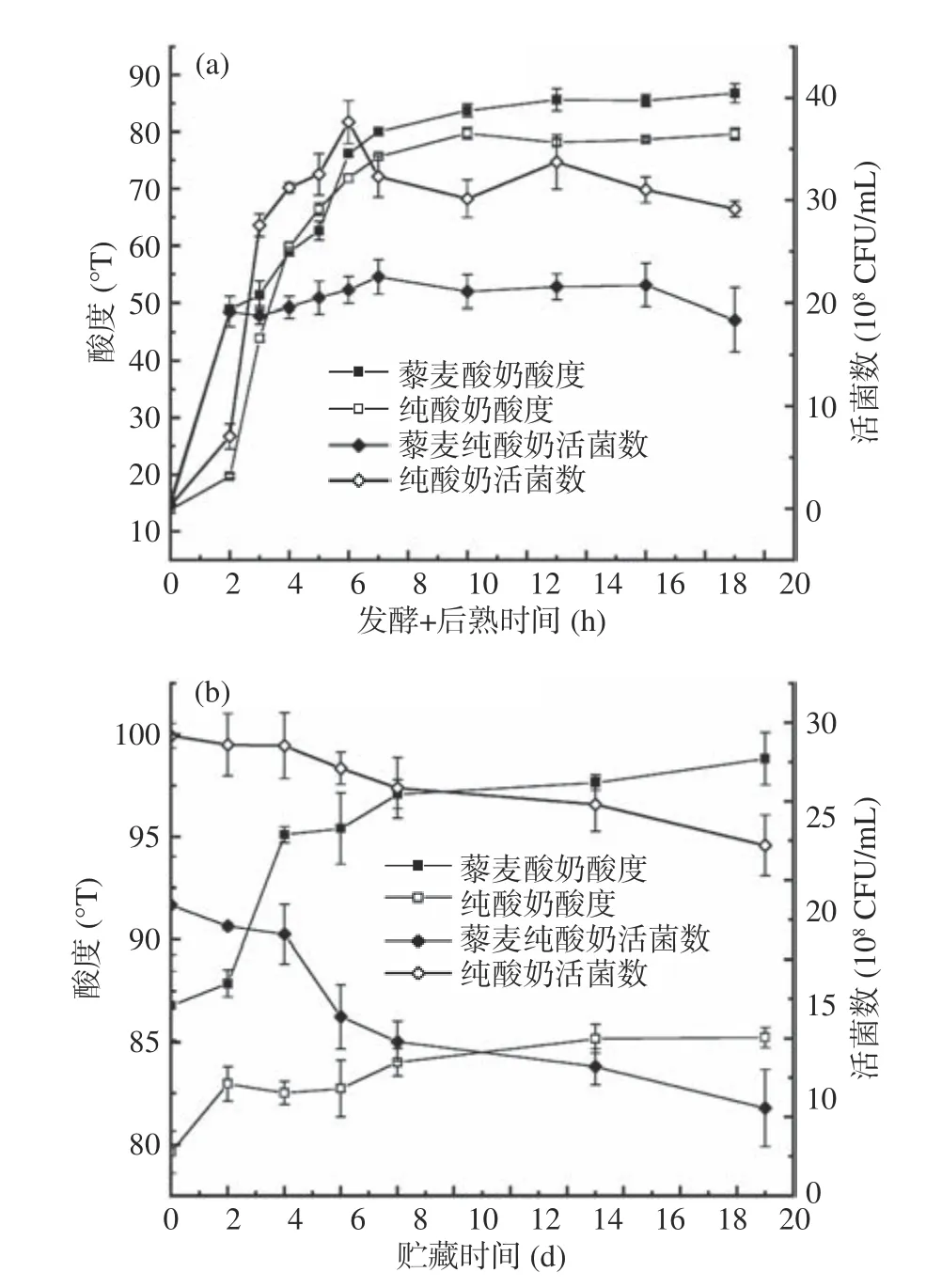
图 6 藜麦酸奶活菌数及酸度动态监测Fig.6 Dynamic monitoring of viable cell count and acidity of quinoa yogurt
在发酵期和后熟期内,两种酸奶的活菌数变化趋势与酸度相似。进入贮藏期后,两种酸奶的活菌数均开始下降,这主要是由于乳酸菌对生存环境和底物的竞争,使得活菌数量开始减少。从发酵第2 h开始,直到贮藏21 d结束,藜麦酸奶的活菌数始终低于纯酸奶。分析由于藜麦粉的添加引起发酵基质缓冲特性的改变,进而引起碳水化合物组成的变化,从而使菌种的发酵性能受到抑制[31]。本实验中,挤压膨化藜麦粉的加入可能改变了牛奶基质的缓冲性能,增加了牛奶的稠度,因此对乳酸菌的生长造成一定影响。此外,在贮藏期内,随着酸度的增加,乳酸菌活菌数下降[32],并且保加利亚乳杆菌产生的H2O2会对酸奶中的其他乳酸菌造成伤害,进而使得乳酸菌活菌数下降[33]。值得注意的是,即使经过了21 d贮藏,藜麦酸奶活菌数有所下降,但是仍高于国家标准所要求的106CFU/mL[29]。
2.6 有机酸含量
由表12可知,藜麦酸奶中的乳酸和乙酸含量均高于纯酸奶,甲酸和丙酮酸含量均低于纯酸奶,其中两种酸奶中的乳酸和甲酸含量差异达到极显著水平。由于膨化藜麦粉的加入,使得发酵体系中碳水化合物含量增多,乳酸菌可利用底物增多,因此乳酸和甲酸含量提高。但是,乳酸菌发酵过程中,丙酮酸作为代谢的中间产物,只有较少量被留下,其他大部分都作为底物参与下一级代谢,因此含量较低。乙酸主要是由双歧杆菌通过双歧途径发酵葡萄糖的产生的,而双歧杆菌产乙酸的能力与生长温度(最佳温度为35~37 ℃)及生长时间(最佳时间为10~18 h)相关。本研究中,发酵温度相对较高(41 ℃),且发酵时间较短(7 h),可能共同导致乙酸产量的降低,与Østlie等[34]的研究结论一致。也有研究表明,嗜热链球菌通过代谢产生大量乳酸和少量甲酸、乙酸[35],也进一步刺激并促进保加利亚乳杆菌的生理活性,使其生理代谢收到促进,从而加快多糖的产生以及香气物质的形成。
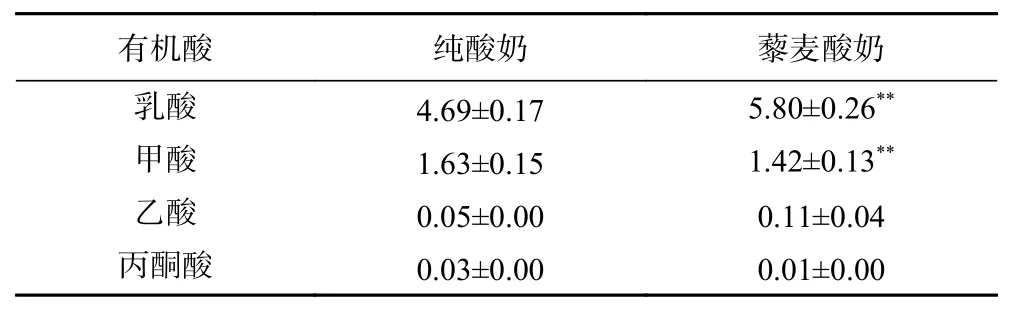
表 12 藜麦酸奶中四种有机酸含量对比(mg/g)Table 12 Comparison of four organic acids in quinoa yogurt (mg/g)
2.7 风味成分分析
由表13和表14可知,藜麦酸奶中检测出74种挥发性物质成分,超过纯酸奶的44种。藜麦酸奶中主要的挥发性风味物质为2,3-丁二酮、2-(1-甲基乙氧基)-乙醇、D-柠檬烯、3-甲基-1-丁醇、2-庚酮、2,2,4-三甲基戊烷等。其中2,3-丁二酮具有强烈的奶油、焦糖香气,并带有坚果底香,D-柠檬烯散发出令人愉悦的柠檬香气,2-庚酮有奶油香气[36]。在检测到的74种挥发性风味物质中,藜麦酸奶中的乙醛、乙醇、2-丁酮、乙酸、2-(1-甲基乙氧基)-乙醇、乙酸正丙酯、2-甲基-1-丁醇、乙酸丁酯、4-甲基-1-戊醇、3-甲基-1-丁醇乙酸酯与乙酸苯乙酯含量均低于纯酸奶,其余挥发性风味物质含量均高于纯酸奶。
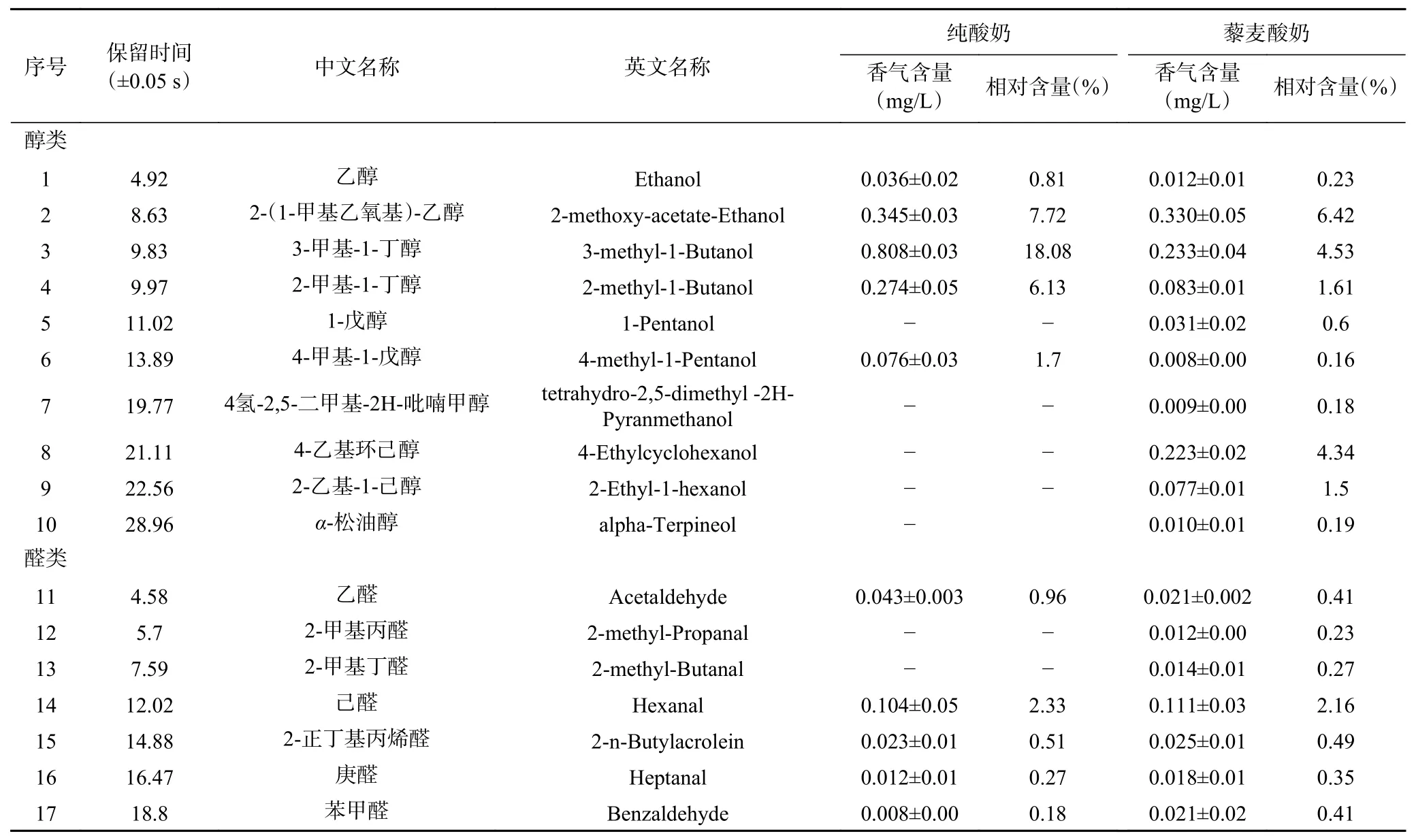
表 13 藜麦酸奶中挥发性风味物质种类及含量Table 13 Volatile flavor compounds and contents in quinoa yoghurt
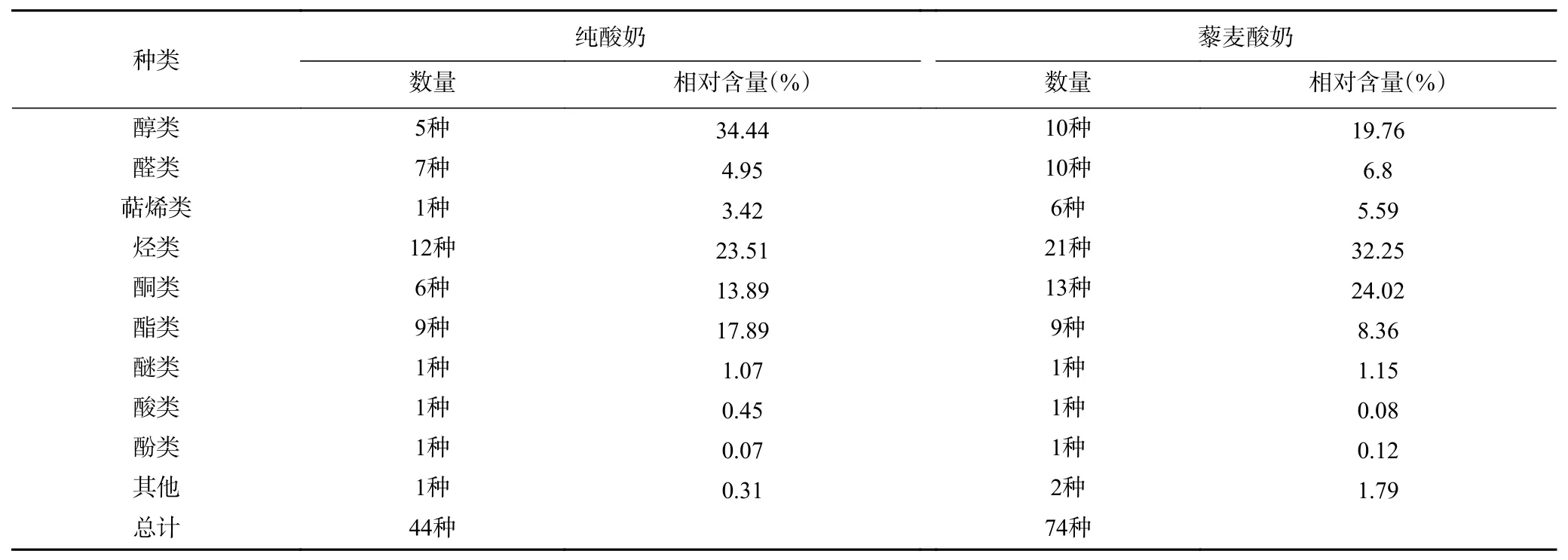
表 14 酸奶中挥发性风味物质分类Table 14 Classification of volatile flavor compounds in yoghurt
采用烘烤、蒸汽热处理和挤压膨化三种方式处理藜麦并分析其挥发性风味物质,确定藜麦的关键性风味物质为苯乙醛、反-2-辛烯醛、壬醛、反式-2-壬烯醛和癸醛[37]。与纯酸奶相比,藜麦酸奶中壬醛的含量显著增加,赋予藜麦酸奶特殊的香气。而酮类物质是由脂肪酸或氨基酸的氧化、降解产生[38],醇类化合物主要通过氨基酸和乳糖代谢、脂肪酸的降解以及甲基酮降解等途径生成[39]。不同的酸类物质和醇类物质酯化组合生成各种酯类物质,具有成熟果香味或坚果味[40]。除乙酸乙酯外,大多数酯类化合物都具有较低的阈值,能够散发较强的香气[41]。
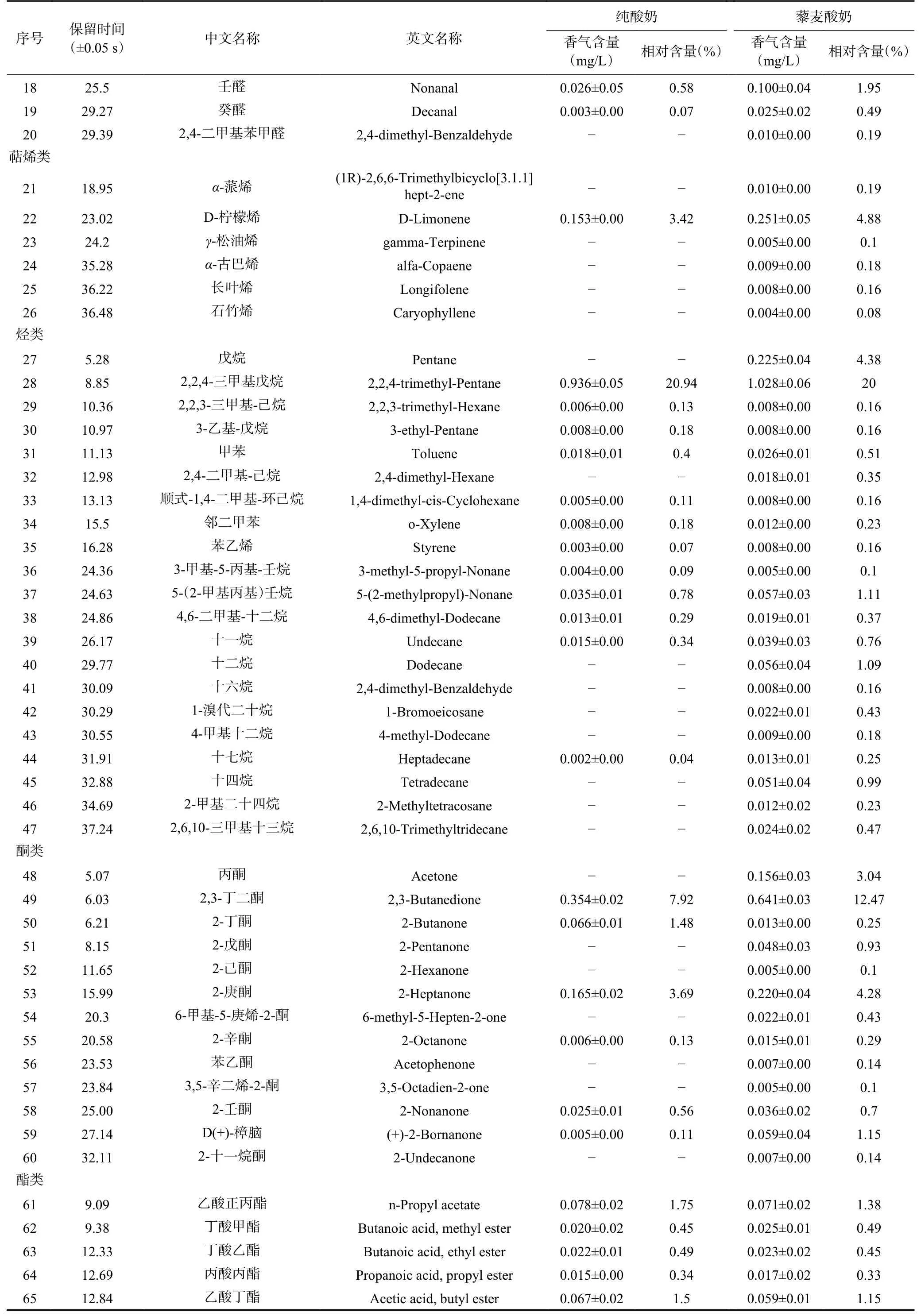
续表 13
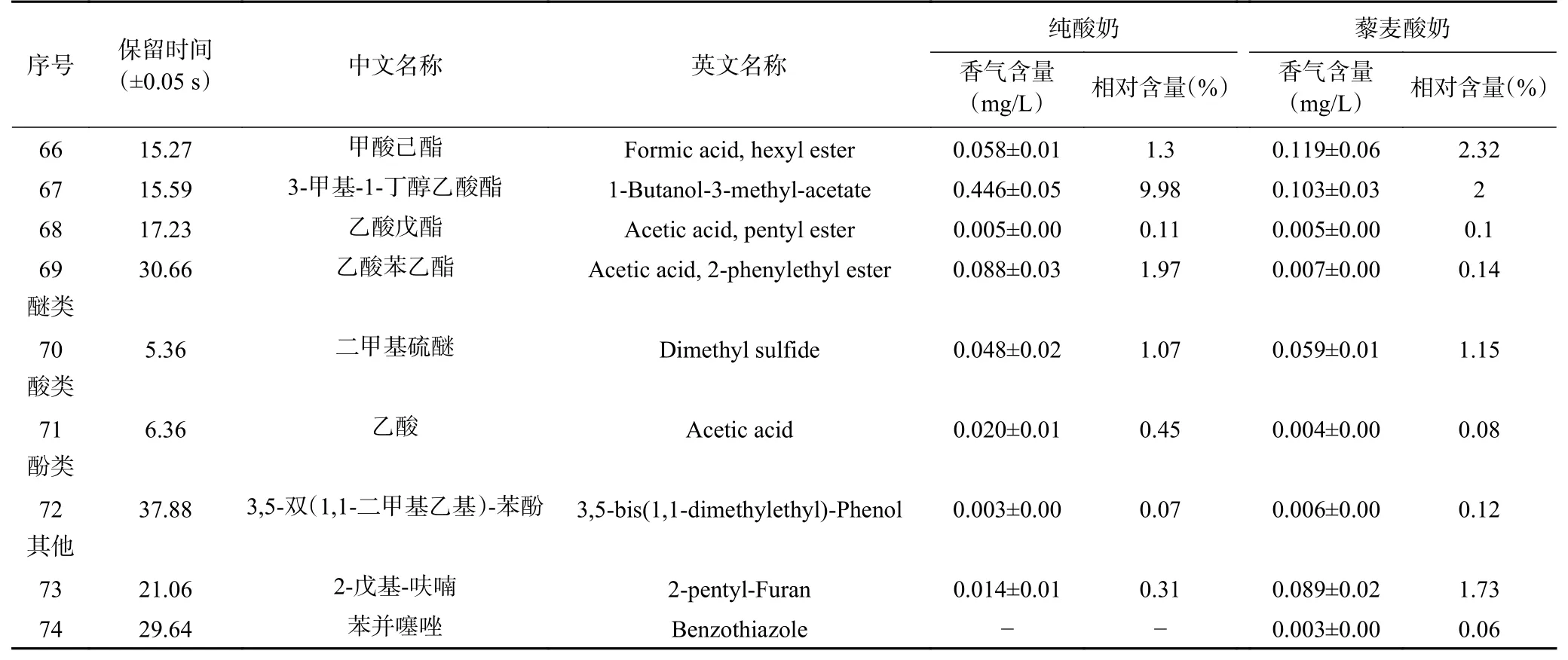
续表 13
3 结论
通过正交试验,确定了藜麦酸奶的最佳生产工艺参数为:发酵温度41 ℃,藜麦添加量5%,接菌量2%,此时藜麦酸奶稠度、酸度均达到较优水平。膨化藜麦粉的添加使得藜麦酸奶营养品质显著提升。21 d低温贮藏期间,藜麦酸奶相比于纯酸奶,酸度更高而活菌数更低。经GC-MS检测分析,藜麦酸奶比纯酸奶多了30种新产生的风味物质,其中包括D-柠檬烯、α-派烯、γ-松油烯、α-古巴烯、长叶烯和石竹烯六种植物源萜烯烃化合物以及α-松油醇等。综上,膨化藜麦粉的加入使得酸奶在营养和风味方面具有一定优势。因此,可对藜麦酸奶进一步开发与应用,丰富藜麦产品多样性,扩大藜麦市场。

