芸豆酵素发酵过程中组分及抗氧化功能研究
王 迪,王 颖,2,3,4, ,张艳莉,佐兆杭,刘淑婷,张 裕,李志芳
(1.黑龙江八一农垦大学食品学院,黑龙江大庆 163319;2.国家杂粮工程技术研究中心,黑龙江大庆 163319;3.粮食副产物加工与利用教育部工程研究中心,黑龙江大庆 163319;4.黑龙江省农产品加工与质量安全重点实验室,黑龙江大庆 163319)
现如今越来越多消费者追求营养的多样性、易于吸收性和平衡性,酵素发酵饮料作为新型功能性食品逐渐被大众喜爱。食用酵素是以一种或多种新鲜果蔬、豆谷类、药食两用食材等为原料,经多种益生菌发酵制得的富含酶、益生菌、矿物质和次生代谢产物等营养成分的功能性微生物发酵产品[1−2],具有解酒护肝[3−4]、美白抗氧化[5−7]、降糖降脂[8−10]等功效。
芸豆(Phaseolus vulgarisLinn)学名菜豆,属蝶形花科的小宗杂粮作物[11],是栽培面积仅次于黄豆的豆类农作物[12]。芸豆富含蛋白质、维生素、皂苷等营养成分,芸豆膳食纤维[13]、山奈酚[14−15]、槲皮素[16]可持续性调控机体糖代谢紊乱,改善胰腺组织内质网应激及线粒体功能,维持血糖水平稳态。芸豆抗性淀粉[17]、α-淀粉酶抑制剂[18]可以降低高脂血症大鼠血脂代谢水平,改善氧化应激并调控肠道微生物平衡。黄酮类化合物对心血管疾病[19−20]、癌症[21−22]等老年疾病有积极的预防、缓解和治疗作用。芸豆提取物还具有补肾利气、抗炎抑菌[23−24]、利水消肿等多种功效,是开发功能性食品的优质原料。
基于芸豆主要以鲜食为主,存在加工形式及企业较少、综合利用程度差等问题,同时目前鲜见复合益生菌发酵芸豆酵素的研究,其代谢产物及抗氧化能力亦没有报道。监测发酵体系代谢产物及抗氧化活性,是反映芸豆酵素发酵进程、产品品质和营养价值的重要依据。因此,本文以芸豆酵素为研究对象,研究不同发酵时间代谢产物变化规律,分析其抗氧化能力,为芸豆高值利用及精深加工产业链提供新思路,同时为综合开发兼具芸豆和益生菌营养保健价值的芸豆酵素产品提供理论依据。
1 材料与方法
1.1 材料与仪器
紫花芸豆 黑龙江省黑河市;白砂糖 市售;安琪牌活性干酵母 湖北安琪酵母股份有限公司;植物乳杆菌(Lactobacillus plantarum) 东北农业大学菌库;嗜酸乳杆菌(Lactobacillus acidophilus) 中国工业微生物菌种保藏中心;耐高温α-淀粉酶(20000 U/mL)、糖化酶(10000 U/mL) 上海源叶生物科技有限公司;2,4,6-三吡啶基三嗪(TPTZ) 北京中生瑞泰科技有限公司;2,2-联氮-二(3-乙基-苯并噻唑-6-磺酸)二铵盐(ABTS) 美国Sigma公司;葡萄糖、氯化铁、氢氧化钠、福林酚(10%)、碳酸钠、3,5-二硝基水杨酸、亚硝酸钠、硝酸铝、无水乙醇 国产分析纯试剂。
BS224S电子天平 赛多利斯科学仪器有限公司;JYL-Y912料理机 九阳股份有限公司;S220 pH计 瑞典波通仪器公司;DGG-9023A电热鼓风干燥箱 上海森信实验仪器有限公司;V-5100B可见分光光度计 上海元析仪器有限公司;HH-1S数显电热恒温水浴锅 上海达洛科学仪器有限公司;DRP-9082电热恒温培养箱 上海培因实验仪器有限公司;YXQ-30SII立式压力蒸汽灭菌器 济南捷岛分析仪器有限公司;H1850R冷冻离心机 湖南湘仪仪器有限公司;BCV-6S1超净工作台 浙江赛德仪器设备有限公司;ATC-32手持式折光仪 上海淋誉贸易有限公司。
1.2 实验方法
1.2.1 工艺流程

1.2.2 菌种的活化与培养 取甘油保存的菌液100 μL于MRS液体培养基中,37 ℃恒温培养24 h,无菌操作台中划线接入MRS固体培养基中培养(37 ℃,24 h),连续接种3代,使其充分活化。挑取斜面培养基生长较好菌落接种至液体培养基中培养(37 ℃,24 h),摇匀后移取10%(v/v)菌液至液体培养基(37 ℃,24 h),得到扩大培养的乳酸菌菌悬液,待用。活性干酵母于10倍体积蒸馏水中溶解,30~35 ℃恒温水浴锅中活化30 min,待用。
1.2.3 芸豆酵素的制备 紫花芸豆清洗后去皮,按1:3(g/mL)料水比打浆。双酶法进行水解,液化条件:α-淀粉酶添加量200 μL/100 mL、pH6.0、酶解温度97 ℃、时间20 min;糖化条件:加酶量200 μL/100 mL、pH4.5、温度60 ℃、时间30 min。酶解液于高速离心机中以1.0×104r/min离心15 min,得到芸豆清汁。调清汁pH4.0,添加6%白砂糖后灭菌。接种0.2%酵母菌于32 ℃恒温振荡预发酵24 h,再接种3%复配乳酸菌(植物乳杆菌:嗜酸乳杆菌=1:1)32 ℃恒温发酵24 h。4 ℃后发酵并保藏。分别在发酵0、8、16、24、32、40、48、56 h时取样,离心后取上清液,待测。
1.2.4 pH和总酸含量的测定 采用精密pH计测定不同发酵时间的芸豆酵素的pH。参考GB/T 12456-2008《食品中总酸的测定方法》测定各样品总酸含量。
1.2.5 还原糖含量的测定 采用3,5-二硝基水杨酸法进行测定[25]。取0.05、0.01、0.15、0.20、0.25、0.30 mL葡萄糖标准溶液(1 mg/mL)于10 mL试管中,去离子水补至1 mL,加入3 mL DNS试剂,混匀后在沸水浴中加热5 min,冷却后定容至10 mL,室温放置30 min,去离子水作为空白对照,520 nm下测定吸光度,绘制标准曲线。取稀释待测液,按照标准曲线步骤测定吸光度,根据标准曲线线性方程y=0.1218x−0.1523,R2=0.9952计算发酵液中还原糖含量(以葡萄糖计)。
1.2.6 可溶性固形物的测定 使用折光仪测定各样品可溶性固形物含量。打开进光板,用柔软绒布将折光棱镜擦拭干净。将蒸馏水数滴,滴在折光棱镜上,轻轻合上进光板,使溶液均匀分布于棱镜表面,并将仪器进光板对准光源或明亮处,调整明暗分界线置于零位。擦净蒸馏水,取一滴芸豆酵素溶液代替蒸馏水滴于折光棱镜上,记录视场相应刻度值。
1.2.7 总酚含量的测定 采用Folin-Ciocalteus法测定[26],200 μL样品溶液与0.5 mL福林酚混匀,加入2.3 mL去离子水,放置1 min后加入7.5%(g/mL)碳酸钠溶液2 mL,混匀,室温下暗反应2 h。测定760 nm波长下的吸光度值,去离子水代替样品作为空白对照。没食子酸(0~250 μg/mL)标准溶液的线性回归方程为y=0.0045x−0.0022(R2=0.9905)。
1.2.8 黄酮含量的测定 采用NaNO2-Al(NO3)3比色法测定[27]。取500 μL待测发酵液,加入5% NaNO2溶液150 μL,摇匀静置6 min。加入10% Al(NO)3溶液150 μL,摇匀静置6 min。再加入4% NaOH溶液2 mL,95%乙醇定容,摇匀静置15 min,510 nm处测吸光值。
1.2.9 抗氧化活性的测定
1.2.9.1 还原力的测定 参照武悦等[28]的方法制备FRAP试剂。1 mL发酵原液与5 mL FRAP试剂混合,37 °C水浴中反应10 min,以去离子水为空白对照,于593 nm处测定吸光度值。FeSO4(0~50 μmol/L)标准溶液的线性回归方程为y=0.0307x−0.0132(R2=0.9975)。
1.2.9.2 ABTS+自由基清除能力的测定 参照白海娜等[29]的方法制备ABTS溶液,1.5 mL酵素原液中加入1.5 mL ABTS溶液,蒸馏水代替ABTS溶液作为对照管,蒸馏水代替酵素原液作为空白管,室温避光放置6 min,734 nm测定其吸光度,计算公式如下:
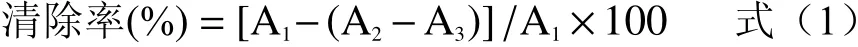
式中:A1:1.5 mL ABTS溶液与1.5 mL蒸馏水的吸光度值;A2:1.5 mL ABTS溶液与1.5 mL酵素原液的吸光度值;A3:1.5 mL酵素原液与1.5 mL蒸馏水的吸光度值。
1.3 数据处理
2 结果与分析
2.1 pH和总酸含量的变化
pH是衡量发酵过程是否正常的重要条件,酸度是衡量酵素成熟度及发酵液品质的主要指标之一[30]。由图1可知,发酵液pH随着发酵时间的延长而不断降低,总酸含量则逐渐升高。经48 h发酵,芸豆酵素pH由4.01降低至3.44,总酸含量从发酵初期0.03 g/100 mL至后期增涨至0.57 g/100 mL。发酵前期总酸含量增幅明显,分析原因该阶段酵母菌大量增殖,在厌氧条件下利用发酵液中的糖原产生CO2及乙醇,部分CO2溶于发酵液,同乳酸作用,降低发酵液pH的同时增加总酸含量。接种乳酸菌后其分泌酶水解发酵液中碳源为单糖后进一步利用产生大量乳酸、苹果酸等有机酸,导致发酵液pH持续降低,总酸含量稳定增长。芸豆酵素发酵56 h时,发酵液营养物质基本被完全消耗,乳酸菌利用有机酸作为代替碳源来维持自身增殖代谢等生物过程,使得总酸含量小幅度升高。发酵体系含多种有机酸,可抑制部分有害菌的生长,同时形成了芸豆酵素的独特风味[31]。
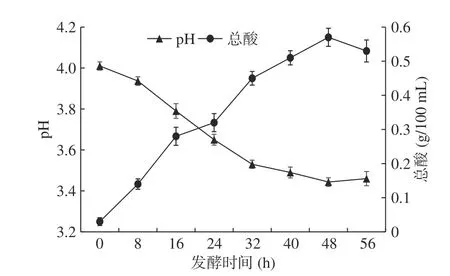
图 1 芸豆酵素发酵过程中pH、总酸含量变化Fig.1 Changes of pH and total acid content in the fermentation process of kidney bean Jiaosu
2.2 还原糖含量与可溶性固形物含量的变化
糖作为碳源是微生物发酵的重要营养物质,其含量的变化是反应酵素液中微生物活动情况的指标之一[32]。由图2所示,还原糖含量仅在前8 h呈现上升趋势,而后随着发酵时间的延长而不断降低。这可能是由于发酵初期优势菌种酵母菌在蔗糖酶的作用下将蔗糖转化为果糖和葡萄糖,使发酵液中还原糖含量增加。发酵8~24 h时,还原糖含量下降较快,该阶段酵母菌已适应此时发酵环境,大量的葡萄糖和果糖被利用生成乙醇用于代谢生长。发酵液中果糖等游离糖利于乳酸菌等厌氧微生物增殖生长,接种乳酸菌其自身分泌β-半乳糖苷酶等水解酶分解乳糖成葡萄糖和半乳糖,并通过糖酵解等代谢途径将葡萄糖转化成乳酸,还原糖逐渐减少。发酵48 h时,还原糖含量为3.55 mg/mL并趋于平缓,证明发酵已基本结束。
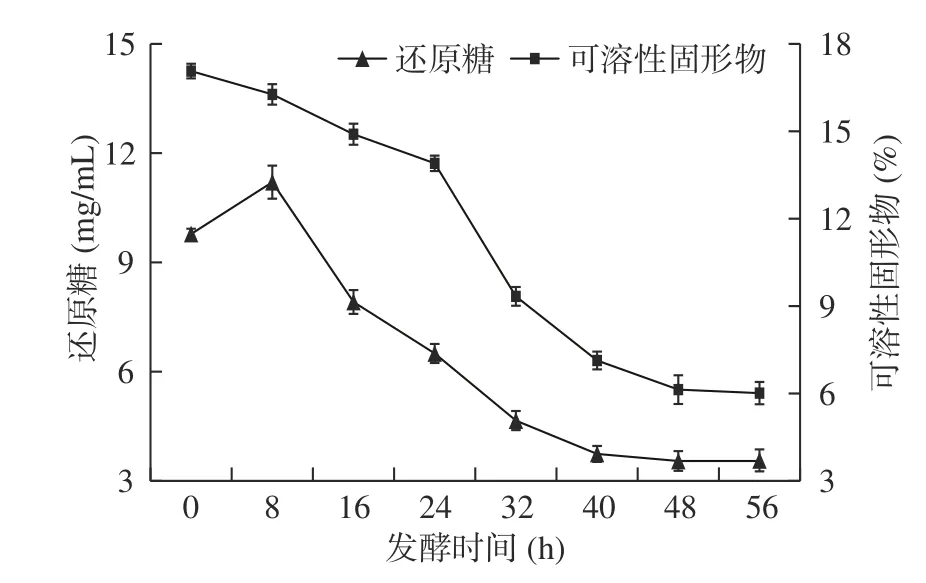
图 2 芸豆酵素发酵过程中还原糖、可溶性固形物含量变化Fig.2 Changes of reducing sugar and soluble solids content in the fermentation process of kidney bean Jiaosu
可溶性固形物含量可较为直观反映发酵液品质,若含量过高,发酵体系渗透压升高易破坏发酵菌种细胞壁及细胞膜特性,导致生长周期停滞或凋亡;含量过低,发酵液口感酸,影响产品风味[33]。由图2可知,芸豆酵素可溶性固形物含量随发酵时间的延长持续下降并趋于稳定,经48 h的发酵,发酵液中可溶性固形物含量由17.07%降低至6.13%,发酵体系环境适宜,营养物质充足,微生物在该阶段迅速繁殖,大量且持续利用碳水化合物,使得芸豆酵素可溶性固形物含量逐渐降低。
2.3 总酚与黄酮含量的变化
芸豆酵素发酵过程中总酚含量的变化见图3。总酚含量在发酵阶段呈先迅速上升后小幅度下降而后继续增长的趋势。杨小幸等[30]研究表明发酵体系中酚类物质含量的变化与发酵原料、发酵工艺条件及微生物种类密切相关。与未发酵清汁相比,发酵24 h的芸豆酵素总酚含量显著增长约1.4倍,分析原因是原料中酚类物质溶出,其一发酵前期发酵液营养物质充足,微生物大量繁殖代谢产生次生代谢产物,这些有机酸及酶类可溶出芸豆中的酚类物质;其二高糖浓度形成高渗透压体系,导致原料大量酚类物质的溶出并呈游离态[34]。发酵32 h时,总酚含量略微降低,可能是由于多酚类物质具有抑菌效果,一定浓度的酚类物质会抑制微生物的生长[35],因此发酵液中优势菌种会产生降解酚类的物质来维持自身正常繁殖代谢。此外,蛋白质可以与多酚类物质的多元氢键和疏水键发生反应,也是可能造成多酚含量下降的因素之一[36]。随着发酵时间的延长,部分微生物逐渐适应发酵环境中的高浓度酚,将一些大分子酚类物质降解为单体酚或小分子量酚类物质[34],发酵56 h时,发酵液总酚含量进一步增长至367.90 mg/mL。

图 3 芸豆酵素发酵过程中总酚、黄酮含量变化Fig.3 Changes of total phenol content and flavonoid content during fermentation of kidney bean Jiaosu
由图3可知,芸豆酵素发酵过程中总黄酮含量呈现持续升高的趋势,由初期30.02 mg/mL迅速上升至56 h的92.31 mg/mL,增涨约3倍且具有显著性差异(P<0.05)。发酵前期优势菌种酵母菌生长代谢旺盛产生乙醇,溶解了大部分不溶或难溶于水的黄酮类物质,造成发酵液黄酮含量的迅速增加。整个发酵过程中,发酵体系中黄酮类物质始终以不同速率累积,一方面,发酵液的高渗环境及微生物的活动致使植物细胞破裂,原料中抗氧化物质渗出与合成,同时酵母菌及乳酸菌代谢产生酶系将部分碳源转化为可以发生显色反应的邻苯二酚结构[37]。另一方面,发酵后期糖苷与游离态黄酮类物质结合的黄酮醇配糖体被水解,造成发酵液黄酮类物质含量的进一步升高[38]。
2.4 还原力的变化
由图4可知,接种酵母菌和乳酸菌后,发酵液还原力均显著高于未发酵清汁,且还原力随发酵时间的延长呈现不断上升的变化趋势。分析原因,酵母菌和乳酸菌均可通过产生NADH氧化酶、SOD、GSHPx等过氧化酶类物质清除活性氧[39]。酵母菌单独发酵时,还原力最高可达0.72 μmol/L,可能是由于酵母菌自身含有的细胞壁多糖能够清除如超氧阴离子自由基等活性氧。发酵56 h时,芸豆酵素还原力为0.88 μmol/L,乳酸菌自身具备的抗氧化能力主要是代谢产物及菌体表面的抗氧化物质发挥作用。范昊安等[40]研究表明相较于发酵初期,苹果梨酵素的还原力显著升高。适当的延长发酵时间有利于芸豆酵素还原力的增强。
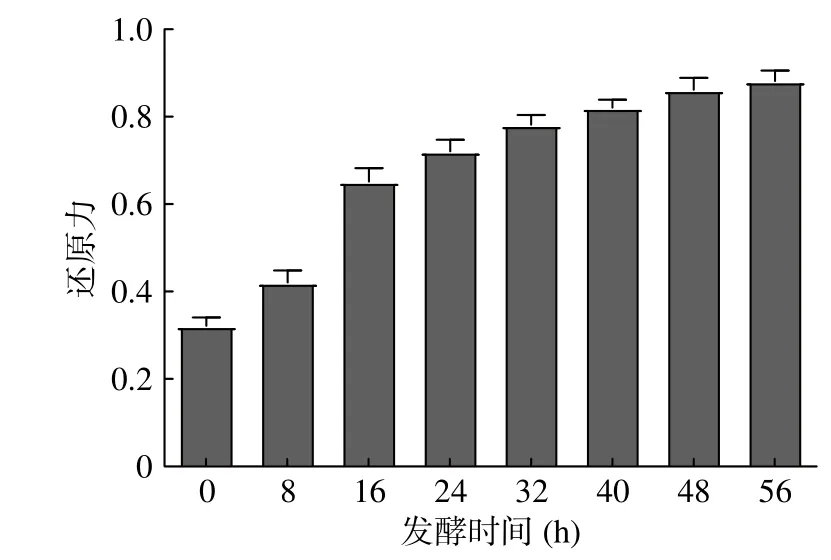
图 4 芸豆酵素发酵过程中还原力变化Fig.4 Reduction force changes during fermentation of kidney bean Jiaosu

表 1 芸豆酵素发酵过程中各参数相关性Table 1 Correlation of various parameters in the fermentation process of kidney bean Jiaosu
2.5 ABTS+自由基清除率的变化
ABTS是一种稳定存在的自由基,可与抗氧化成分发生反应而使体系褪色,清除自由基能力由样品对其吸光度的影响所反映[41]。芸豆酵素发酵过程中ABTS+自由基清除率的变化如图5所示,发酵过程中ABTS+自由基清除率呈现先快速上升后趋于平缓的趋势。发酵前32 h,ABTS+自由基清除率从30.01%迅速上升至82.49%,随后以小幅度趋势上升至发酵后期趋于平缓,整个发酵过程芸豆酵素ABTS+自由基清除率增涨约3倍。研究表明[30],ABTS自由基清除能力与高浓度酚类、有机酸等物质的芳香环数量、分子数量和羟基取代基的性质密切相关。Floegel等[42]发现酚类化合物与ABTS+自由基清除率存在密切关系,分析其可能是造成芸豆酵素具有高ABTS+自由基清楚能力的主要因素。
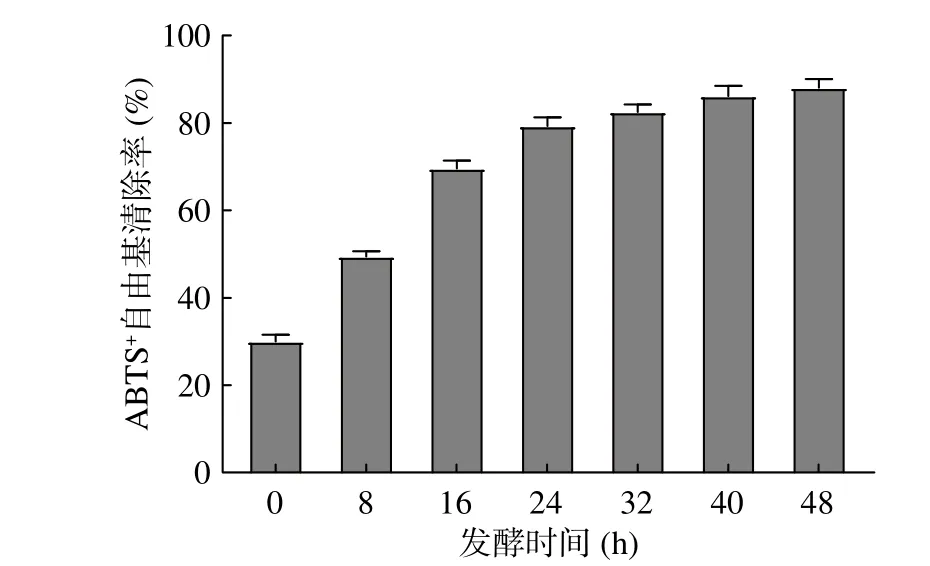
图 5 芸豆酵素发酵过程中ABTS+自由基清除率变化Fig.5 ABTS+ radical scavenging rate during kidney bean fermentation
2.6 相关性分析
芸豆酵素复合发酵过程中还原糖、总酚、黄酮等功能成分与还原力、ABTS+自由基清除率相关性分析结果如表1所示。还原力与ABTS+自由基清除率呈现极显著正相关性(P<0.01),与周偏等[36]对诺丽酵素的研究结果一致。芸豆酵素黄酮与还原力呈极显著正相关(r=0.99,P<0.01),与ABTS+自由基清除率呈极显著正相关(r=0.98,P<0.01);总酚与还原力、ABTS+自由基清除率均呈极显著正相关(r=0.96,P<0.01),表明黄酮类物质和多酚类物质是芸豆酵素发酵过程中重要的抗氧化物质。
3 结论
探究芸豆酵素发酵过程中代谢产物含量以及抗氧化活性的动态变化规律,结果表明,pH呈现持续下降的趋势,总酸变化趋势与之相反。发酵初期还原糖含量小幅度上升后不断降低至3.56 mg/mL。发酵56 h时可溶性固形物含量达到最低6.01%。总酚含量总体呈现上升趋势,仅在发酵32 h时略微降低。与未发酵芸豆清汁相比,发酵48 h的芸豆酵素黄酮含量显著提高3倍(P<0.05)。还原力和ABTS+自由基清除率呈现迅速升高后趋于平缓的趋势,发酵大幅度提升芸豆酵素的抗氧化能力,抗氧化活性的提高与总酚和黄酮含量的变化显著正相关(P<0.05)。代谢产物含量的变化规律可以较为直观反映发酵体系周期进程以及发酵液生物活性物质积累情况。芸豆酵素代谢产物和抗氧化性的研究可为酵素产品的开发及推广利用提供一定的理论依据及数据支持。

