新生VAP小鼠和肽素 IL-32 IL-17水平变化与不同程度肺炎的相关性分析
方 平,王 娅,吴 迪,赵 婧
(1.川北医学院,四川 南充 637100 2.川北医学院附属医院儿科,四川 南充 637000)
呼吸机相关性肺炎(VAP)是一种常见的医院获得性感染疾病,具有高发病率和高死亡率。目前,支气管肺泡灌洗(BAL)是医院诊断VAP并指导治疗的常用方案[1]。近年来,VAP经常在新生儿机械通气治疗后出现,严重影响新生儿治疗效果及安全。有相关文献显示,VAP是新生儿重症监护室中仅次于败血症的第二大院内感染性疾病[2]。因此明确新生儿VAP进展情况并及时采取合理有效的治疗措施是提高新生儿VAP存活率的关键。因为目前关于影响新生儿VAP发病因素的研究很少,所以本研究通过构建新生VAP小鼠模型,研究和肽素(Copeptin)、IL-32、IL-17水平变化与VAP发病因素的关系,为新生儿VAP在临床上的诊断提供更可靠的参考依据。
1 材料与方法
1.1实验材料:实验动物:SPF级BALB/c小鼠,4周龄,雄性,体重(18±2)g,由成都达硕实验动物有限公司提供,生产许可证号:SCXK(川)2015-030,使用许可证号:SYXK(川)2014-189。实验细菌:铜绿假单胞菌,菌种编号:CCTCC AB 200053,来源:中国典型培养物保藏中心。实验试剂:Copeptin、IL-32、IL-17 Elisa测定试剂盒购于上海茁彩生物科技有限公司,NF-κB、TLR2与TLR4抗体购于艾博抗(上海)贸易有限公司。实验仪器:MD3000小动物肺功能测定仪(安徽正华生物仪器设备有限公司);RM2235切片机(德国徕卡公司);Multiskan Sky酶标仪(美国ThermoFisher仪器有限公司);BX43光学显微镜(日本Olympus公司)。
1.2方 法
1.2.1实验分组及构建VAP小鼠模型:取健康BALB/c雌性小鼠54只,随机分为空白组、轻症组(1×106cfu/L菌液)、重症组(6×106cfu/L菌液),每组18只,适应性喂养一周后进行实验。除空白组外,其余各组在进行气管插管前禁食12h,然后腹腔注射4%戊巴比妥钠进行麻醉,固定在动物手术台上,取仰卧位,将自制备的气管导管在喉镜的帮助下插入声门,通过听双肺呼吸音确定导管插在气管内,然后将气管导管外层与小鼠上唇缝合固定,连接小动物呼吸机控制呼吸,呼吸机设置为:潮气量(V)5mL/kg,呼吸频率90次/min,吸入氧浓度(FiO2)100%。为防止体位引起的肺不张,每隔30min行2~3次大VT通气。通过股静脉插管以3~5mL/h输入5%的葡萄糖盐水溶液。机械通气持续24h后,进行肺部感染:使用微量注射器经气管导管快速注入0.05mL铜绿假单胞菌(PA)菌液和0.05mL的无菌气体,并保持体位并持续5min,空白组同法给予等量生理盐水。
1.2.2小鼠肺功能检测:造模后第1、3、7天,各组每个时间点取6只小鼠进行麻醉,通过小动物肺功能测定仪检测用力肺活量(FVC)、第1秒用力呼气量(FEV1),记录数值并计算FEV1/FVC%值。
1.2.3小鼠肺脏组织病理学检测:造模后第7天,各组小鼠处死后采集肺脏保存于4%多聚甲醇中进行固定,用于HE染色观察病理学改变。
1.2.4小鼠血清Copeptin、IL-32、IL-17的含量检测:造模后第1、3、7天通过摘眼球法收集小鼠血液分离血清,使用Elisa法测定Copeptin、IL-32、IL-17的含量。
1.2.5小鼠血清Copeptin、IL-32、IL-17与肺功能指标相关性分析:根据Copeptin、IL-32、IL-17水平的检测结果及肺功能指标,计算相关系数r和P值分析Copeptin、IL-32、IL-17与FVC,FEV1,FEV1/FVC%的相关性。
1.2.6小鼠血清Copeptin、IL-32、IL-17的ROC分析:根据Copeptin、IL-32、IL-17水平的检测结果,采用ROC曲线分析分别计算出Copeptin、IL-32、IL-17相关AUC及95%CI值。
1.2.7免疫组织化学:造模后第7天,处死小鼠收集肺脏,使用免疫组织化学法检测肺脏中NF-κB、TLR2与TLR4的表达情况。
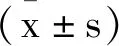
2 结 果
2.1小鼠肺功能检测:对第1、3、7天各组动物进行肺功能测定发现,轻症组与重症组的FVC与FEV1均比空白组显著性下降(P<0.05),在7d内下降程度随时间的增加而增大,同时,重症组的FVC与FEV1均比轻症组显著性下降(P<0.05)。计算FEV1/FVC%后发现,重症组第1、3天的FEV1/FVC均小于空白组与轻症组(P<0.05),虽然第7天数值有所回升,但总体趋势依然是下降,说明VAP的特征之一是肺功能下降,具体结果见表1~3。

表1 各组小鼠FVC测定情况

表2 各组小鼠FEV1测定情况

表3 各组小鼠FEV1/FVC%测定情况
2.2小鼠肺脏病理学:结果显示,空白组肺组织外膜完整,肺脏各级支气管分支结构正常,支气管上皮细胞排列较为整齐,形态正常,胞质染色均匀,未见明显坏死;肺泡结构正常,未见明显萎缩或肺气肿;轻症组肺组织外膜完整,肺脏各级支气管分支结构较正常;肺泡结构正常,少量上皮细胞坏死;肺间质轻微增宽,内见少量淋巴细胞浸润,主要分布在血管、支气管或细支气管周围,未见明显纤维组织增生;重症组:肺组织外膜完整,肺脏各级支气管分支结构较正常,支气管上皮细胞排列较为整齐,未见明显坏死;肺泡结构较正常,部分上皮细胞坏死或脱落,胞质空泡化,胞核固缩;部分区域肺间质明显增宽,见大量炎细胞浸润,主要为淋巴细胞和中性粒细胞,集中分布在血管周围,少量分布在支气管或细支气管周围;少量纤维组织增生。结果见图1。

图1 各组小鼠肺脏组织病理学结果(HE染色)
2.3小鼠血清Copeptin、IL-32、IL-17水平表达:Elisa检测发现,与空白组相比,轻症组与重症组血清Copeptin、IL-32、IL-17水平在7d内均明显升高(P<0.05);与轻症组相比,重症组的Copeptin、IL-32、IL-17水平在7d内均明显升高(P<0.05),结果见表4~6。

表4 各组小鼠Copeptin测定情况

表5 各组小鼠IL-32测定情况

表6 各组小鼠IL-17测定情况
2.4小鼠血清中细胞因子与肺功能指标的相关性分析:将Copeptin、IL-32、IL-17的检测结果与肺功能指标检测结果进行Pearson相关性分析,结果发现,在小鼠VAP模型中,Copeptin、IL-32、IL-17与FVC、FEV1、FEV1/FVC的关系均为负相关(P<0.01),即肺功能指标随Copeptin、IL-32、IL-17含量的升高而下降,结果见表7。

表7 各组小鼠细胞因子与肺功能指标的相关性分析
2.5小鼠血清中细胞因子的ROC分析:对各组的Copeptin、IL-32、IL-17检测结果进行ROC分析,结果发现,Copeptin、IL-32、IL-17的AUC分别为0.823、0.761与0.807(P<0.05),详细结果见表8。
2.6小鼠肺脏中TRL2、TRL4、NF-κB的表达结果:免疫组织化学检测结果发现,与空白组相比,轻症组的TRL2、NF-κB与重症组的TRL2、TRL4、NF-κB的表达水平均显著性升高(P<0.05);与轻症组相比,重症组的TRL2、NF-κB表达水平显著性升高(P<0.05),结果见表9,图2。

表9 各组小鼠肺脏中TRL2 TRL4 NF-κB的表达结果

图2 各组小鼠肺脏组织免疫组织化学结果(400×)
3 讨 论
据估计,所有使用机械通气的患者中约有9.27%会出现VAP,约占所有医院获得性肺炎病例的一半[3]。在过去的几十年中,虽然改进机械通气患者的综合管理在理论上降低VAP发病率的可能性,但实际上与VAP相关的死亡率和发病率并没有降低。目前有研究发现,患者在接受机械通气超过48h后的发生肺炎的可能性比重症监护病房的非通气患者高出约10倍[4]。因此机械通气是引起潮气量依赖性呼吸机诱发的肺部炎症因素之一。本实验构建了VAP小鼠改良模型,通过检测呼吸功能与组织病理学观察发现,VAP造成的损伤主要是呼吸功能受损与炎症反应,具体表现为7d内FVC、FEV1、FEV1/FVC%均呈明显下降的趋势,组织内炎性细胞大量浸润,淋巴细胞与中性粒细胞聚集程度严重,同时还伴有部分肺泡上皮细胞坏死,损伤程度与病重程度呈正比。所以,治疗VAP的首要目的应该是减少炎症反应、提高肺功能为主。
VAP造成肺部炎症的原因是激活促炎TH1细胞因子如肿瘤坏死因子-α(TNF-α),白介素1(IL-1)、γ干扰素(IFN-γ)和白介素6(IL-6),以及肺部中性粒细胞和巨噬细胞等的聚集[5,6]。其中,Copeptin是一种与呼吸和代谢条件疾病严重程度密切相关的生物标志物。有研究发现,Copeptin在成人慢性阻塞性肺病和儿童重症肺炎患者血清中处于高水平[7],而且是儿童社区获得性肺炎并发症的良好预测因子。IL-17是一种促炎细胞因子,在中性粒细胞和其他免疫细胞到感染部位的招募中发挥重要作用[8]。IL-32则是一种新发现的促炎因子,广泛存在于人体的肺、结肠、肌肉、大脑等器官中,在免疫细胞和非免疫细胞中均有表达,与肺癌、关节炎、哮喘、心肌梗死和心血管疾病具有相关性[9]。因此,本实验重点探讨Copeptin、IL-32、IL-17在VAP发病进程中的作用及关联,实验结果显示,轻症组与重症组的Copeptin、IL-32、IL-17在VAP发病的7d内均呈上升的趋势,说明VAP的发病伴随着Copeptin、IL-32、IL-17的上升,属于正向调控。进一步与肺功能进行相关性分析发现,Copeptin、IL-32、IL-17水平与FVC、FEV1、FEV1/FVC%呈负相关,间接说明VAP通过诱导Copeptin、IL-32、IL-17上升促使肺功能下降。而随后ROC特征结果则显示Copeptin、IL-32、IL-17三者曲线下面积(AUC)均大于0.5,且敏感性较高,因此,临床上对VAP的诊断可参考Copeptin、IL-32、IL-17等指标的变化,可辅助诊断早期VAP。
TLR/NF-κB通路是一条经典的炎症通路,通过激活NF-κB促进基因的表达,介导下游炎性细胞因子转录大量的炎性与免疫蛋白,从而引发疾病。TLR2与TLR4均是此通路中的关键蛋白,TLR2与TLR4在炎症与免疫反应中对IL-17、IL-32均有调控作用[10]。在本研究中,通过免疫组织化学法对小鼠肺脏中的TRL2、TRL4、NF-κB蛋白表达水平进行了检测,发现VAP持续7d后,轻症组与重症组这3个蛋白的表达量均有所上升,且重症组比较明显。由此说明,持续的VAP可以激活肺脏中的TLR/NF-κB信号通路,导致炎症细胞聚集,Copeptin、IL-32、IL-17的分泌增多,最终引发炎症反应,降低肺功能。
综上所述,本研究从肺功能、病理改变与炎症反应3方面探讨了VAP的发病因素,初步明确了VAP的发病与机体内TLR/NF-κB信号通路的激活,Copeptin、IL-32、IL-17含量增加以及肺功能下降三者间具有密切关联性,但具体调控机制尚未明确,后续实验将进一步探讨VAP与Copeptin、IL-32、IL-17以及TLR/NF-κB信号通路的关系。

