miR-145-5p通过调节PHB2基因发挥对非小细胞肺癌细胞A549增殖迁移的影响
李新军,钟敏华,吴展陵,曹玲莉,邱 琦,涂平华,汪娜娜,彭闪闪,高 飞
(湖北省孝感市中心医院,湖北 孝感 432000)
在我国肺癌发病率和病死率居恶性肿瘤首位[1]。其中非小细胞肺癌(non-small cell lung cancer ,NSCLC)占肺癌的85%以上,据报道我国有逾2/3的患者临床确诊时已错过最佳手术时机,5年生存率较低[2]。因此,积极探索并发现影响NSCLC患者疾病发展及预后的相关机制具有十分重要的意义。近年来,大量证据表明 miRNA在包括NSCLC在内癌症发生和发展中起到重要作用[3,4]。miR-145和肿瘤发生发展密切相关,如胆管癌、口腔癌、胰腺癌、前列腺癌等[5],然而,miR-145对NSCLC发生和发展的相关分子机制尚未得到阐明。因此,我们研究的目的是评估miR-145-5p与NSCLC的关联,尝试发现miR-145-5p在NSCLC疾病进展中的分子机制。
1 材料与方法
1.1临床标本:2019年10月至2021年1月间,收集孝感市中心医院14例NSCLC患者癌组织及其相邻的非癌组织。每位参与者均知悉研究内容并签署了知情同意书。所有材料和方法均获得孝感市中心医院伦理委员会批准。
1.2细胞培养:NSCLC细胞系(A549)和非肿瘤细胞系(BEAS-2B)购自美国典型培养物保藏中心(ATCC,Manassass,弗吉尼亚州,美国)。将细胞培养在加有10%胎牛血清(Hyclone,美国)和100U/mL青霉素-链霉素(Hyclone,美国)的RPMI-1640培养基(Gibco,美国)中,置于5%CO2的37℃的潮湿细胞培养箱中培养。
1.3细胞转染:miR-145-5p模拟物及其阴性对照;pcDNA-PHB2及其阴性对照分别购自GenePharma(中国上海)。按照制造商(Invitrogen,美国)的说明,使用Lipofectamine®2000进行质粒和pc-DNA转染。
1.4细胞活力测定
1.4.1进行MTT测定以分析细胞的存活力。将细胞接种到96孔板中,加入20μL MTT(5mg/mL,Sigma-Aldrich;Merck KGaA,Darmstadt,德国)。将细胞在37℃下再孵育4h,然后加入150μL DMSO。在室温下反应10min后,在570nm处通过Multiskan FC酶免疫测定分析仪测量光密度(OD),检测细胞增殖水平。
1.4.2为了评估细胞增殖,将A549细胞接种到48孔板中。将细胞在标准条件下在完全培养基(补充有10%FBS的DMEM)中温育。如上所述,第2天进行细胞转染。转染后24h,收获转染的细胞。使用EDU Cell Proliferation Assay Kit(Ribobio,Guangzhou,China)通过掺入5-乙炔基-2'-脱氧尿苷(EdU)检测细胞增殖。简而言之,将细胞与50μM EDU一起温育8h,然后根据制造商的方案进行固定,透化和EDU染色。细胞核用DAPI(Ribobio,Guangzhou,China)染色。通过荧光显微镜确定EDU阳性的有核细胞的比例。
1.5细胞迁移和侵袭试验:用8.0μm探针(BD Falcon)将2万个细胞接种到24孔细胞培养小室的上部。用未涂覆的基质胶(迁移)和涂覆的基质胶(侵袭)进行细胞迁移和侵袭测定。24h后,用棉签除去小室表面的细胞。随后,在冷甲醇中固定并用DAPI溶液对培养皿表面的细胞染色。在荧光显微镜下观察细胞的形态和数量。
1.6RNA提取和定量实时PCR分析(qRT-PCR):根据制造商(Invitrogen,美国)的方法,用Trizol分离来自组织和细胞的总RNA。然后使用M-MLV逆转录酶(Promega,美国)将总RNA(2μg)反转录为cDNA。使用SYBR Green qPCR预混液(美国罗氏公司)评估基因表达。U6和GAPDH分别用作miRNA和mRNA的内部对照。
1.7荧光素酶报告基因检测:包含PHB2的3'UTR的互补DNA片段被亚克隆到pGL3-Baisc荧光素酶报道载体(Promega)中的荧光素酶基因的下游。将细胞与报告质粒(100ng)和miR-145-5p minic / miR-NC minic共转染。转染后48h后,使用双萤光素酶试剂盒(Promega)测定萤光素酶含量。
1.8蛋白质印迹分析:用冷PBS洗涤后收集组织和细胞,然后在带有蛋白酶抑制剂混合物(Roche)的RIPA裂解缓冲液(Solarbio)中裂解。使用Lowry蛋白浓度检测试剂盒(Solarbio)确定蛋白浓度。将每个样品中等量的蛋白质进行8-15%的十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(SDS-PAGE),然后转移到硝酸纤维素膜上。采用一抗PHB2(1∶500,Proteintech)和GAPDH(1∶1000,Proteintech)分别孵育过夜并与二抗HRP-缀合的兔/小鼠抗-IgG(1∶10000,Proteintech)一起在室温下孵育2h并洗涤。随后用ECL化学发光系统(Biorad,美国)检测蛋白质条带。
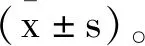
2 结 果

表1 非小细胞肺癌组织非小细胞肺癌细胞系及过表达miR-145-5p A549细胞系中miR145-5p的表达水平(n=10)
2.1miR-145-5p在非小细胞肺癌组织和细胞中下调:首先我们检测了14对NSCLC组织和癌旁组织中miR-145-5p的表达水平,发现miR-145-5p水平在肺癌组织中与非癌组织显著降低(P<0.01),见表1。另外我们发现A549细胞系中miR-145-5p水平显著低于BEAS-2B(P<0.001),见表1。最后,我们进行了mimic转染效率实验,用miR-145-5p mimic转染A549细胞,并与转染NC组细胞对比,发现转染可以有效增加细胞miR-145-5p的水平(P<0.001,表1)。基于此结果我们进行了后续实验。
2.2miR-145-5p抑制NSCLC细胞的增殖、迁移和侵袭:为了研究miR-145-5p作为抑癌miRNA的作用,我们在A549非小细胞肺癌细胞系中过表达miR-145-5p,使用MTT和EdU测定其相对吸光度及阳性细胞的百分比来验证miR-145-5p对细胞增殖活力的影响。结果发现与miR-NC组相比,转染miR-145-5p mimic后的相对吸光度及阳性细胞百分比显著降低(图1A、B、表2),提示过表达miR-145-5p可以有效降低NSCLC细胞的增殖水平。随后,我们通过划痕试验及transwell试验测试了miR-145-5p在NSCLC细胞的迁移和侵袭能力的作用,结果发现,与miR-NC组相比,过表达miR-145-5p显著抑制细胞迁移和侵袭(图1C、表2)。总之,我们的结果表明过表达miR-145-5p可以在体外有效抑制A549细胞的增殖、迁移和侵袭。
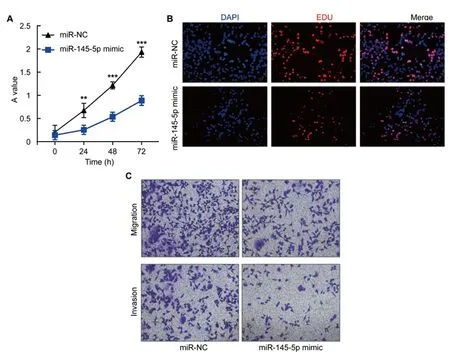
图1 miR-145-5p抑制NSCLC的增殖、迁移和侵袭A.转染miR-145-5p mimic后,MTT法检测A549细胞的活力B.转染miR-145-5p mimic 的A549细胞24h后进行EdU增殖测定及阳性细胞计数。未转染的细胞(模拟物)用作阴性对照。具有红色荧光的细胞处于有丝分裂的S期,具有蓝色荧光的细胞代表所有细胞。比例尺=300μm。C.转染miR-145-5p mimic后,A549细胞的迁移、侵袭实验。
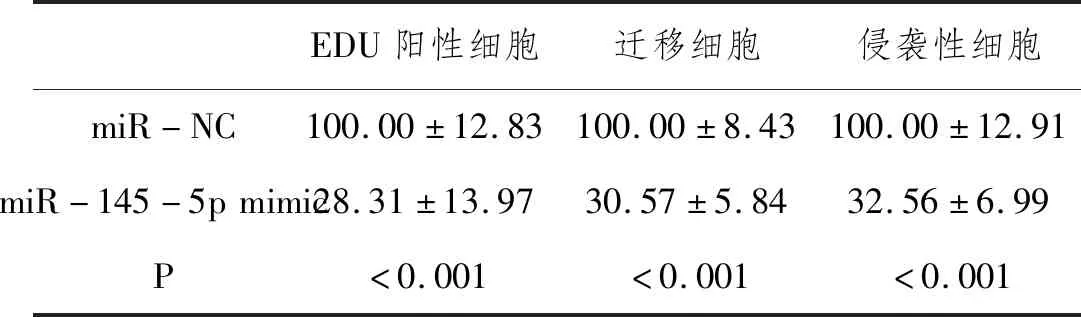
表2 两组A549细胞增殖迁移侵袭能力(n=10)
2.3PHB2是miR-145-5p的直接靶标:由于miR-145-5p促进了NSCLC细胞的增殖、迁移和侵袭能力,我们进一步研究了其促进NSCLC进展的机制。通过在线算法TargetScan进行信息学分析,以预测miR-145-5p的潜在靶标。并预测PHB2是miR-145-5p的靶点。我们首先对人NSCLC组织、癌旁组织及A549细胞中PHB2的表达水平进行检测,结果发现人NSCLC组织及A549细胞中PHB2中的表达水平明显低于癌旁组织,仅约为癌旁组织的62%。为了证实PHB2是miR-145-5p的真正靶标,我们在A549细胞中,将PHB2和miR-145-5p的野生型(WT)或突变体(Mut)3'-UTR共转染,并进行荧光素酶报告实验。共转染实验显示,过表达miR-145-5p显著降低了A549细胞中野生型PHB2的荧光素酶活性,而使用突变体则无上述现象(表3);另外,使用miR-145-5p抑制剂转染后显著增加了A549细胞中野生型PHB2的荧光素酶活性,同样使用突变体则无上述现象(表4)。随后,我们进一步通过蛋白质免疫印迹实验研究了用miR-145-5p或对照载体转染的细胞中的PHB2蛋白表达。结果显示,与miR-NC组细胞相比,转染miR-145-5p后,细胞中COPB2的蛋白表达水平显著降低(P<0.001)(表5)。上述结果联合证明,PHB2是miR-145-5p抑制NSCLC细胞增殖、迁移和侵袭的直接靶标。
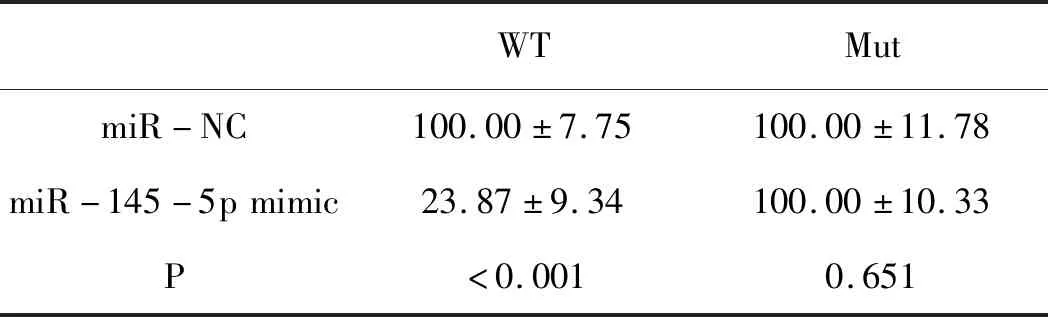
表3 过表达miR-125-5p后野生型(WT)或突变体(Mut)A549荧光素酶活性(n=10)

表4 抑制miR-125-5p表达后野生型(WT)或突变体(Mut)A549荧光素酶活性(n=10)
2.4miR-145-5p通过靶定PHB2,在体外抑制NSCLC细胞的增殖、迁移和侵袭:为了进一步验证PHB2对NSCLC细胞迁移和侵袭的影响,我们采用miR-145-5p和PHB2共转染A549细胞,并评估其增殖、迁移和侵袭的水平。蛋白质免疫印迹实验结果显示,miR-145-5p mimic与pcDNA-PHB2的共转染部分恢复了PHB2蛋白的表达水平,并有效地恢复了NSCLC的细胞活力(表6)。细胞的迁移和侵袭实验结果显示,miR-145-5p mimic与pcDNA-PHB2的共转染显著恢复了NSCLC细胞的迁移和侵袭能力(图2)。上述结果说明,miR-145-5p是通过靶定PHB2,有效抑制了NSCLC细胞的增殖、迁移和侵袭。

表5 过表达miR-125-5p后A549细胞中PHB2的表达(n=10)
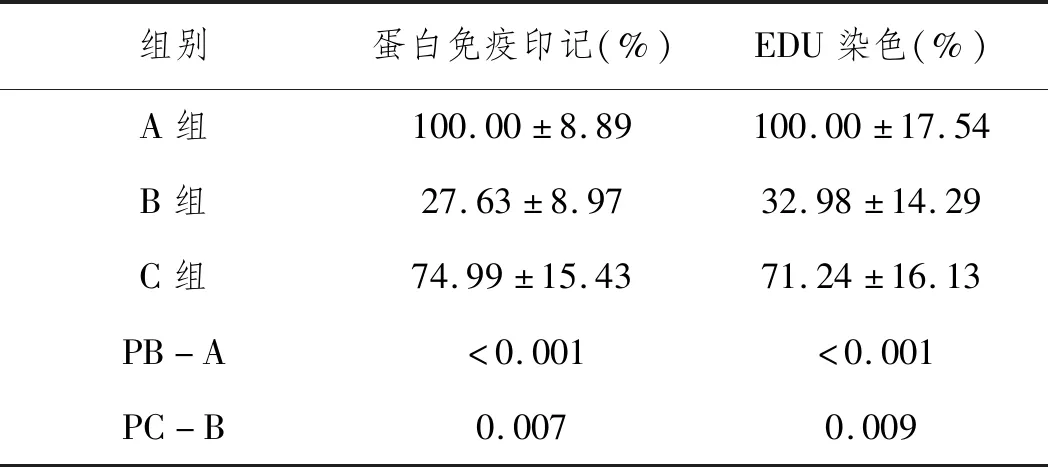
表6 蛋白质免疫印迹及EDU染色检测3组A549细胞PHB2的表达水平(n=10)
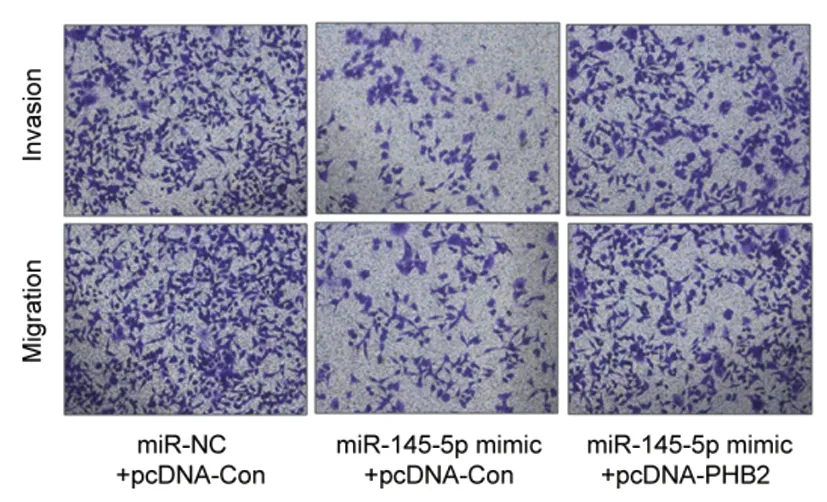
图2 miR-145-5p通过靶定PHB2,在体外抑制NSCLC细胞的增殖、迁移和侵袭。
3 讨 论
研究已证实miRNA参与了包括NSCLC在内的多种恶性肿瘤的发生与发展[6,7]。Zhang等指出miRNA可在转录后水平上调控蛋白质表达,参与包括骨肉瘤在内的多种恶性肿瘤的发生和发展[8]。miR-145是miRNA家族的一员,属于抗癌基因,位于染色体5q32-33。其中miR-145-5p在多种癌症组织及细胞中表达明显下调,如甲状腺癌、胶质瘤、乳腺癌、肠癌、肺癌等,被认为是肿瘤的生物学标志物,miR-145-5p的表达量与肿瘤转移、预后显著相关,恢复其表达对于增强癌细胞的化疗药物敏感性、抑制癌细胞增殖及肿瘤生长[9,10]。表明miR-145-5p在肿瘤细胞的发展过程中发挥复杂的作用。近年与研究显示miR-145-5p在甲状腺癌、为此,我们试图确定miR-145在NSCLC中的潜在作用。结果表明,miR-145-5p在NSCLC组织和细胞株中的表达明显下调。此外,我们还发现miR-145-5p在NSCLC细胞中的过表达可以明显地降低细胞的增殖、迁移和侵袭能力。因此我们的研究可表明,miR-145-5p可作为NSCLC一种新型的生物标志物。
miRNA需要通过转录后进而调控基因表达才能发挥其生物学功能。因此,我们利用公共生物信息学算法筛选了miR-145-5p的靶基因,并确定了PHB2,PHB2属于抗增殖蛋白,随着对PHBs研究的深入,科学家发现PHBs与多种细胞功能相关,如:细胞增殖,细胞迁移和细胞凋亡等,近年来对PHBs研究发现,其在肿瘤发生发展过程中均有参与[11,12]。利用双荧光素酶测定法进一步证实,PHB2是miR-145-5p的直接靶标。此外,研究发现与miR-NC转染的细胞相比,PHB2的过表达显著增强了miR-145-5p转染后细胞的增殖、迁移和侵袭。我们的研究结果显示miR-145-5p可通过抑制PHB2表达水平调节NSCLC细胞的增殖、迁移和侵袭能力。
综上,miR-145-5p可通过抑制PHB2表达水平,进而在NSCLC疾病中发挥其抑癌作用,这可能为NSCLC的临床诊疗提供新的思路。

