QuEChERS-UPLC-MS/MS测定果蔬中18 种琥珀酸脱氢酶抑制剂类杀菌剂
龚 蕾,黄 徽,韩 智,江 丰,彭青枝*,黄宗骞,王 亨
(湖北省食品质量安全监督检验研究院,湖北省食品质量安全检测工程技术研究中心,湖北 武汉 430070)
琥珀酸脱氢酶抑制剂(succinate dehydrogenase inhibitors,SDHIs)是一类通过抑制病原菌琥珀酸脱氢酶活性,从而干扰其呼吸作用的新型杀菌剂[1],是近年发展很快且应用前景最广的一类新型农药[2],包括麦锈灵、氟酰胺、灭锈胺、甲呋酰胺、萎锈灵、氧化萎锈灵、啶酰菌胺、噻呋酰胺、呋吡菌胺、吡噻菌胺以及近2 a新研发的氟吡菌酰胺、联苯吡菌胺、吡唑萘菌胺、氟唑环菌胺和氟唑菌苯胺等[3]。目前,该类杀菌剂主要应用于蔬菜、水果、粮食等经济作物的杀菌和防霉[4]。虽然该类杀菌剂毒性较低,但因其使用日益广泛,SDHIs杀菌剂及代谢物残留对农产品质量安全造成严重影响。美国、日本和韩国规定小麦中萎锈灵的最大残留限量(maximum residue limit,MRL)值均为0.2 mg/kg,中国、国际食品法典委员会(codex alimentarius commission,CAC)和欧盟等均未制定萎锈灵在小麦中的MRL标准[5]。吡噻菌胺、氟唑菌酰胺、氟吡菌酰胺、啶酰菌胺和吡唑萘菌胺的MRLs已经确定,苹果MRL为10 mg/kg,草莓为10 mg/kg,番茄为3 mg/kg,菠菜为60 mg/kg[6-8]。欧盟规定啶酰菌胺、吡噻菌胺、吡唑萘菌胺、氟唑菌酰胺在西红柿中的限量为3 mg/kg[9],我国规定啶酰菌胺在草莓和苹果中的限量分别为3 mg/kg和2 mg/kg,新版GB 2763—2019《食品中农药最大残留限量》增加了吡唑萘菌胺、吡噻菌胺、氟唑环菌胺、氟唑菌酰胺和苯并烯氟菌唑在大麦、小麦、黄瓜、香蕉、结球甘蓝、畜禽肉等食品中的临时限量[10],其他SDHIs杀菌剂还没有相应的MRL值。有关此类农药检测的标准方法较少,仅见GB 23200.8—2016《水果和蔬菜中500 种农药及相关化学品残留量的测定 气相色谱-质谱法》[11]和GB/T 20769—2006《水果和蔬菜中405 种农药及相关化学品残留量的测定 液相色谱-串联质谱法》[12]中涉及了麦锈灵、氟酰胺、灭锈胺等几种,其他SDHIs杀菌剂也没有相应的国标检验方法。因此有必要开展快速分析SDHIs杀菌剂方法的研究,为该类杀菌剂的使用、监管提供技术依据。
目前,国内外报道的关于食品中部分SDHIs类杀菌剂的分析方法主要有免疫分析法[13-15]、气相色谱(gas chromatography,GC)法[16-17]、气相色谱-质谱(gas chromatography-mass spectrometry,GC-MS)法[18-20]、液相色谱(liquid chromatography,LC)法[21]和液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LC-MS/MS)法[22-26]。LC-MS/MS法分离能力强,可同时定性定量测定多组分,研究者采用较多。Abad-Fuentes等[27]建立了LC-MS/MS法测定果蔬中吡唑萘菌胺等7 种SDHIs杀菌剂;孙亚米等[28]采用LC-MS/MS法快速测定果蔬中啶酰菌胺、呋吡菌胺、噻唑菌胺、氟吡菌酰胺、联苯吡菌胺和吡噻菌胺等16 种新型酰胺类杀菌剂;杨欢等[29]利用LC-MS/MS法测定果蔬中8 种新型SDHIs杀菌剂;Han Lijun等[30]采用了GC-MS/MS和UHPLC-MS/MS分别测定鲶鱼肌肉组织中219 种和128 种农药,涵盖部分SDHIs杀菌剂;还有研究者[31-32]采用超高效液相色谱-串联质谱(ultra-high performance liquid chromatography-tandem mass spectrometry,UPLC-MS/MS)法检测柑橘、土豆、大豆及水果加工产品等不同基质中上百种农药或其代谢物的残留,包括啶酰菌胺、氧化萎锈灵、灭锈胺、吡噻菌胺等,而有关异丙噻菌胺、氟唑菌酰胺、苯并烯氟菌唑等新一代SDHIs杀菌剂在果蔬中残留的检测方法至今鲜见报道。
考虑到不同SDHIs杀菌剂限量范围较宽以及样品基质的复杂性,为满足样品实际测定需要,本研究采用经济、简便、易操作的QuEChERS(quick, easy, cheap,effective, rugged and safe)前处理方法与UPLC-MS/MS技术结合,建立了能同时分析果蔬中18 种SDHIs杀菌剂的UPLCMS/MS方法。本方法快速、操作简便、分析时间短、灵敏度高,可满足果蔬中SDHIs杀菌剂的定量检测需要。
1 材料与方法
1.1 材料与试剂
76 份果蔬样品购自湖北武汉中百仓储超市、沃尔玛超市、武商超市3 家超市。
标准品:麦锈灵、氟酰胺、灭锈胺、氟吡菌酰胺、甲呋酰胺、萎锈灵、氧化萎锈灵、联苯吡菌胺、呋吡菌胺、吡唑萘菌胺、氟唑菌苯胺、吡噻菌胺、氟唑环菌胺、氟唑菌酰胺、苯并烯氟菌唑、异丙噻菌胺、啶酰菌胺、噻呋酰胺(均为液态标准物质,质量浓度均为100 μg/mL) 阿尔塔科技有限公司。
乙腈(色谱纯) 德国Merck公司;甲酸(色谱纯)美国Thermo Fisher公司;醋酸钠、无水硫酸镁(均为分析纯) 国药集团化学试剂有限公司;N-丙基乙二胺(primary secondary amine,PSA)(40~60 µm)上海安谱科学仪器有限公司;超纯水由Millipore系统制备。
1.2 仪器与设备
AB SCIEX Triple QuadTM4500液相色谱-质谱联用仪美国AB SCIEX公司;ME204电子天平 梅特勒-托利多仪器有限公司;MS3 digital涡旋仪 德国IKA公司;Centrifuge 5810离心机 艾本德中国有限公司;0.22 μm有机相滤膜 天津津腾公司;Milli-Q超纯水系统美国Millipore公司。
1.3 方法
1.3.1 UPLC条件
色谱柱:ACQUITY UPLC BEH C18色谱柱(50 mm×2.1 mm,1.7 μm);进样量2 μL;柱温35 ℃;流动相:A相为0.1%甲酸溶液,B相为乙腈,流速0.3 mL/min;梯度洗脱条件如表1所示。

表1 梯度洗脱程序Table 1 Gradient elution program
1.3.2 质谱条件
离子源:电喷雾电离源(electrospray ionization,ESI);扫描方式:正负离子模式同时扫描;检测方式:多反应监测,ESI+电压5 500 V,ESI-电压-4 500 V;离子源温度500 ℃;气帘气压力35 psi;碰撞气压力9 psi;雾化器压力50 psi;辅助气压力50 psi;入口电压10.0 V;碰撞室出口电压6 V。各杀菌剂的质谱条件见表2。

表2 18 种SDHIs的定性离子、定量离子、去簇电压和碰撞能量Table 2 Qualitative ions, quantitative ions, cone voltages and collision energies for eighteen compounds
1.3.3 标准溶液配制
分别准确移取质量浓度为100 μg/mL的麦锈灵、氟酰胺、灭锈胺、氟吡菌酰胺、甲呋酰胺、萎锈灵、氧化萎锈灵、联苯吡菌胺、呋吡菌胺、吡唑萘菌胺、氟唑菌苯胺、吡噻菌胺、氟唑环菌胺、氟唑菌酰胺、苯并烯氟菌唑、异丙噻菌胺、啶酰菌胺、噻呋酰胺标准品各1.0 mL至10 mL容量瓶,用乙腈定容到10.00 mL,18 种SDHIs的标准品母液质量浓度均为10.0 μg/mL,于-18 ℃保存。
标准品混合中间液:准确移取18 种SDHIs的标准品母液各1.0 mL于20 mL容量瓶,用乙腈定容到20.00 mL,各化合物质量浓度均为0.5 μg/mL,于4 ℃保存。
标准曲线工作液:用乙腈稀释混合中间液,配制系列标准曲线为0.5、5、20、50、100、200 ng/mL。
1.3.4 样品前处理
取新鲜果蔬样品,用粉碎机粉碎混匀,于-18 ℃冷冻保存。
准确称取10.00 g(准确至0.01 g)试样于50 mL离心管中,加10.0 mL乙腈,振荡混匀2 min,再加入5 g无水硫酸镁和1 g醋酸钠,混匀,4 000 r/min离心5 min。取3 mL上清液于15 mL离心管中,加入100 mg无水硫酸镁、50 mg PSA,涡旋3 min后,于4 000 r/min离心3 min,过0.22 μm有机滤膜,供UPLC-MS/MS待测。
1.3.5 实际样品检测
采集湖北武汉中百仓储超市、沃尔玛超市、武商超市共3 家超市76 份蔬菜及水果,采用本研究建立的前处理方法和液相色谱-质谱法测定18 种农药的残留量。
1.4 数据统计及图表绘制
本研究所有数据均在AB SCIEX公司的Analyst Software软件下采集,采用MultiQuant3.0.2软件进行定性定量分析,采用Origin 9.0进行图像处理。
2 结果与分析
2.1 质谱条件与色谱条件的优化
为获得18 种SDHIs最佳灵敏度和分离效果,对质量浓度为0.5 mg/L的18 种SDHIs单标溶液依次采取蠕动泵注射的方式进行一级质谱扫描。结果显示:在正离子模式下,噻呋酰胺难以形成稳定的[M+H]+峰,其他17 种杀菌剂在正离子模式下均有较好响应;在负离子模式下,噻呋酰胺能形成稳定的[M-H]-峰。因此本实验采取正负离子同时扫描,噻呋酰胺为负离子扫描,其他17 种SDHIs正离子扫描。为了得到响应值高,稳定性好的子离子,优化了质谱和液相色谱参数,图1为优化后18 种杀菌剂的多反应监测离子色谱图。

图1 18 种化合物定量离子流图Fig.1 Total ion current chromatograms for quantitative analysis of 18 compounds


2.2 样品前处理方法的优化
2.2.1 提取
QuEChERS法是经典的果蔬农药残留检测方法,包含原始QuEChERS法、AOAC的QuEChERS法和欧盟的QuEChERS法。盐析法也是农残检测中常用的前处理方法[33]。本实验选择毛白菜为实验对象,通过加标回收,考察QuEChERS及盐析法对SDHIs的提取效率。5 种前处理方法分别为:1)原始QuEChERS法,10 g样品+10 mL乙腈+4 g无水MgSO4+1 g NaCl;2)欧盟的QuEChERS法,10 g样品+10 mL乙腈+4 g无水MgSO4+1 g NaCl+1 g柠檬酸三钠+0.5 g柠檬酸氢二钠;3)AOAC的QuEChERS法(未酸化),10 g样品+10 mL乙腈+4 g无水MgSO4+1 g醋酸钠;4)AOAC的QuEChERS法,10 g样品+10 mL乙腈+4 g无水MgSO4+1 g醋酸钠+0.1%乙酸;5)NY/T 761—2008《蔬菜和水果中有机磷、有机氯、拟除虫菊酯和氨基甲酸酯类农药多残留的测定》的提取方法,10 g样品+10 mL乙腈+7 g NaCl。
考察不同前处理对提取效果的影响,具体操作步骤如下:取均质的10 g毛白菜样品(每个样品3 个平行),加入100 μL质量浓度为1 μg/mL的混合标准溶液,静置30 min后,用以上5 种方法进行提取,涡旋3 min,取上清液,过0.22 μm滤膜检测,通过计算18 种化合物的回收率计算提取方式。
表3显示,采取方法3)整体提取效果较好,总体回收率好。方法1)中整体回收率较低,氧化萎锈灵回收率仅65.7%,方法5)中超过一半样品的回收率高于100%,有明显的基质增强效应,方法2)平均回收率不及方法3)和方法4),方法3)和方法4)的回收率差别不大,区别在于噻呋酰胺在酸化条件下回收率高于120%,综合考虑,本实验选择方法3)提取,即称取10 g样品,加入10 mL乙腈,涡旋振荡,加入4 g无水MgSO4和1 g醋酸钠混匀。
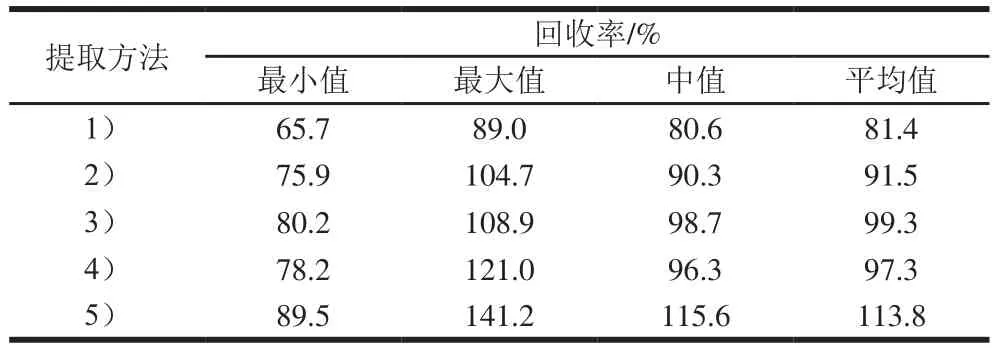
表3 不同提取方法的18 种化合物总体回收率Table 3 Effects of different extraction methods on recoveries of eighteen compounds
2.2.2 净化与基质效应
QuEChERS法常用到净化剂C18、N-丙基乙二胺(primary secondary amine,PSA)和石墨化碳黑(graphitized carbon black,GCB)。C18可用来除脂,PSA可用来消除各种果蔬的有机酸、色素及一些糖和脂肪酸,GCB可用来去除甾体、叶绿素等色素,但对含苯官能团的化合物有较强吸附作用。杨欢等[29]在研究8 种新型SDHIs杀菌剂快速测定中,对净化试剂进行比较和优化,发现C18的加入对氟唑环菌胺、联苯吡菌胺等化合物有吸附作用,本实验参考其研究结果,使用PSA粉末进行净化。并考察不同质量PSA(0、20、40、50、80、100、200、500 mg)与200 mg无水MgSO4的净化效果,选取基质为毛白菜、芹菜、梨、橙4 种。
分别用乙腈和空白基质溶液配制相同质量浓度的标准溶液,在相同色谱条件下测定,按照基质效应/%=B/A×100计算样品基质溶液的基质效应,其中B为目标化合物在空白基质溶液中的响应值,A为目标化合物在乙腈中的响应值。通过基质效应强弱评价方法的净化效果。结果表明,PSA的加入能有效达到净化效果,并发现在取上清液3 mL的条件下,使用50 mg PSA即能有效降低基质增强效应,加大PSA量对净化效果无显著性影响,与杨欢等[29]的研究相同。
2.2.3 线性范围、检出限及定量限
在空白样品中添加一系列质量浓度的目标化合物,在1.3.4节的前处理条件下进行检测,以目标物质量浓度为横坐标,质谱定量峰面积为纵坐标绘制标准曲线(表4),得出18 种农药在0.5~200 ng/mL范围内呈现出良好的线性关系,相关系数R均大于0.99,以信噪比RSN=3确定检出限,以RSN=10确定定量限,18 种SDHIs检出限为0.5~2.0 μg/kg,定量限为1.5~6.0 μg/kg,具体结果见表4。杨欢等[29]研究的8 种SDHIs杀菌剂检出限为0.2~1.7 μg/kg,本方法检出限与其水平相当,均满足检测需要。

表4 18 种SDHIs的标准曲线、相关系数、检出限和定量限Table 4 Linear ranges, related coefficient, LODs and LOQs for 18 compounds
在毛白菜、芹菜、梨、橙4 种基质中分别添加标准溶液,按照1.3.4节进行样品前处理,按高中低3 水平对空白样品提取液进行添加,每个添加水平平行测定6 次,计算平均回收率和相对标准偏差(relative standard deviation,RSD),结果见表5。各种目标化合物在4 种基质中3 个添加水平(10、50 μg/kg和150 μg/kg)下的回收率为83.6%~109.4%,RSD为1.2%~8.4%。孙亚米等[28]利用LC-MS/MS建立的16 种SDHIs杀菌剂回收率为85.7%~103.9%;杨欢等[29]建立的8 种SDHIs杀菌剂回收率为71.4%~121.3%,本研究与其相比,均能满足果蔬中农药残留检测的回收率要求。

表5 18 种SDHIs的加标回收率及RSDTable 5 Average spiked recoveries and precision of 18 compounds

续表5
2.3 实际样品检测结果
采用优化建立UPLC-MS/MS快速分析方法对市售沃柑、橙、梨、黄瓜、番茄、菠菜、辣椒、山药、上海青、白菜、茄子、芹菜、豇豆、油麦菜等76 份样品进行测试。结果显示氟吡菌酰胺检出样品2 个,分别为西红柿和黄瓜,检出值分别为10.2、22.6 μg/kg;氟唑菌酰胺检出样品1 个,为黄瓜,检出值为7.8 μg/kg;啶菌酰胺在芹菜、黄瓜、番茄、菠菜、上海青、茄子6 种蔬菜共12 个样品中均有检出,检出值为7.4~1 966 μg/kg,其中在2 批次芹菜中检出值分别高达1 017、1 966 μg/kg。噻呋酰胺检出样品1 个,为沃柑,检出值为47.2 μg/kg。
3 结 论
本实验建立了同时分析果蔬中18 种SDHIs杀菌剂残留的UPLC-MS/MS检测方法。该方法灵敏度高、重复性好,经过系列方法学验证,结果表明18 种目标化合物在0.5~200 μg/L范围内线性关系良好,相关系数均大于0.99,方法检出限为0.5~2.0 μg/kg,定量限为1.5~6.0 μg/kg。各种目标化合物在4 种基质中3 个添加水平(10、50 μg/kg和150 μg/kg)下的回收率为83.6%~109.4%,RSD为1.2%~8.4%(n=6)。实际样品的检测结果表明氟吡菌酰胺、氟唑菌酰胺、啶酰菌胺和噻呋酰胺均在黄瓜、西红柿、芹菜、沃柑等果蔬中有残留,啶菌酰胺残留现象严重。该方法操作简单、净化效果好,适用于果蔬中SDHIs杀菌剂的快速检测,不仅可以满足当前国际上对果蔬中这18 种SDHIs杀菌剂MRL的检测要求,也可推进果蔬中SDHIs杀菌剂残留的食品安全风险评估,为政府监管部门数据支撑具有重要的实际意义和社会效益。

