促人胎结肠上皮细胞增殖的婴儿源双歧杆菌的分离筛选及生物学性质
关嘉琦,梁胜男,陈庆学,赵丽娜,解庆刚,霍贵成,李柏良,*
(1.东北农业大学食品学院,黑龙江 哈尔滨 150030;2.黑龙江飞鹤乳业有限公司,黑龙江 齐齐哈尔 164800)
人与动物的肠道环境营养丰富,由大量复杂的微生物聚集而成,其中包括大量益生菌。益生菌是通过定植在人体内,改变宿主某一部位菌群组成的一类对宿主有益的活性微生物[1]。越来越多的研究表明,益生菌在动物早期肠道发育、免疫系统分化、上皮细胞增殖等肠道生长发育过程中发挥作用[2]。例如王世杰等[3]通过动物实验证实,早期应用副干酪乳杆菌(Lactobacillus paracasei)N1115可促肠上皮细胞增殖分化,完善紧密连接结构完整及肠道黏膜屏障作用。Resta-Lenert等[4]研究发现,嗜热链球菌(Streptococcus thermophilus)和嗜酸乳杆菌(Lactobacillus acidophilus)可提高磷酸肌醇3激酶信号分子通路、ERK、p38、c-Jun氨基末端激酶活力,上调Occludin和ZO-1蛋白磷酸化表达量。
双歧杆菌作为人体早期肠道发育的优势菌群,定植在结肠区域,是益生菌的重要组成部分。研究表明双歧杆菌在人类健康中发挥着重要作用,具有防治便秘[5]、抑制肠道致病菌[6]、调节肠道平衡、降低胆固醇[7]、促进营养物质消化吸收、延缓衰老[8]和增强机体免疫活性[9]等生理功能。肠道中定植的双歧杆菌的种类和数量可一定程度上反映机体的健康功能[10-12]。
肠道是机体消化吸收能量等营养物质的重要场所,肠道发育对于维持机体健康具有重要意义。婴儿出生时肠道发育尚未成熟,更容易出现感染、产后生长受限和坏死性小肠结肠炎等疾病。产后早期是新生儿肠胃结构和功能发育的关键时期,当肠道发育不良或受到外界损伤刺激后,可通过分子水平的相关机制刺激肠道上皮细胞增殖并对其实施调控。目前一些研究表明,某些双歧杆菌的胞外蛋白、益生菌代谢产物丁酸及其盐类[13]、益生菌细胞壁中肽聚糖的水解产物胞壁酰二肽[14]等可参与维持肠道良好形态、干预肠道细胞增殖分化、调节肠道上皮紧密连接蛋白的合成,从而促进肠道成熟、修复应激损伤[15]。而近年来关于双歧杆菌如何作用于肠细胞并干预其增殖未知,其作用机制研究尚不深入,具有促肠上皮细胞增殖功能的潜力双歧杆菌有待开发,综上,筛选出对人胎结肠上皮细胞具有促进增殖潜力的婴儿源双歧杆菌,对于肠道发育的生物功能的调控、对促进婴幼儿早期肠道发育成熟以及临床肠道损伤修复具有重要意义。
本实验以婴儿粪便中分离出的15 株双歧杆菌为研究对象,对其促进CCD841 CoN细胞增殖的性质进行研究,通过主成分分析(principal component analysis,PCA)的方法筛选出促增殖效果最好的双歧杆菌,并对筛选出的菌株进行形态学特征、生长特性、环境耐受性、黏附性、安全性等生物学性质的评价。
1 材料与方法
1.1 材料与试剂
人胎结肠上皮CCD841 CoN细胞由东北农业大学孟祥晨教授赠送;mMRS培养基(MRS培养基中添加0.05%L-半胱氨酸盐酸盐) 北京Biotopped公司;血平板培养基郑州人福博赛生物技术有限公司;胎牛血清 加拿大Wisent公司;高糖DMEM培养基 美国HyClone公司;胰蛋白酶 美国Sigma公司;0.25%青霉素-链霉素双抗和胰蛋白酶-EDTA 美国Gibco公司;与细胞培养相关产品 无锡耐思公司;Cell Counting Kit-8(CCK-8)大连Meilune公司;0.22 μm滤膜 美国Millipore公司;青霉素等药敏试纸 杭州滨和微生物试剂有限公司;磷酸盐缓冲液(pH 7.2)、戊二醛、无水乙醇、叔丁醇 天津市富宇精细化工有限公司。
1.2 仪器与设备
Heal Force型细胞培养箱 力康医疗生物科技控股有限公司;DU800紫外-可见分光光度计 美国Beckman公司;DMLB型光学显微镜 德国徕卡显微镜与系统公司;680型酶标仪 美国Biorad公司;LDZF-50KB-II立式蒸汽灭菌器 上海申安医疗器械厂;CJ-2D超净工作台 天津泰斯特仪器有限公司;DHP-927型电热恒温培养箱 上海一恒科技有限公司;JY-92-IIN超声波细胞粉碎机 宁波新芝生物科技股份有限公司;3-15台式冷冻高速离心机 美国Sigma公司;YDS-10液氮生物容器 成都金凤液氮容器有限公司;DW-86L626超低温冰箱 青岛海尔集团;DELTA 320 pH计 美国Mettler-Toledo公司;SU8010电子显微镜 日本日立公司。
1.3 方法
1.3.1 细胞培养
将细胞冻存管于37 ℃水浴锅内快速融化;在超净台中将冻存液迅速转移至加有3 mL完全高糖DMEM培养基的15 mL无菌离心管中,1 000 r/min离心5 min,去上清液;用5 mL高糖DMEM培养基重悬细胞后转移至50 mL细胞培养瓶中;于5% CO2培养箱中37 ℃培养;隔天更换新鲜培养基。待细胞贴壁生长为单层且培养瓶底部80%左右被细胞覆盖时,磷酸盐缓冲溶液(phosphate buffered saline,PBS)洗涤2 次,加1 mL胰蛋白酶消化30 s,加入1 mL高糖DMEM培养基终止消化。将消化下来的细胞转移至15 mL无菌离心管,离心后弃上清液,加入2~3 mL新鲜培养基重悬细胞,混匀后分瓶,并补加4 mL新鲜培养基,于5% CO2培养箱37 ℃传代培养。
1.3.2 双歧杆菌分离培养与鉴定
采集黑龙江哈尔滨地区14 名母乳喂养健康婴儿的粪便样品。取新鲜粪便样品置于加有预还原液(L-半胱氨酸盐酸盐3 g/L,大豆蛋白胨2 g/L,121 ℃灭菌15 min)的无菌取样管中,将粪便样品用稀释液10 倍梯度稀释,在10-6、10-7稀释度下分别取100 µL涂布于mMRS固体培养基中,37 ℃厌氧培养48~72 h后,选取光滑、凸起、边缘水润的白色或乳白色菌落镜检。将呈V、Y或两端钝圆的杆状形态菌落划线于mMRS培养基中,在严格厌氧条件下37 ℃培养72 h,选取革兰氏染色为阳性的菌落,重复划线纯化,直至获得镜检为纯菌株为止。挑取菌落接种于mMRS液体培养基中,37 ℃培养24 h以活化,经相同方法传代2 次,其中第3次的培养时间为16 h,活化所获得菌液可通过梯度稀释法进行平板计数,确定稳定期的活菌数。
细菌基因组DNA的提取、16S rDNA基因片段扩增反应的上下游引物、聚合酶链式反应(polymerase chain reaction,PCR)扩增反应总体系以及扩增条件参照张秋雪等[16]的方法。最后将扩增后得到的PCR产物进行1%琼脂糖凝胶电泳,若扩增产物长度为1 500 bp左右且无杂带,再将其送至测序公司进行双向测序。将得到的16 S测序结果在美国国立生物技术信息中心进行BLAST比对,确定目的基因的归属。运用Mega 7.0软件并采用Neighbor-Joining方法构建系统发育树。
1.3.3 供试样品的制备
参照陈漪汶等[17]的方法,略作修改,具体方法如下:
活菌悬液:取培养16 h的培养液,10 000 r/min离心15 min,PBS洗涤菌体3 次。用PBS重悬菌体,调整双歧杆菌的菌数至107CFU/mL。
活菌上清液:取培养16 h的培养液,用双蒸水调整双歧杆菌浓度至107CFU/mL,10 000 r/min离心15 min,用0.22 μm微孔滤膜过滤上清液,即为发酵上清液。
活菌裂解液:取培养16 h的培养液,10 000 r/min离心15 min,PBS洗涤菌体3 次,用无菌水调整双歧杆菌浓度至107CFU/mL,冰浴中超声裂解细胞(工作功率300 W、工作时间2 s、间隔3 s、持续15 min),显微镜下观察无完整菌体,破碎液于4 ℃、10 000 r/min离心20 min,收集上清液,即为活菌裂解液。
灭活菌悬液:取培养16 h的培养液,65 ℃水浴30 min,10 000 r/min离心15 min,PBS洗涤菌体后离心,重复3 次。用PBS重悬菌体,调整双歧杆菌浓度至107CFU/mL。取灭活菌悬液100 μL涂布于mMRS固体培养基,37 ℃培养48 h,无菌生长即证明灭活菌悬液制备成功。
灭活菌上清液:取培养16 h的培养液,65 ℃水浴30 min,即得双歧杆菌灭活上清液。用双蒸水将调整乳酸菌浓度至107CFU/mL,10 000 r/min离心15 min,用0.22 μm微孔滤膜过滤上清液,即为灭活双歧杆菌发酵上清液。取灭活上清液100 μL涂布于mMRS固体培养基,37 ℃培养48 h,无菌生长即证明灭活菌上清液制备成功。
灭活菌裂解液:取培养16 h的培养液,65 ℃水浴30 min,10 000 r/min离心15 min,收集菌体,并用磷酸缓冲液(pH 7.4)洗涤3 次后,用无菌水调整双歧杆菌浓度,在冰浴中超声破碎细胞(工作功率300 W、工作时间2 s、间隔3 s、持续15 min),显微镜下观察无完整菌体,破碎液于4 ℃、10 000 r/min离心20 min,收集上清液,即为胞内提取物。取灭活菌裂解液100 μL涂布于mMRS固体培养基,37 ℃培养48 h,无菌生长即证明灭活菌裂解液制备成功。
1.3.4 CCK-8法检测双歧杆菌对CCD841 CoN细胞的增殖促进作用
参照赵桉等[18]的方法,略作修改。当培养瓶中的细胞贴壁生长为单层且培养瓶底部80%左右被细胞覆盖时,弃培养液,PBS清洗3 次,用胰蛋白酶消化30 s后吹匀,l 000 r/min离心5 min,弃上清液,用含双抗DMEM培养液调整细胞浓度为105个/mL,每孔100 μL细胞悬液接种于96 孔培养板,5% CO2培养箱中37 ℃静置过夜,弃培养液,PBS清洗3 次,加入200 μL不含双抗的高糖DMEM菌悬液。同时设置空白对照组,每组设置5 个重复孔。将15 株菌的活菌悬液、灭活菌悬液、活菌上清液、灭活菌上清液、活菌裂解液及灭活菌裂解液与CCD841 CoN细胞共作24 h,弃培养液,PBS清洗3 次,每孔加110 μL混合液(100 μL无双抗DMEM培养液+10 μL CCK-8),孵育1 h后酶标仪测波长450 nm处光密度(OD)。增殖率和增殖活性百分比按式(1)、(2)计算:

1.3.5 PCA
对分离得到的15 株婴儿源双歧杆菌进行促CCD841 CoN细胞增殖评价实验,分别以上述双歧杆菌的活菌与灭活菌的菌悬液、上清液及裂解液对CCD841 CoN细胞的增殖率作为指标进行PCA,以期筛选出性能最优的益生菌。
1.3.6 生长曲线和产酸曲线的测定
参照焦雯姝[19]的方法,略作修改。菌株活化后以2%的接种量接种于mMRS液体培养基中,37 ℃厌氧培养24 h,每2 h取1 次培养液,测其OD600nm和pH值。
1.3.7 形态学特征
1.3.7.1 菌落菌体形态观察
将活化后性能优良的双歧杆菌菌株涂布于mMRS固体培养基,置于37 ℃培养48 h,取出并观察菌落形态;选取一个较大菌落,挑取其中的1/2菌落,进行革兰氏染色、油镜观察菌体形态。
1.3.7.2 扫描电镜观察菌体形态
参照杨靖鹏等[20]的方法,略作修改。将双歧杆菌菌液以1 200 r/min离心2 min,将菌泥转入1.5 mL EP管中预冷的2.5%戊二醛固定,4 ℃过夜。用0.1 mol PBS(pH 6.8或pH 7.2)漂洗10 min×3 次;梯度脱水:50%乙醇脱水10 min,70%乙醇脱水10 min,90%乙醇脱水10 min,100%乙醇脱水10 min×3 次;置换:100%乙醇-叔丁醇(1∶1,V/V)溶液,纯叔丁醇各1 次,各15 min。干燥:将样品置于-20 ℃冰箱30 min,冻干4 h。离子溅射镀膜仪在样品表面镀一层100~150 Å金属膜。冷场发射扫描电镜,电压1.0 kV,放大倍率15 000~30 000。
1.3.8 耐受性评价
参照蒙月月等[21]的方法,略作修改。使用0.1 mol/L的HCl溶液对mMRS液体培养基的pH值进行调整,使培养基的pH值为4、5、6。使用牛胆盐对mMRS液体培养基的胆盐浓度进行调整,使培养基的胆盐质量浓度为0.03、0.3、0.5 g/100 mL。菌株活化后以2%的接种量分别接种于经过处理的液体培养基中,37 ℃条件下恒温培养,并于0、1、2、3 h取样,采用平板计数法对活菌数进行测定,计算菌株的存活率并分析其耐酸能力。存活率按式(3)计算:

1.3.9 黏附性评价
参照岳莹雪等[22]的方法,略作修改。
将CCD841 CoN细胞按照2×105个/孔的浓度接种至12 孔板中,37 ℃条件下于CO2培养箱中恒温培养至长成单层细胞后,进行黏附实验。PBS清洗孔板2 次,加入1 mL菌体悬液(108CFU/mL)(V0),每个样品重复3 孔,在CO2培养箱中37 ℃孵育2 h。孵育后PBS清洗孔板2 次,洗去未黏附细菌。加胰酶消化30 s后加1 mL含血清高糖DMEM培养液终止消化。收集孔内溶液并分别进行梯度稀释,采用平板菌落计数法检测培养后菌株的活菌数(V1)。黏附率按式(4)计算:

1.3.10 抗生素抗性实验
参照高文文等[23]的方法,略作修改。
将待测菌株以2%的接种量接种于mMRS液体培养基中,37 ℃厌氧培养12 h后,吸取100 µL菌悬液涂布于mMRS固体培养基上,干燥后分别镊取各种药敏纸片贴于培养基表面,37 ℃厌氧培养48 h后,用游标卡尺测量抑菌圈直径。
1.3.11 溶血实验
超净台中在血平板培养基上划线,同时以金黄色葡萄球菌ATCC 25923作为阳性对照,37 ℃培养48 h,观察有无溶血圈出现[24]。菌落周围的琼脂出现绿色,则α-溶血;菌落周围出现透明圈,则β-溶血;否则为γ-溶血,即不溶血。
1.3.12 不同条件下K2-21-4对CCD841 CoN细胞增殖活性的影响
将 103、 104、 105、 106、 107、 108CFU/mLBifidobacterium longumK2-21-4的活菌悬液、灭活菌悬液分别与CCD 841 CoN细胞共作24、48 h,细胞增殖活性百分比、增殖率测定方法见1.3.4节。
1.4 数据处理
2 结果与分析
2.1 婴儿源双歧杆菌的分离鉴定
选取14 份健康婴儿的新鲜粪便进行梯度稀释以及涂布平板,随机挑取若干株单菌落,纯化后进行16S测序,选取16S rDNA同源性99%以上的模式菌株序列,对分离得到的双歧杆菌菌株构建系统发育树(图1)。由16S rDNA同源性分析结果可知,有13 株菌(K4-4、K6-1、K4-3、K3-4、K24-1、K2-21-4、K13-4、H5-6、B13-2、K6-3、I2-2-3、K2-21-2、K2-21-3)均与B.longumATCC 15707 16S rDNA亲缘关系接近,判定为长双歧杆菌长亚种;1 株菌(I2-2-1)与B.pseudocatenulatumNWAFU0003 16S rDNA亲缘关系最近,判定为假小链双歧杆菌;1 株菌(E7-1)与B.dentiumBRDF5 16S rDNA亲缘关系最近,判定为齿双歧杆菌。
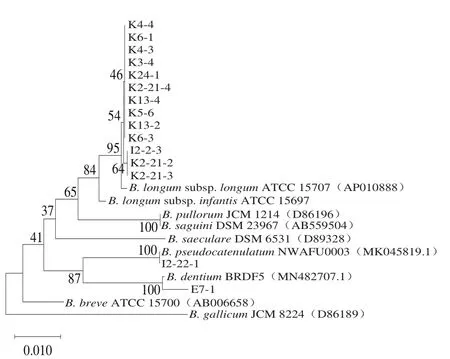
图1 基于16S rDNA基因序列构建双歧杆菌系统发育树Fig.1 Phylogenetic tree of Bifidobacterium based on 16S rDNA gene sequences
2.2 具有促进CCD841 CoN细胞增殖的双歧杆菌筛选
2.2.1 双歧杆菌菌悬液对CCD841 CoN细胞增殖的影响
增殖活性百分比可用于表示与细胞正常增殖的差异,当增殖活性百分比大于1时,表示对于细胞增殖具有促进作用,反之,则有抑制作用。由图2可知,B.longumK2-21-4活菌悬液对于CCD841 CoN细胞的促增殖作用效果最佳,增殖活性百分比为160.67%,此外B.longumK4-3、B.pseudocatenulatumI2-22-1、B.longumK2-21-2、K6-3、B13-2、K24-1、K3-4、K2-21-3活菌悬液也对CCD841 CoN细胞增殖有促进作用,增殖率分别为40.84%、33.24%、27.78%、25.58%、22.74%、10.85%、4.99%、1.97%。

图2 各菌株活菌悬液、灭活菌悬液对CCD841 CoN细胞的增殖促进作用Fig.2 Promoting effect of live and inactivated cell suspensions of each isolate on CCD841 CoN cells
15 株双歧杆菌的灭活菌悬液处理CCD841 CoN细胞后的细胞增殖活性百分比为90.16%~119.68%,峰值较活菌悬液处理组(160.67%)低。15 株双歧杆菌中有9 株菌的灭活菌悬液对CCD841 CoN细胞有促进作用,增殖活性百分比分别为B.longumK2-21-4(119.53%)、K13-4(119.68%)、H5-6(118.22%)、K24-1(109.09%)、K6-1(104.02%)、K4-4(103.92%)、K4-3(103.51%)、K2-21-2(101.86%)、I2-2-3(101.81%)。
2.2.2 双歧杆菌上清液对CCD841 CoN细胞增殖的影响
由图3可知,B.dentiumE7-1(132.02%)、B.longumK6-3(129.69%)、K2-21-2(128.21%)、K2-21-4(126.52%)活菌上清液对于CCD841 CoN细胞具有显著促增殖作用(P<0.05),此外B.longumK2-21-3、K13-4、K24-1、K4-4活菌上清液也对CCD841 CoN细胞增殖有促进作用,增殖率分别为20.65%、10.12%、8.43%、1.22%。

图3 各菌株活菌上清液、灭活上清液对CCD841 CoN细胞的增殖促进作用Fig.3 Promoting effect of culture supernatants of live and inactivated cells of each isolate on CCD841 CoN cells
15 株双歧杆菌的灭活菌上清液处理CCD841 CoN细胞后的细胞增殖活性百分比为100.98%~117.12%,均表现为促进作用,其中B.longumK2-21-4增殖率为17.12%,显著高于其他菌株(P<0.05)。
2.2.3 双歧杆菌裂解液对CCD841 CoN细胞增殖的影响
由图4可知,B.longumK2-21-3活菌裂解液对于CCD841 CoN细胞的促增殖作用效果最佳,增殖活性百分比为118.47%。此外B.longumK6-1(114.74%)、K13-4(111.93%)、I2-2-3(110.61%)、B.pseudocatenulatumI2-22-1(110.48%)、K2-21-2(105.39%)、K6-3(103.20%)、K3-4(100.79%)、K4-4(100.61%)活菌裂解液也对CCD841 CoN细胞增殖有促进作用。

图4 各菌株活菌裂解液、灭活裂解液对CCD841 CoN细胞的增殖促进作用Fig.4 Promoting effect of live and inactivated cell lysates of each isolate on CCD841 CoN cells
15 株双歧杆菌的灭活菌悬液处理CCD841 CoN细胞后的细胞增殖活性百分比为70.23%~135.44%,峰值较活菌裂解液处理组高(118.47%)。此外,15 株双歧杆菌中还有7 株菌的灭活菌裂解液对CCD841 CoN细胞有促进增殖作用,分别为B.pseudocatenulatumI2-22-1(135.44%)、B.longumK6-3(134.86%)、K6-1(130.67%)、K24-1(114.32%)、B13-2(102.64%)、K4-3(100.58%)、K2-21-2(100.41%)。
2.3 PCA结果
如图5A所示,PC1和PC2共占总变量的51.373%,PC1解释为活菌悬液、灭活菌上清液、活菌裂解液。PC2解释为灭活菌悬液、活菌裂解液。根据图5B和表1可以看出,K2-21-4的综合得分最高,为2.18,其次为K21-4、H5-6得分分别为0.79、0.76,I2-2-3的综合得分最低。该结果表明B.longumK2-21-4是15 株益生菌中具有促肠上皮细胞增殖性能且效果最好的益生菌。
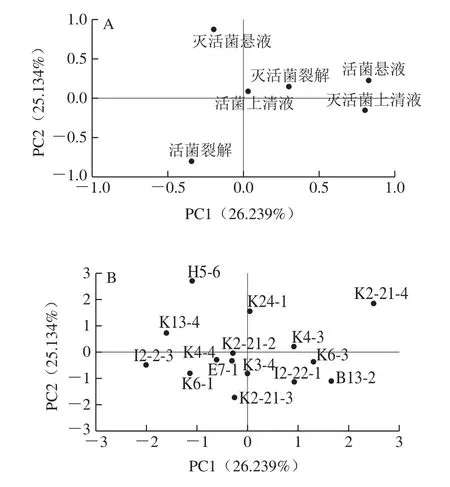
图5 因子载荷图(A)和因子得分图(B)Fig.5 PCA loading (A) and score plots (B)
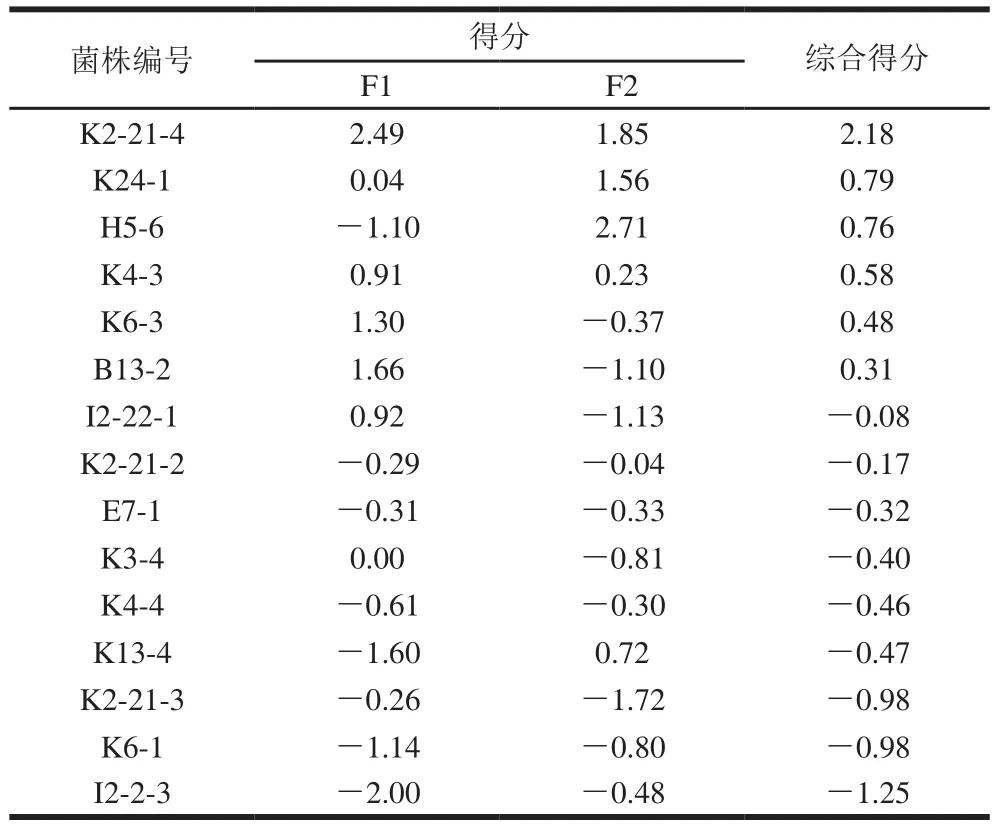
表1 各菌株因子得分Table 1 Scores of first principal components for each strain
2.4 长双歧杆菌K2-24-1生物学性质
2.4.1 生长曲线、产酸曲线的测定
如图6所示,B.longumK2-21-4在0~8 h为生长迟滞期,8~20 h后进入对数生长期,OD600nm值由0.1迅速提高至1.8,此时K2-21-4的生长速度较快。20 h后进入稳定期,OD600nm值基本不变,最终稳定在1.8左右。长双歧杆菌在发酵过程中,因其产生大量乙酸、乳酸和少量甲酸等脂肪酸而使pH值有所降低,从而抑制肠道中有害菌和致病菌的生长。处于对数生长期与迟滞期的菌株相比,其生长更加旺盛,故pH值由5.5到pH 4.4降低较快。而稳定期的菌株生长逐渐稳定,代谢产物含量无显著提升,从而导致pH值也缓慢降低,最终稳定在pH 4.3左右。

图6 长双歧杆菌K2-21-4的生长曲线和pH值曲线Fig.6 Growth curve of B.longum K2-21-4 and pH variations during its culture
2.4.2 菌落形态与菌体形态观察
分离株B.longumK2-21-4在mMRS固体培养基上培养24 h后,菌落形态如图7A所示,为规则圆形凸起,边缘整齐、直径1~3 mm,不透明、乳白色、表面湿润光滑、挑起后成拉丝状。如图7B所示,菌体成短杆状,单个或成对出现,革兰氏染色阳性。如图7C所示,菌体成短杆状,与光学显微镜观察结果一致。

图7 长双歧杆菌K2-21-4菌落形态(A)、菌体形态(B)及扫描电镜观察菌体形态(C)Fig.7 Colony morphology (A), cell morphology (B) and scanning electron microscopic observation (C) of B.longum K2-21-4
2.4.3 耐受性评价
如图8A所示,长双歧杆菌在pH 6、5、4的mMRS培养基中孵育3 h后,K2-21-4的存活率显著降低(P<0.05),说明B.longumK2-21-4对pH 4、5、6的耐受能力较差,且酸性越强对长双歧杆菌的胁迫越大。
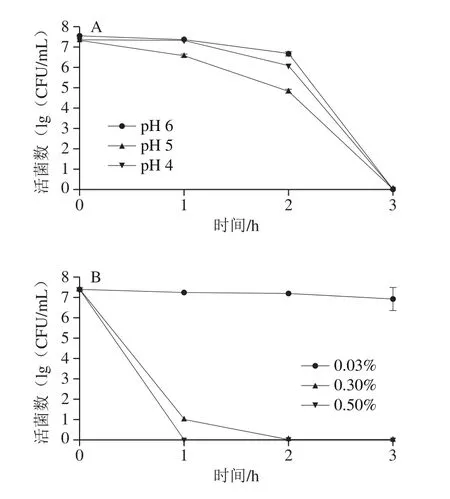
图8 长双歧杆菌K2-21-4的酸耐受曲线(A)及胆盐耐受曲线(B)Fig.8 Acid tolerance curve (A) and bile salt tolerance curve (B) of B.longum K2-21-4
如图8B所示,B.longumK2-21-4存活率随胆盐质量分数升高而快速降低。当胆盐质量分数为0.03%时,3 h后其存活率为93.70%,而其他质量分数下,3 h后菌株存活率均为0%。结果表明B.longumK2-21-4对质量分数0.03%胆盐有较好的耐受能力,但对质量分数0.3%、0.5%胆盐无耐受能力。
有报道显示益生菌只有在达到一定数量才可发挥益生功能,而B.longumK2-21-4对于酸胁迫、胆盐胁迫耐受性不高,因此将B.longumK2-21-4作为潜在功能性益生菌开发时,需对其进行进一步包埋或其他方式处理,保证其在肠道中的存活率。
2.4.4 黏附性评价
为更好评价B.longumK2-21-4的黏附性,实验以15 株双歧杆菌及商业菌株Lactobacillus animalisBB12为对照,研究双歧杆菌对CCD841 CoN细胞的黏附能力,结果如图9所示。实验中B.longumK2-21-4的黏附能力显著高于其他菌株,黏附率达6.6%,仅次于商业菌株Lactobacillus animalisBB12黏附性(7.5%)。其余高黏附性菌株的黏附率依次为B.pseudocatenulatumH5-6>B.longumB13-2>B.pseudocatenulatumI2-22-1>B.dentiumE7-1>B.dentiumK4-4,分别为5.85%、3%、2.33%、2.30%和2.16%,其他菌株黏附率较低均不足1%。B.longumK2-21-4的高黏附性或与其在扫描电子显微镜观察下菌体表面具有菌毛的显微结构有关,这可以从一定程度上解释该菌株具有较好促CCD841 CoN细胞增殖效果的原因。同时,15 株双歧杆菌对细胞的黏附能力存在菌种差异性的同时也存在菌株差异性,这与占萌等[25]研究结果相符。Maldonadogómez等[26]的结果也证明长双歧杆菌具有良好定植性并表现出菌株特异性。

图9 15 株双歧杆菌对CCD841 CoN细胞的黏附率Fig.9 Adhesion rates of 15 isolates to CCD841 CoN cells
2.4.5 抗生素抗性实验
检测B.longumK2-21-4对12 种抗生素的敏感性,并将金黄色葡萄球菌S.aureusATCC 25923作为质控菌株,质控范围依据NCCLS药敏实验标准执行。如图10所示,该菌对链霉素、卡那霉素、庆大霉素、环丙沙星具有抗性,对青霉素、红霉素、罗红霉素中度敏感,对阿莫西林、万古霉素、四环素、利福平、氯霉素敏感。有文献报道干酪乳杆菌、鼠李糖乳杆菌以及植物乳杆菌等乳酸菌天然对糖肽类抗生素如万古霉素具有普遍耐受性,而K2-21-4则对万古霉素表现出敏感[27]。表2结果表明,B.longumK2-21-4对喹诺酮类、氨基糖苷类部分抗生素耐受,这可能是由于双歧杆菌产生分解氨基糖苷类的酶,从而使其对此类抗生素耐受,与相关文献[27]报道的此类抗生素对革兰氏阳性菌效果普遍较差一致。刘奋[28]研究发现双歧杆菌对青霉素、氯霉素、氧氟沙星等药物仍普遍敏感,这一结果与实验菌株K2-21-4相似。石晶红[27]研究发现实验菌株对特定抗生素是否敏感,是菌株本身的特性。

图10 长双歧杆菌K2-21-4对抗生素的抗性Fig.10 Resistance of B.longum K2-21-4 to several antibiotics

表2 长双歧杆菌K2-21-4对抗生素的抗性Table 2 Resistance of B.longum K2-21-4 to several antibiotics mm
2.4.6 溶血实验
某些益生菌可能具有潜在的溶血性,从而引起败血症[29]。通过在含有动物或人血的培养基上培养微生物观察有溶血活性引起的物理变化是评估溶血性的常用方法[30]。由图11可知,阳性对照Staphylococcus aureusATCC 25923菌落周围可见明显透明圈,即致病性较强的β-溶血,而B.longumK2-21-4菌落周围未溶血,菌落外围无颜色变化,不具有溶血性。

图11 金黄色葡萄球菌ATCC 25923(A)和长双歧杆菌K2-21-4(B)溶血活性Fig.11 Hemolysin activities of S.aureus ATCC 25923 (A) and B.longum K2-21-4 (B)
2.4.7 长双歧杆菌K2-21-4浓度和处理时间对CCD841 CoN细胞增殖活性的影响
为进一步确定B.longumK2-21-4对CCD841 CoN细胞增殖促进作用的最佳条件,研究不同活性状态、添加浓度和培养时间下B.longumK2-21-4对CCD841 CoN细胞的增殖促进作用。由图12可知,当活菌与细胞共作24 h时,细胞增殖活性百分比呈现出一定的浓度依赖,当活菌浓度达到107CFU/mL时,对细胞的增殖促进作用显著提高(P<0.05),与108CFU/mL活菌无显著差异(P>0.05)。当活菌与细胞共作48 h时,细胞增殖活性百分比普遍低于同剂量活菌共作24 h的效果,当活菌浓度达到107CFU/mL时,对细胞的增殖促进作用最好,而108CFU/mL时则显著降低(P<0.05)。灭活菌与细胞共处理24 h后,灭活菌剂量达107CFU/mL时,细胞增殖活性百分比显著提升,与108CFU/mL灭活菌组差异不显著(P>0.05)。灭活菌与细胞共处理48 h后,细胞增殖活性百分比普遍低于同剂量活菌共作24 h的效果,其中108CFU/mL灭活菌组对细胞增殖表现出显著抑制作用。

图12 菌浓度及处理时间对CCD841 CoN细胞增殖的影响Fig.12 Promoting effect of live and inactivated cells of B.longum K2-21-4 at different concentrations on the proliferation of CCD841 CoN cells ater co-culture for different durations
添加107CFU/mL长双歧杆菌K2-21-4活菌与细胞共作24 h的细胞增殖促进作用,显著高于其他浓度活菌与细胞共作24、48 h(P<0.05),在此条件下,细胞增殖率可达60.67%,是活菌悬液对细胞增殖促进作用的最佳条件。添加107CFU/mL长双歧杆菌K2-21-4灭活菌与细胞共作24 h的细胞增殖促进作用,显著高于其他浓度灭活菌与细胞共作24、48 h(P<0.05),此时细胞增殖率可达20.09%,是灭活菌悬液对细胞增殖促进作用的最佳条件。
3 结 论
本实验从健康婴儿新鲜粪便中分离得到15 株双歧杆菌(经16S同源性比对为13 株长双歧杆菌、1 株假小链双歧杆菌、1 株齿双歧杆菌),以此作为研究对象,以双歧杆菌活菌及灭活菌的菌悬液、发酵上清液及裂解液对人胎结肠细胞CCD841 CoN细胞增殖的促进作用为筛选指标,筛选出对结肠上皮细胞具有促进增殖效果的益生菌。结果显示,一些双歧杆菌活菌悬液、菌体细胞破碎液及菌体发酵上清液具有一定促进效果,且不同菌株实验效果不同。PCA结果表明B.longumK2-21-4的得分最高,故对其生物学性状进一步分析。结果显示K2-21-4具有良好黏附性,但对酸、胆盐耐受能力较差,抗生素抗性实验结果表明菌株K2-21-4对阿莫西林、万古霉素、四环素、氯霉素及利福平具有耐药性,107CFU/mL长双歧杆菌K2-21-4活菌与细胞共作24 h的细胞增殖促进作用最佳。以上研究结果表明B.longumK2-21-4具有潜在的应用价值。

