喉咽清口服液抗炎活性成分的筛选
欧阳文 罗懿钒 #唐代凤王雄龙张云坤周华荣于炜民曾颖陈韬刘梓琛胡云舒唐 琴陈 林郭丽娟唐纯玉*李顺祥*
(1.湖南中医药大学药学院,湖南 长沙410208; 2.湖南省中药活性物质筛选工程技术研究中心,湖南长沙410208; 3.湖南时代阳光博士后科研流动站协作研发中心,湖南 永州410116; 4.湖南时代阳光药业股份有限公司,湖南 永州410116; 5.湖南省抗感染中药工程技术研究中心,湖南 永州410116; 6.湖南食品药品职业学院,湖南 长沙 410208)
喉咽清口服液来源于民间验方,由土牛膝、马兰草、天名精、车前草4 味药材组成,具有清热解毒、利咽止痛的功效,主要用于肺胃实热所导致的咽部肿痛、发热、口渴、便秘、扁桃体炎、咽炎等症状[1],为湖南时代阳光药业股份有限公司自主研制开发的国家级新药。孙建辉等[2]采用滴鼻感染甲型H1N1 流感病毒FM1 株建立小鼠流感病毒肺炎模型,发现喉咽清口服液高、中、低剂量组(15.60、7.80、3.90 g/kg)小鼠体质量明显高于模型组,并且高、中剂量组存活时间明显延长,高剂量组肺指数值、死亡率明显降低,在感染第6、9 天高剂量组肺组织病毒载量明显降低,表明该制剂对甲型流感病毒性肺炎具有一定治疗作用。在新型冠状病毒肺炎(COVID⁃19)的治疗过程中,喉咽清口服液(颗粒)于2020 年2 月7 日被湖南省卫生健康委纳入《湖南省儿童新型冠状病毒感染临床诊断与治疗专家共识(试行第一版)》,用于儿童新型冠状病毒感染的防治,适于咽痛偏于风热者[3]。
炎症风暴又称细胞因子风暴,是指机体感染微生物后引起体液中多种细胞因子[如肿瘤坏死因子⁃α(TNF⁃α)、白细胞介素⁃1(IL⁃1)、白细胞介素⁃6(IL⁃6)、环氧化酶⁃2(COX⁃2)、NO 等] 迅速大量产生的现象,促使免疫系统对人体进行猛烈攻击,引起急性呼吸窘迫综合征和多脏器衰竭[4]。在COVID⁃19、埃博拉病毒、SARS 等传染性疾病中,炎症风暴是轻中症患者向重症或危重症转换的节点,同时也是患者死亡的原因之一,故阻断炎症风暴因子发生、抑制过多免疫细胞活化和细胞因子产生是重要的治疗手段。
临床上利用糖皮质激素(如地塞米松等)可非特异性抑制急性呼吸窘迫综合征炎症反应的特点来治疗COVID⁃19,但其不良反应(如二重感染、糖尿病、骨质疏松、高血压、骨坏死[5]等)较大,长期使用时更明显。当前,以清肺排毒汤等方剂为代表的中药全程参与了相关治疗,可明显改善症状,对于轻症可缩短病程,提高治愈率;对于重症能防止病情进一步发展,促进其恢复,其机制可能不是直接消灭病毒,而是通过抑制活化细胞因子、缓和过激免疫反应、消除炎症来达到作用[6⁃7]。
LPS 刺激小鼠单核巨噬细胞株RAW264.7 后,可诱导细胞产生多种相关介质和细胞因子(如NO、TNF⁃α、IL⁃6等),从而形成炎症细胞模型,被广泛应用于抗炎药物的筛选和评价。NO 作为炎症介质主要因子之一,在调节多种生理功能方面起到重要作用,如血管扩张、神经传递、炎症应答等,其释放量可用于评价炎症反应的强弱程度[8]。因此,本实验建立LPS 刺激的RAW264.7 炎症模型,通过测定NO 释放量分析喉咽清口服液的抗炎作用,并在此基础上筛选主要活性成分。
1 材料
1.1 药物 喉咽清口服液(批号20171108、20180705、20190716)、成型前喉咽清浸膏(批号20190716)由湖南时代阳光药业股份有限公司提供。
1.2 试剂 小鼠单核巨噬细胞株(RAW264.7)购于中国科学院上海细胞库。竹节参皂苷Ⅳa(PS010730)、竹节参皂苷Ⅴ(PS010731)对照品购于成都普思生物科技股份有限公司,纯度均大于98%。LPS、地塞米松、二甲基亚砜、MTT(美国Sigma 公司);DMEM 高糖培养基(美国Gibco公司);胎牛血清(FBS,德国Pan Seratech 公司);PBS 磷酸盐缓冲液(美国HyClone 公司);NO 检测试剂盒(上海碧云天生物技术有限公司)。ODS⁃AQ(50 μm,日本YMC公司);色谱纯乙腈、甲醇(德国Merck 公司);分析纯甲醇(湖南汇虹试剂有限公司)。
1.3 仪器 AL104 电子天平(万分之一,瑞士梅特勒⁃托利多公司);C18色谱柱(日本YMC 公司);高效液相色谱仪,配置LC⁃20A 二元高压梯度仪、SPD⁃20A 紫外检测仪(日本岛津公司);Ulimate 3000/TSQ ENDURA 液质联用仪、二氧化碳培养箱(美国Thermo 公司);R204B3 型旋转蒸发器(上海申顺科技有限公司);超净工作台(苏州艾克林净化设备有限公司);倒置显微镜(日本Olympus 公司);低速冷冻离心机(湖南湘仪实验室仪器开发有限公司);酶标仪(美国BioTek 公司);数显恒温水浴锅(上海齐欣科学仪器有限公司)。
2 方法
2.1 细胞培养 参照文献[9⁃10] 报道,将RAW264.7 细胞接种于细胞培养瓶后加到含10%灭活胎牛血清的DMEM培养基中,充分吹打混匀,置于37 ℃、5% CO2培养箱中培养,在光学显微镜下观察细胞生长状况,每天更换1 次培养基,取对数生长期的细胞进行后续试验。另外,还包括细胞传代、细胞冻存、细胞复苏等基本操作。
2.2 样品制备与单体结构分析 将喉咽清浸膏经ODS⁃AQ反相柱分离后,分别用水、10% 甲醇、30% 甲醇、50% 甲醇、70%甲醇、90%甲醇、甲醇、异丙醇进行洗脱,60 ℃下减压浓缩后冷冻干燥,得到相应洗脱部位,精密称取适量,DMSO(终体积不得超过0.1%)完全溶解,完全培养基配制成25、50、100、200、400、800、1 200 μg/mL 稀释液(现配现用),0.22 μm 微孔滤膜除菌,采用LC⁃MS 法进行结构鉴定,并结合对照品比对。LC 分析条件为Weltch Ultimate C18色谱柱(2.1 mm×100 mm,1.8 μm);流动相乙腈(A)⁃0.1%甲酸(B),梯度洗脱(0~1.5 min,40%A;1.5~8 min,40%~95% A;8~9.5 min,95% A;9.5~10 min,95%~40% A;10~12 min,40% A);体积流 量0.2 mL/min;柱温30 ℃;进样量5 μL。MS 分析条件为ESI-离子化模式;喷雾电压3 500 V;鞘气20 Arb;辅助气为10 Arb;离子传输管温度350 ℃;蒸发温度350 ℃;全扫描模式MS SCAN,扫描范围m/z100~1 000。在进行单体抗炎活性实验时,分别精密称取所鉴定成分,DMSO(终体积分数不得超过0.1%)完全溶解,完全培养基配制成3.13、6.25、12.5、25、50、100、200 μmol/L 稀释液(现配现用),0.22 μm 微孔滤膜除菌。
2.3 细胞毒性检测(MTT 法)称取25 mg MTT 于10 mL离心管中,加5 mL PBS 缓冲液配制成5 mg/mL 溶液,0.22 μm微孔滤膜除菌,4 ℃下避光保存,取生长状态良好、处于对数生长期的培养细胞,脱壁后用含10%灭活胎牛血清的DMEM 培养基配制成单细胞悬液,以3×104个/孔、每孔100 μL 接种于96 孔板中,置于37 ℃、5% CO2细胞培养箱中培养。设置空白组、对照组、样品组,其中空白组无细胞,对照组加入含100 μL 细胞的DMEM 培养基,样品组加入不同浓度样品(不同溶剂洗脱物、单体成分),使终体积为100 μL(共7 组),每组设3 个复孔,培养24 h。弃去旧培养基,再加入5 mg/mL MTT 溶液20 μL,置于37 ℃CO2培养箱中孵育4 h,弃去培养液,每孔加入150 μL DMSO 溶液,在培养板平台振荡机上振荡10 min,酶标仪490 nm 波长处测定各孔光密度(OD)值,计算细胞存活率,公式为存活率= [(样品组OD值-空白组OD值)/(对照组OD值-空白组OD值)] ×100%。
2.4 NO 释放量检测(试剂盒法)取处于对数生长期的培养细胞,脱壁后用含10%灭活胎牛血清的DMEM 培养基制成单细胞悬液,调节细胞浓度为3×104/mL,均匀接种于96 孔培养板上,每孔100 μL,置于37 ℃、5%CO2培养箱中培养24 h,弃去原培养液,设置正常组、模型组、样品组,其中正常组不加LPS 和样品;模型组在培养液中加入LPS 溶液(1 μg/mL);样品组为加入不同溶剂洗脱物、单体成分的100 μL 稀释培养基,每组设置3 个复孔,培养24 h后取上清液于离心管中。按照试剂盒说明书操作方法,将各试剂依次加入培养基中,酶标仪550 nm 波长处测定各孔光密度(OD)值,根据标准曲线检测NO 释放量。
2.5 抗炎活性成分含量测定(RP⁃HPLC 法)
2.5.1 色谱条件 YMC C18色谱柱(250 mm×4.6 mm,5 μm);流动相乙腈⁃0.5%磷酸(33 ∶67);体积流量1 mL/min;柱温30 ℃;检测波长203 nm。
2.5.2 溶液制备
2.5.2.1 对照品溶液 精密称取竹节参皂苷Ⅳa 对照品3.0 mg,流动相溶解定容于10 mL 量瓶中,过0.45 μm 微孔滤膜,即得(0.3 mg/mL)。
2.5.2.2 供试品溶液 将口服液充分摇匀后精密吸取2 mL,置于10 mL 量瓶中,“2.5.1”项下流动相超声定容,过0.45 μm 微孔滤膜,即得。
2.5.3 方法学考察
2.5.3.1 线性关系考察 精密吸取竹节参皂苷Ⅳa 对照品溶液0.5、1、2、4、8、10 μL,在“2.5.1”项色谱条件下进样测定,以进样量为横坐标(X),峰面积为纵坐标(Y)进行回归。
2.5.3.2 精密度试验 精密吸取竹节参皂苷Ⅳa 对照品溶液5 μL,在“2.5.1”项色谱条件下进样测定6 次,计算峰面积。
2.5.3.3 重复性试验 取同一份口服液(批号20190716)6 份,按“2.5.2.2”项下方 法制备 供试品溶液,在“2.5.1”项色谱条件下进样测定6 次,计算峰面积。
2.5.3.4 稳定性试验 取同一份口服液(批号为20180705),按“2.5.2.2”项下方法制备供试品溶液,室温下于0、2、4、8、12、24 h 在“2.5.1”项色谱条件下进样测定,计算峰面积。
2.5.3.5 加样回收率试验 精密吸取各成分含量已知的口服液0.5 mL,加入等量对照品溶液,流动相定容于5 mL量瓶中,微孔滤膜过滤,在“2.5.1”项色谱条件下进样20 μL 测定,计算回收率。
2.6 统计学分析 通过SPSS 22.0 软件进行处理,数据以()表示,组间比较采用t检验。P<0.05 表示差异具有统计学意义。
3 结果
3.1 LPS 质量浓度筛选 表1 显示,不同质量浓度LPS 对RAW264.7 细胞分泌的NO 均具有促进作用,并呈剂量依赖性;作用24 h 后,0.01~1 μg/mL LPS 对细胞无明显毒性,而在10 μg/mL 下细胞 存活率下降(P<0.05),100 μg/mL下更明显(P<0.01)。为了能最大限度刺激RAW264.7 细胞释放NO,并不影响其存活率,本实验采用1 μg/mL LPS 质量浓度。
表1 不同LPS 质量浓度下的NO 释放量和细胞存活率(, n=3)

表1 不同LPS 质量浓度下的NO 释放量和细胞存活率(, n=3)
注:与空白组(0 μg/mL)比较,*P<0.05,**P<0.01。
3.2 洗脱部位质量浓度筛选 表2 显示,洗脱部位质量浓度为400~1 200 μg/mL 时各部位细胞均有不同程度的死亡,低于200 μg/mL 时细胞存活率较高,即无明显细胞毒性。因此,本实验选择6.25、12.5、25、50、100、200 μg/mL进行下一步研究。
表2 不同洗脱部位质量浓度下的细胞存活率(, n=3)
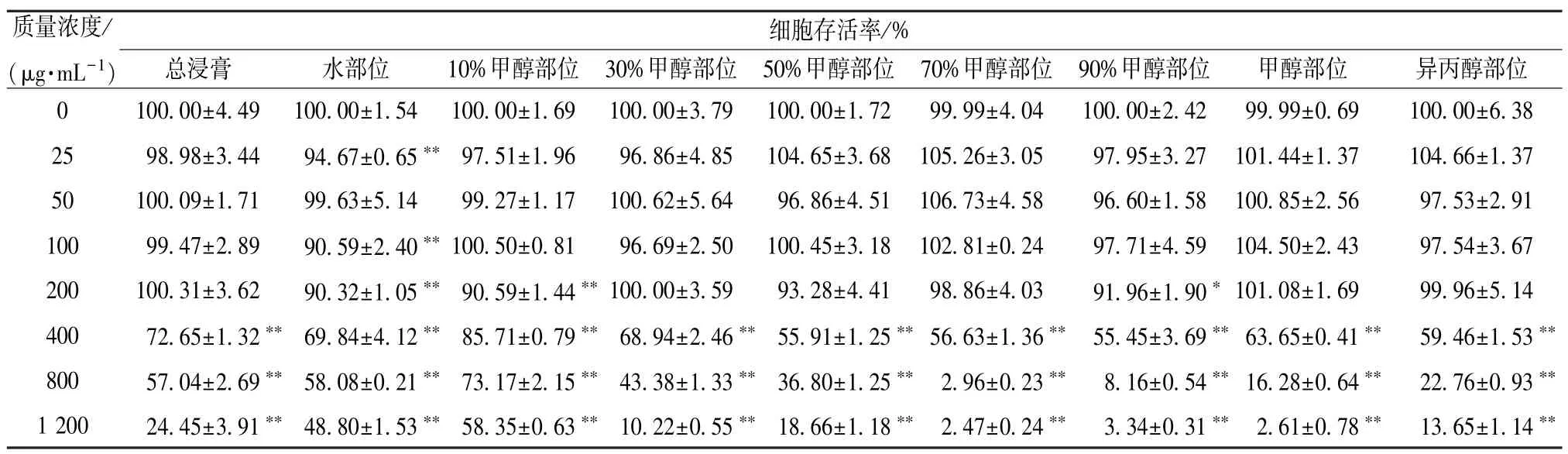
表2 不同洗脱部位质量浓度下的细胞存活率(, n=3)
注:与空白组(0 μg/mL)比较,*P<0.05,**P<0.01。
3.3 各洗脱部位对NO 释放量的影响 表3 显示,与模型组比较,各洗脱部位组均呈剂量依赖性地降低NO 释放量,以70%甲醇部位体外抑制作用最强,IC50为35.25 μg/mL,是最佳活性部位。
表3 各洗脱部位对NO 释放量的影响(, n=3)
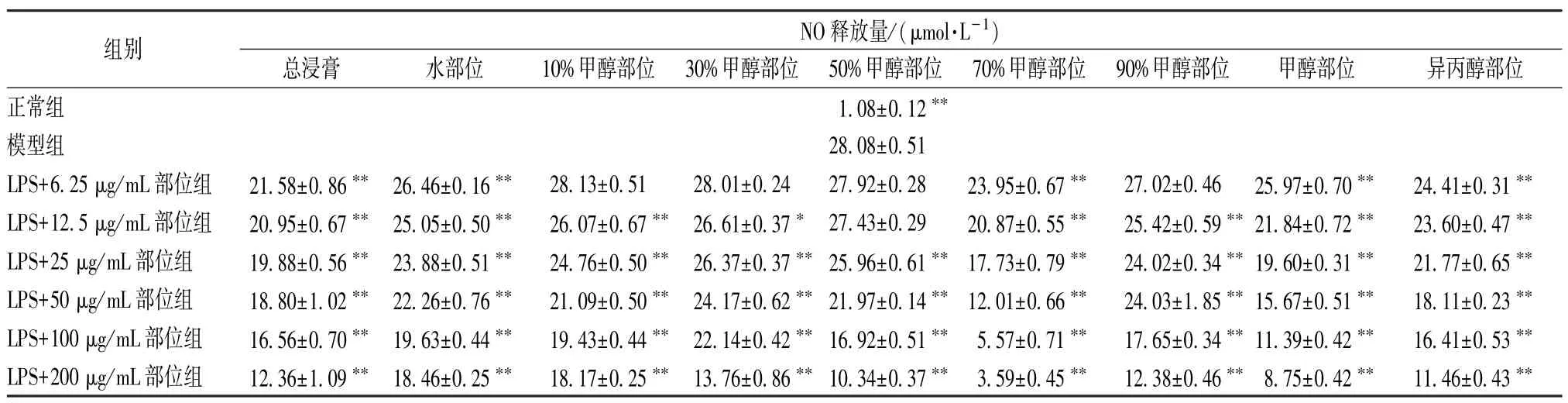
表3 各洗脱部位对NO 释放量的影响(, n=3)
注:与模型组比较,*P<0.05,**P<0.01。
3.4 成分分析与鉴定 图1 显示,70%甲醇洗脱部位中有2 个主要色谱峰经液质联用色谱分析,峰1、2 在总离子图中的保留时间分别为2.80、4.58 min,准分子离子峰[M⁃H]-m/z分别为955.38、793.30。结合对照品比对,鉴定两者分别为竹节参皂苷Ⅴ、竹节参皂苷Ⅳa。

图1 70%甲醇洗脱部位RP⁃HPLC 色谱图
3.5 各成分活性研究 地塞米松为常用激素类抗炎药物,故本实验选择其作为阳性对照,分析竹节参皂苷Ⅴ、竹节参皂苷Ⅳa 的体外细胞毒性和抗炎活性,结果见表4~5。由表4 可知,各成分浓度在3.13~50 μmol/L 时均对细胞无明显毒性,而在100~200 μmol/L 时细胞均有不同程度地死亡,故选择3.13、6.25、12.5、25、50 μmol/L 作为检测浓度。由表5 可知,与模型组比较各成分浓度在3.13~50 μmol/L时均可呈剂量依赖性抑制NO 释放,以地塞米松作用最强;相对竹节参皂苷Ⅴ,竹节参皂苷Ⅳa 活性更强。
表4 各成分细胞存活率(, n=3)
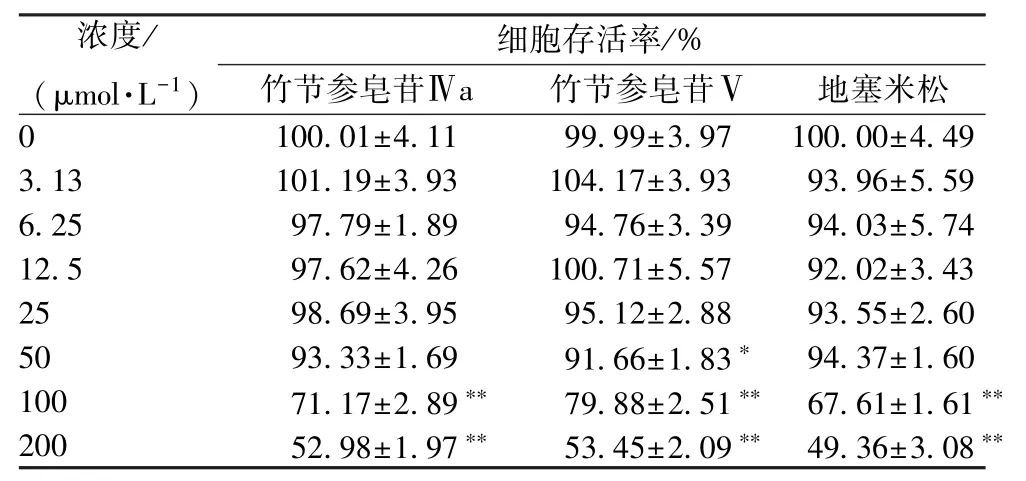
表4 各成分细胞存活率(, n=3)
注:与空白组(0 μg/mL)比较,*P<0.05,**P<0.01。
表5 各成分对NO 释放量的影响(, n=3)

表5 各成分对NO 释放量的影响(, n=3)
注:与模型组比较,**P<0.01。
3.6 方法学考察 竹节参皂苷Ⅳa 与相邻峰可基线分离(分离度大于1.5),在相同保留时间内空白无干扰(图2);该成分回归方程为Y=359 972X-20 210(R2=0.999 6),在0.15~3.0 μg 范围内线性良好(R2=0.999 6);精密度、重复性、稳定性试验中,该成分峰面积RSD 分别为1.15%、1.48%、1.09%,表明仪器精密度、方法稳定性理想,溶液在24 h 内稳定性良好。加样回收率试验结果见表6。
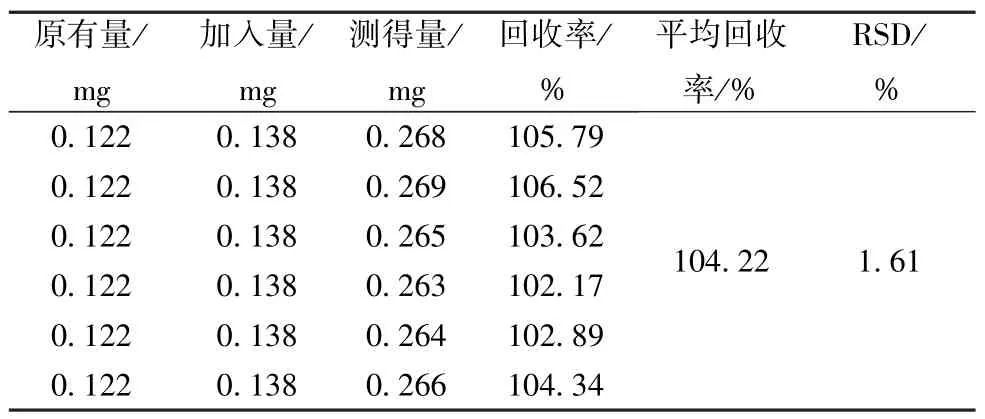
表6 竹节参皂苷Ⅳa 加样回收率试验结果(n=6)

图2 竹节参皂苷Ⅳa RP⁃HPLC 色谱图
3.7 样品含量测定 取3 批口服液,按“2.5.2.2”项下方法制备供试品溶液,在“2.5.1”项色谱条件下进样测定,计算含量,结果见表7,可知均超过了0.2 mg/mL。

表7 竹节参皂苷Ⅳa 含量测定结果
4 讨论
喉咽清口服液临床疗效显著,市场销售良好,前期已证实该制剂对甲型流感病毒性肺炎具有治疗作用[2],而本实验进一步考察该制剂总浸膏和单体成分的抗炎活性。先采用1 μg/mL LPS 建立RAW264.7 炎症细胞模型,发现模型组NO 释放量明显高于正常组,表明造模成功,再经ODS⁃AQ 反相柱分离总浸膏,用不同溶剂进行洗脱,结果显示各洗脱组分均可剂量依赖性地降低NO 释放量,以70%甲醇组分作用最强。
在2015 年版《中国药典》 喉咽清口服液的质量标准中,样品水解后石油醚萃取,薄层层析分离,再通过薄层色谱扫描法测定水解产物中齐墩果酸含量[11],但其准确性、稳定性、精密度都不理想,并且通过水解方式所得到的该成分是多种皂苷的苷元,而不是单一成分,故无法全面控制该制剂质量。本实验采用LC⁃MS 定性鉴定结合RP⁃HPLC 定量分析,发现主要活性成分为竹节参皂苷Ⅴ、竹节参皂苷Ⅳa,以后者含量更高,活性更好。另外,RP⁃HPLC法具有样品处理简便,线性关系、重复性、仪器精密性良好的优点,经该方法测得竹节参皂苷Ⅳa 平均含量大于0.2 mg/mL,表明可通过分析该成分来控制喉咽清口服液的质量。

