HPLC 法同时测定金银花配方颗粒中6 种成分
胡 杨李先芝 钱全全严 玲毛琼丽林 露刘 洋石 豪
(1.劲牌有限公司,湖北 大冶435112; 2.中药保健食品质量与安全湖北省重点实验室,湖北 大冶 435112)
金银花是忍冬科植物忍冬Lonicera japonicaThunb.的干燥花蕾或带初开的花,具有清热解毒、疏散风热 之功效[1],主要含 有黄酮[2⁃3]、有 机酸[4⁃5]、多糖[6⁃7]、挥发油[8]、多酚[9⁃10]等成分,在抗炎[11⁃12]、抗氧化[6,13]、抗病毒[14⁃15]、抗癌[16⁃17]、调节免疫力[18⁃19]等方面具有显著功效,正成为研究热点。金银花配方颗粒是以金银花饮片为原料,采用现代工艺技术对其进行提取、浓缩、干燥、制粒、包装等工序加工制成的新型中药制剂,与传统饮片相比,它具有免煎煮、易于携带、安全卫生等优势[20],但在性状、鉴别上与原药材有较大差异,为了确保其安全有效、质量稳定,对其指标性成分含量进行测定显得尤为重要[21]。目前,对金银花配方颗粒的研究主要集中在指纹图谱或单一成分(如绿原酸、木犀草苷)[22⁃24],但鲜有同时测定6种绿原酸及其异构体含量的报道。因此,本实验采用HPLC 法同时测定金银花配方颗中绿原酸、新绿原酸、隐绿原酸、异绿原酸A、异绿原酸B、异绿原酸C 的含量,以期为该制剂的质量控制提供有效手段。
1 材料
1.1 仪器 UltiMate 3000 高效液相色谱仪(美国赛默飞世尔科技公司);SQP 电子分析天平(德国赛多利斯公司);数控超声波清洗仪(上海科导超声仪器有限公司);PURELAB classic UV 超纯水仪(英国ELGA 公司);数显恒温水浴锅(常州国华电器有限公司)。
1.2 试剂 绿原酸对照品(批号110753⁃201716,纯度99.3%,中国食品药品检定研究院);异绿原酸C 对照品(批号250036⁃202005,纯度99.21%,上海鸿永生物科技有限公司);隐绿原酸(批号DST200522⁃035,纯度98.77%)、新绿原酸(批号DST200521⁃015,纯度99.68%)、异绿原酸A(批号DST190918⁃036,纯度99.55%)、异绿原酸B(批号DST191008⁃037,纯度99.04%)对照品(成都德思特生物技术有限公司)。乙腈为色谱纯(美国费希尔公司);磷酸为色谱纯(国药集团化学试剂有限公司);其他试剂均为分析纯;水为超纯水。
1.3 药物 金银花配方颗粒共3 批,由劲牌持正堂药业有限公司提供。
2 方法与结果
2.1 色谱条件 Waters Atlantis T3 色谱柱(4.6 mm×250 mm,5 μm);流动相乙腈(A)⁃0.1%磷酸(B),梯度洗脱,程序见表1;体积流量1.0 mL/min;柱温30 ℃;检测波长348 nm;进样量10 μL。

表1 梯度洗脱程序Tab.1 Gradient elution programs
2.2 溶液制备
2.2.1 对照品溶液 精密称取绿原酸、新绿原酸、隐绿原酸、异绿原酸A、异绿原酸B、异绿原酸C对照品适量,50%甲醇溶解,制成每1 mL 分别含0.5、0.5、0.3、0.4、0.4、0.3 mg 上述成分的溶液,即得。
2.2.2 供试品溶液 精密称取配方颗粒粉末0.1 g,置于25 mL 量瓶中,20 mL 50%甲醇超声处理30 min,冷却至室温,50%甲醇定容至刻度,摇匀,0.25 μm 微孔滤膜过滤,即得。
2.2.3 阴性样品溶液 精密称取麦芽糊精粉末0.1 g,置于25 mL 量瓶中,加20 mL 50%甲醇超声处理30 min,冷却至室温,50% 甲醇定容至刻度,摇匀,0.25 μm 微孔滤膜过滤,即得。
2.3 方法学考察
2.3.1 系统适应性考察 取对照品、供试品、阴性样品溶液,在“2.1”项色谱条件下进样测定,结果见图1。由此可知,供试品、对照品溶液在相同保留时间上都有色谱峰,阴性无干扰。
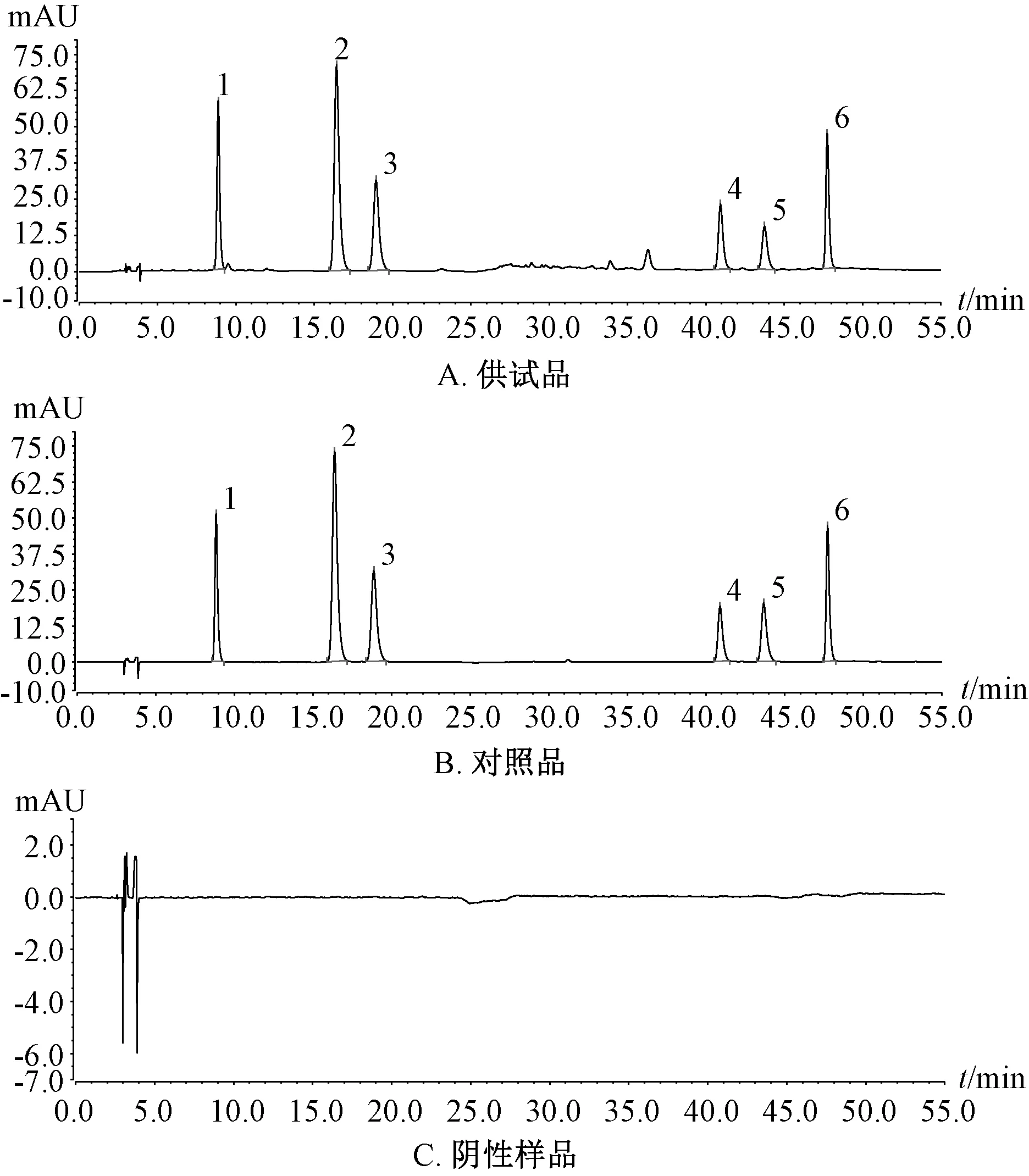
图1 各成分HPLC 色谱图Fig.1 HPLC chromatograms of various constituents
2.3.2 线性关系考察 将“2.2.1”项下对照品溶液稀释成5 个质量浓度,在“2.1”项色谱条件下进样测定。以对照品质量浓度为横坐标(X),峰面积为纵坐标(Y)进行回归,结果见表2,可知各成分在各自范围内线性关系良好。

表2 各成分线性关系Tab.2 Linear relationships of various constituents
2.3.3 精密度试验 取同一批配方颗粒(批号C20442001011),按“2.2.2”项下方法制备供试品溶液,在“2.1”项色谱条件下进样测定6 次,测得新绿原酸、绿原酸、隐绿原酸、异绿原酸B、异绿原酸A、异绿原酸C 峰面积RSD 分别为0.27%、0.28%、0.25%、0.18%、1.16%、0.15%,表明仪器精密度良好。
2.3.4 稳定性试验 取同一批配方颗粒(批号C20442001011),于0、4、8、12、16、20 h 在“2.1”项色谱条件下进样测定,测得新绿原酸、绿原酸、隐绿原酸、异绿原酸B、异绿原酸A、异绿原酸C 峰面积RSD 分别为0.36%、0.27%、0.38%、0.50%、1.06%、0.33%,表明溶液在20 h内稳定性良好。
2.3.5 重复性试验 取同一批配方颗粒6 份(批号C20442001011),按“2.2.2”项下方法制备供试品溶液,在“2.1”项色谱条件下进样测定,测得新绿原酸、绿原酸、隐绿原酸、异绿原酸B、异绿原酸A、异绿原酸C 含量RSD 分别为0.43%、0.38%、0.48%、0.35%、0.77%、0.39%,表 明该方法重复性良好。
2.3.6 加样回收率试验 精密量取各成分含量已知的同一批配方颗粒(批号C20442001011)50 mg,置于25 mL 量瓶中,共9 份,分别按低、中、高水平加入对照品适量,按“2.2.2”项下方法制备供试品溶液,在“2.1”项色谱条件下进样测定,计算回收率。结果,各成分平均加样回收率(RSD)分别为新绿原酸99.27%(2.49%)、绿原酸99.60%(1.88%)、隐绿原酸98.40%(2.77%)、异绿原酸B 101.17%(1.27%)、异绿原酸A 101.38%(1.28%)、异绿原酸C 99.76%(1.26%)。
2.3.7 样品含量测定 取3 批配方颗粒,按“2.2.2”项下方法制备供试品溶液,在“2.1”项色谱条件下进样测定,计算含量,结果见表3。
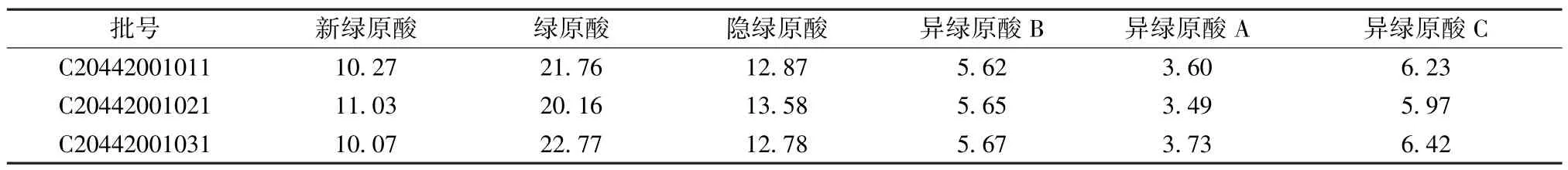
表3 各成分含量测定结果(mg/g, n=3)Tab.3 Results of content determination of various constituents(mg/g, n=3)
3 讨论
3.1 供试品溶液制备方法筛选
3.1.1 提取溶剂 考察了甲醇、水、50% 甲醇,发现以水提取时,各成分含量均很低;以甲醇提取时,绿原酸、隐绿原酸含量较低;以50% 甲醇提取时,各成分提取效果最好。因此,选择50% 甲醇作为提取溶剂。
3.1.2 提取方法 考察了超声、加热回流、冷浸,发现加热回流、超声提取效果均较好,冷浸效果最差。为了操作简便,选择超声作为提取方法。
3.2 色谱条件筛选
3.2.1 色谱柱 考察了Waters、Thermo 等不同厂家的色谱柱,发现Waters 色谱柱分离效果最好,重复性理想。
3.2.2 检测波长 将对照品、样品在190~800 nm范围内进行全波长扫描,发现各成分在348 nm 处均有较大吸收峰,而且干扰较小,基线平稳。因此,选择348 nm 作为检测波长。
4 结论
本实验建立了HPLC 法同时测定金银花配方颗粒中新绿原酸、绿原酸、隐绿原酸、异绿原酸B、异绿原酸A、异绿原酸C 的含量,该方法操作简便,重复性好,准确度高,可为该制剂的质量监控提供参考。

