红毛藻多糖对H2O2诱导的Caco-2细胞氧化损伤的保护作用
何萍萍,郑雅君,郑明静,2,3,4,姜泽东,2,3,4,*,杜希萍,2,3,4,朱艳冰,2,3,4,倪 辉,2,3,4,李清彪,2,3,4,*
(1.集美大学海洋食品与生物工程学院,福建 厦门 361021;2.福建省食品微生物与酶工程重点实验室,福建 厦门 361021;3.厦门南方海洋研究中心,经济海藻资源化利用与深加工重点实验室,福建 厦门 361021;4.厦门市食品生物工程技术研究中心,福建 厦门 361021)
红毛藻(Bangia fusco-purpurea)又称为红毛菜,是我国东南沿海特色的食用海藻资源。红毛藻在福建、广东沿海分布较广,“莆田红毛菜”是国家地理标志的名优海藻。红毛藻富含蛋白质、多糖、氨基酸、游离脂肪酸和维生素,有较高的营养价值,在我国及东南亚地区具有悠久的食用历史[1-3]。多糖是红毛藻中主要的膳食营养活性成分之一。研究报道红毛藻多糖(Bangia fusco-purpureapolysaccharide,BFP)主要由半乳糖(66.55%,质量分数,后同)和硫酸基团(10.34%)以及少量的糖醛酸(7.27%)、甘露糖(6.04%)和葡萄糖(5.92%)等组成,其平均分子质量约133.18 kDa[1]。BFP具有抑制血管紧张素转化酶[4]、免疫诱导[5]、抑菌[5]、抑制α-淀粉酶/α-葡萄糖苷酶[1]等多种有益的生物活性,在食品、生物医药以及化妆品领域具有潜在的开发应用价值。此外,研究证明,BFP对·OH、1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基以及脂质过氧化体有清除作用,具有体外抗氧化活性[6]。本课题组近期研究表明,BFP表现出优良的抵抗人皮肤成纤维细胞光氧化损伤的能力[7]。随着人们对食品安全和饮食健康的日益关注,天然抗氧化剂的研究和开发日益受到重视。目前,关于BFP的抗氧化损伤相关机理还鲜见报道。因此,BFP作为高效安全的天然抗氧化剂具有广阔的研究和开发应用前景。
氧化应激是指体内氧化与抗氧化作用失衡的一种状态,细胞内会大量产生和积累活性氧(reactive oxygen species,ROS)[8]。ROS的过量产生和累积会破坏胞内生物分子,如脂质过氧化、蛋白质氧化和DNA损伤等,从而引起机体产生炎症、癌症、神经变性等病理变化[9-11]。肠上皮在吸收营养方面极为重要,也是机体与外部环境之间的物理屏障[12]。人类炎症性肠病(inflammatory bowel disease,IBD)的发病机理与ROS引起的肠上皮细胞氧化损伤密切相关[11]。溃疡性结肠炎(ulcerative colitis,UC)是IBD的一种主要形式,在许多国家发病率和患病率都很高。UC患者通常会出现呕吐、厌食、紧急腹泻和直肠出血等症状[13]。目前,尽管尚未完全了解UC的发病机制,越来越多的实验和临床研究证据表明氧化应激在结肠炎的发展中起着至关重要的作用[14-15]。在结肠炎发展过程中,弥漫性炎症细胞浸润和小肠黏膜隐窝脓肿会诱导ROS的大量产生,从而引起氧化应激损伤结肠细胞和影响肠上皮屏障的通透性,导致病原体侵袭、炎症细胞浸润和炎症的过度损坏[16]。另外,过量生成的ROS会降低内源性抗氧化酶的活性,包括过氧化氢酶(catalase,CAT)、超氧化物歧化酶(superoxide dismutase,SOD)和谷胱甘肽过氧化物酶(glutathione peroxidase,GSH-Px),并消耗受损细胞中的非酶类抗氧化物谷胱甘肽(glutathione,GSH)[17]。许多研究者提出可以通过抗氧化剂和ROS靶向治疗来预防或减轻结肠炎症[15,18-19]。因此,筛选和研究能够有效调控氧化应激引起结肠细胞损伤的抗氧化剂,是预防和辅助治疗结肠炎、改善患者生活质量的有效策略之一。
综上,可推测BFP可能对肠上皮细胞的氧化应激损伤同样具有保护作用,其或许有助于预防和缓解由氧化应激损伤引起的肠道疾病。人结肠腺癌Caco-2细胞是用于研究肠道屏障损伤发生与修复机制的经典体外细胞模型,当细胞长满时表现出特征性的肠上皮细胞分化现象,并具有与肠上皮细胞相似的代谢酶系和分泌功能[20]。H2O2是体内氧化代谢的中间产物,会引起细胞氧化应激损伤[21]。因此,本研究采用H2O2诱导Caco-2细胞氧化损伤模型,探讨BFP对Caco-2细胞氧化损伤的保护作用以及由氧化应激诱导细胞凋亡的抑制作用,旨在阐明红毛藻的食药用功效机理,为红毛藻作为精准营养食品的开发利用提供理论参考。
1 材料与方法
1.1 材料与试剂
人结肠腺癌细胞(Caco-2) 美国模式培养物集存库;高糖Dulbecco’s modified Eagle’s medium(DMEM)培养基 美国Hyclone公司;胎牛血清 美国Gibco公司;四甲基偶氮唑盐(methylthiazolyldiphenyl-tetrazolium bromide,MTT)、H2O2美国西格玛奥德里奇有限公司;RIPA裂解液 北京索莱宝科技有限公司;SOD、CAT、还原型谷胱甘肽(reduced glutathione,GSH)、丙二醛(malondialdelyde,MDA)检测试剂盒 南京建成科技有限公司;Hoechst 33258荧光染色试剂盒、ROS检测试剂盒、Caspase 3和Caspase 9活力检测试剂盒上海碧云天生物技术有限公司。
1.2 仪器与设备
HERAcell VIOS 160i CO2细胞培养箱 美国赛默飞世尔科技公司;Avanti J26XP高速冷冻离心机 德国贝克曼公司;Cytation™ 5细胞成像多模式检测仪 美国伯腾仪器有限公司;TS100倒置生物显微镜、50i荧光显微镜 日本尼康公司。
1.3 方法
1.3.1 BFP的提取和纯化
BFP的提取和纯化参考文献[1]并稍作修改。红毛藻粗多糖经Sevag法[22]脱除蛋白质后,利用丙烯葡聚糖凝交S-400 HR柱层析(1.6 cm×100 cm)纯化[23],采用0.1 mol/L NaCl进行洗脱,利用自动样品收集器按4 mL/管进行收集,并用苯酚-硫酸法于490 nm波长处测定吸光度以进行跟踪检测,以洗脱体积为横坐标,490 nm波长处吸光度为纵坐标作图,绘制洗脱曲线。收集洗脱峰处多糖溶液,经3 500 Da透析膜透析后得到BFP溶液,冷冻干燥得到BFP。
1.3.2 BFP的Caco-2细胞毒性分析
采用MTT法[24]测定BFP干预后Caco-2细胞活力。细胞于高糖DMEM生长培养基(含体积分数10%胎牛血清、100 IU/mL的青霉素和100 μg/mL的链霉素)中进行常规及传代培养。将处于对数生长期的Caco-2细胞以3×104个/孔的浓度接种于96 孔细胞培养板中,于37 ℃、5% CO2的细胞培养箱中孵育24 h。细胞长满单层后,用不同质量浓度的BFP生长培养基(0、31.25、62.50、125、250、500、1 000 μg/mL)处理细胞。经过24 h孵育,除去上清液,每孔加入50 μL的含质量分数5% MTT的培养基,继续孵育30 min。移去上清液后,每孔用pH 7.4 0.1 mol/L磷酸缓冲液清洗2 次,加入100 μL的二甲基亚砜,振荡20 min,甲瓒完全溶解后,于CytationTM5细胞成像多模式检测仪测定570 nm波长处光密度值(OD570nm),并根据公式(1)计算细胞活力。以细胞活力大于等于90%为标准,确定BFP的安全剂量。
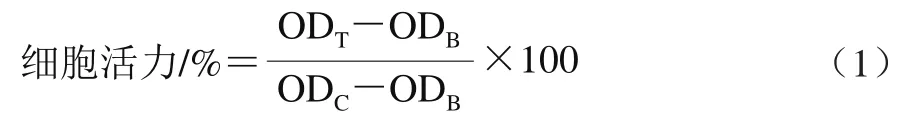
式中:ODT、ODC和ODB分别是实验组、对照组和空白组在570 nm波长处的光密度值。对照组用不含BFP的DMEM生长培养基处理,实验组用含有不同质量浓度BFP的DMEM生长培养基处理,空白组为DMEM生长培养基。
1.3.3 H2O2诱导的Caco-2细胞氧化损伤模型建立
采用An Jun等[25]报道的方法建立H2O2诱导的Caco-2细胞氧化损伤模型。实验分组包括对照组和H2O2氧化损伤模型组。将处于对数生长期的Caco-2细胞以3×104个/孔接种于96 孔板中,于37 ℃、5% CO2的细胞培养箱培养24 h。细胞长满单层后,移除生长培养基。对照组细胞中加入100 µL DMEM生长培养基;H2O2氧化损伤模型组细胞中每孔加入100 µL不同浓度H2O2的DMEM生长培养基(H2O2终浓度分别为100、200、400、800、1 200、1 600、2 000 μmol/L)。处理后的细胞置于37 ℃、5% CO2的细胞培养箱培养4 h,采用1.3.2节方法检测细胞活力。
1.3.4 H2O2诱导氧化损伤Caco-2细胞经BFP干预后细胞活力的测定
参照Liang Rong等[26]报道的方法分析BFP对H2O2诱导的Caco-2细胞氧化损伤的保护作用。实验分组包括空白组、对照组、H2O2诱导氧化损伤组和BFP干预保护组。空白组每孔加入100 µL DMEM生长培养基,其余组别每孔加入100 µL处于对数生长期Caco-2细胞悬液(3×104个/孔),于37 ℃、5% CO2的细胞培养箱培养24 h。细胞长满单层后,移除生长培养基。空白组、对照组和H2O2诱导氧化损伤组每孔加入100 µL DMEM生长培养基,BFP干预保护组加入100 µL含BFP(终质量浓度分别为100、200、500 µg/mL)的DMEM生长培养基,继续孵育24 h。孵育结束后,H2O2诱导氧化损伤组和BFP干预保护组每孔加入含H2O2(终浓度为800 µmol/L)的DMEM生长培养基,空白组和对照组加入等体积的DMEM生长培养基,继续孵育4 h,采用1.3.2节MTT法检测细胞活力。
1.3.5 H2O2诱导氧化损伤Caco-2细胞经BFP干预后细胞形态的观察
采用1.3.2节中的方法将处于对数生长期Caco-2细胞接种到96 孔板,按1.3.3节方法处理细胞后,使用50i荧光显微镜(放大倍数400)对细胞进行形态学观察,并分别拍摄空白组、对照组、H2O2诱导氧化损伤组和BFP干预保护组中的Caco-2细胞的形态,比较各组之间细胞形态的差异[27]。
1.3.6 H2O2诱导氧化损伤Caco-2细胞经BFP干预后细胞内ROS含量的测定
利用二氯荧光乙酰乙酸盐荧光探针测定Caco-2细胞内产生的ROS含量[28]。将Caco-2细胞接种到96 孔黑色聚苯乙烯微孔板,按1.3.3节诱导细胞氧化损伤的方法处理细胞后,按照ROS检测试剂盒说明书操作步骤测定各孔的荧光强度,根据公式(2)计算ROS相对含量。

1.3.7 H2O2诱导氧化损伤Caco-2细胞经BFP干预后细胞中SOD活力、CAT活力、GSH含量和MDA含量的测定
采用1.3.2节方法,将Caco-2细胞接种到6 孔板,按1.3.3节的方法诱导细胞氧化损伤后,收集并裂解细胞,离心取上清液。按照相应的试剂盒说明书操作步骤测定细胞SOD、CAT活力和GSH、MDA含量。
1.3.8 H2O2诱导氧化损伤Caco-2细胞经BFP干预后细胞凋亡及细胞内Caspase-3和Caspase-9活力测定
采用Hoechst 33258染色法检测H2O2诱导的Caco-2细胞凋亡[29]。Caco-2细胞接种到细胞培养皿,待细胞长满单层后,按1.3.3节方法处理各组细胞。按照相应的试剂盒说明书采集图像并测定酶活力。
1.4 数据统计与分析
为了确保实验数据的可信度,进行3 次独立实验,每组实验重复3 次,实验结果表示为平均值±标准偏差。利用SPSS 17.0软件,使用单因素方差中的Duncan检验进行显著性分析,P<0.05、P<0.01分别表示差异显著、极显著。
2 结果与分析
2.1 BFP对Caco-2细胞活力的影响
采用MTT法分析BFP对Caco-2细胞活力的影响,结果如图1所示。在BFP质量浓度为0~1 000 µg/mL范围内,细胞活力均大于90%,与对照组相比差异不显著(P>0.05)。实验结果表明,BFP在测试质量浓度(0~1 000 µg/mL)范围内对Caco-2细胞没有显著毒性作用,所以本研究选取100、200、500 µg/mL作为BFP对H2O2诱导氧化损伤的干预剂量进行后续研究。

图1 BFP对Caco-2细胞活力的影响Fig.1 Effect of BFP at different concentrations on the viability of Caco-2 cells
2.2 BFP对H2O2诱导Caco-2细胞氧化损伤的影响
H2O2诱导Caco-2细胞氧化损伤模型建立的结果如图2所示。在不同浓度的H2O2处理Caco-2细胞4 h后,与对照组相比,100 μmol/L的H2O2对Caco-2细胞活力无显著影响,随着培养基中H2O2浓度的升高,Caco-2细胞活力显著下降,表明在测试条件下,培养基中H2O2浓度在200~2 000 μmol/L范围内可有效诱导Caco-2细胞氧化损伤,并且存在浓度依赖性。当培养基中H2O2浓度为800 μmol/L时,Caco-2细胞活力抑制率接近50%。因此,后续选取培养基中H2O2浓度为800 μmol/L作用细胞4 h为建立Caco-2细胞氧化损伤的诱导条件。
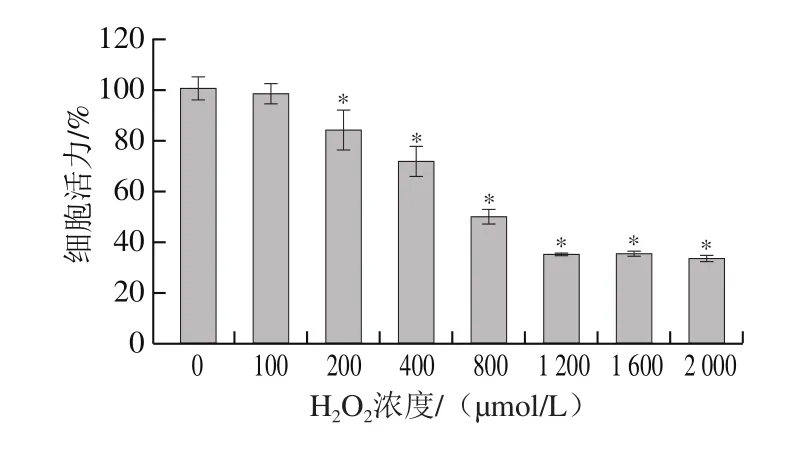
图2 不同浓度的H2O2对Caco-2细胞活力的影响Fig.2 Effect of H2O2 at different concentrations on the viability of Caco-2 cells
BFP对H2O2诱导Caco-2细胞氧化损伤的保护作用结果如图3所示。与对照组相比,H2O2诱导氧化损伤组中Caco-2细胞活力显著降低,为(51.3±4.1)%;经不同质量浓度的BFP(100、200、500 µg/mL)处理的BFP干预保护组中Caco-2细胞活力随着多糖质量浓度增加显著升高,分别达到(77.4±2.2)%、(83.3±2.8)%和(90.9±2.1)%,与H2O2诱导氧化损伤组相比,分别提高了50.9%、62.4%和77.2%。以上结果表明,BFP预处理能有效缓解H2O2诱导的Caco-2细胞氧化应激损伤,并且在测定的质量浓度(0~500 µg/mL)范围内呈剂量效应关系,提示BFP对H2O2诱导Caco-2细胞氧化损伤具有保护作用。

图3 BFP对H2O2诱导Caco-2细胞氧化损伤的保护作用Fig.3 Protective effect of BFP at different concentrations on H2O2-induced oxidative damage in Caco-2 cells
2.3 BFP对H2O2诱导氧化损伤的Caco-2细胞形态的影响
H2O2诱导Caco-2细胞氧化损伤的细胞形态观察结果如图4所示。结果显示,对照组中Caco-2细胞贴壁生长,细胞密度大,细胞间衔接紧密,生长状态良好(图4A);H2O2诱导氧化损伤组中Caco-2细胞数量明显减少,贴壁性变差,出现明显皱缩或膨大,生长状态较差(图4B);与H2O2诱导氧化损伤组中的细胞相比,经BFP预处理后的细胞,其形态随着多糖质量浓度的增加得到显著改善,细胞密度显著增大,细胞间衔接增加,生长状态趋于正常(图4C~E)。以上结果表明,BFP能有效改善H2O2诱导氧化应激损伤的Caco-2细胞形态。

图4 H2O2诱导Caco-2细胞氧化损伤的细胞形态学观察(×400)Fig.4 Morphological observation of H2O2-induced oxidative damage in Caco-2 cells (× 400)
2.4 BFP对H2O2诱导氧化损伤的Caco-2细胞内ROS含量的影响
ROS引起的肠上皮细胞氧化损伤与IBD的发病机理息息相关[11]。2’,7’-二氯荧光素二乙酸酯自身无荧光,可穿过细胞膜进入细胞内进而被胞内的酯酶水解,经细胞内的ROS氧化转化为具有强荧光的2’,7’-二氯荧光素(无法穿过细胞膜)。因此,通过检测二氯荧光素的荧光强度可反映出细胞内ROS的水平[30-31]。Caco-2细胞内ROS含量测定结果如图5所示。H2O2处理能显著诱导Caco-2细胞内ROS水平的升高(P<0.05),而经不同质量浓度BFP(100、200、500 µg/mL)干预后,细胞内ROS生成水平被显著抑制,并随多糖质量浓度升高呈下降趋势。当BFP质量浓度为500 µg/mL时,H2O2诱导氧化损伤的Caco-2细胞内ROS水平达到最低。以上结果表明,BFP能有效降低H2O2诱导的Caco-2细胞内ROS水平。ROS是细胞氧化损伤的一种重要的标志因子,BFP干预能够显著降低H2O2诱导氧化损伤Caco-2细胞内ROS水平,从而缓解氧化损伤,保护细胞[32]。
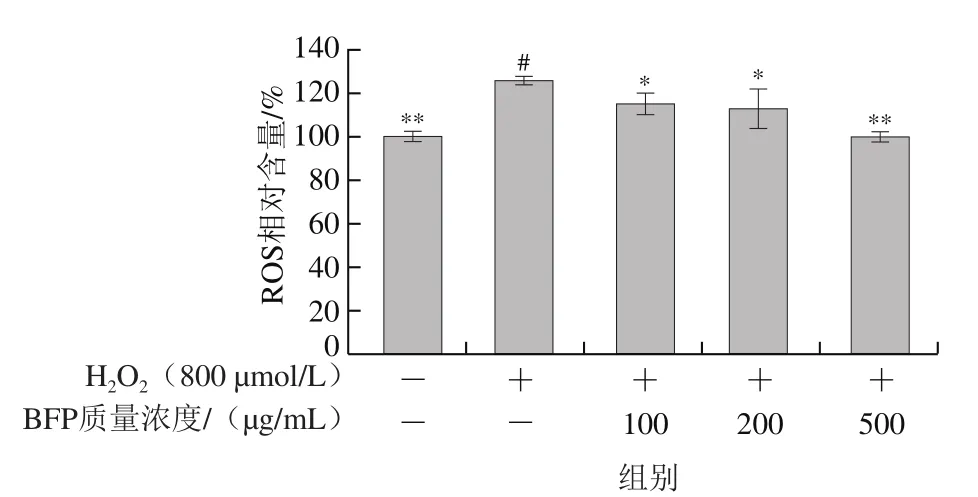
图5 BFP对H2O2诱导氧化损伤的Caco-2细胞内相对ROS水平的影响Fig.5 Effect of BFP at different concentrations on ROS levels in Caco-2 cells induced by H2O2
2.5 BFP对Caco-2细胞内SOD活力、CAT活力、GSH含量和MDA含量的影响
BFP对H2O2诱导氧化损伤的Caco-2细胞内SOD活力、CAT活力、GSH水平和MDA含量的影响如表1所示。与对照组相比,H2O2诱导氧化损伤组中Caco-2细胞内SOD活力、CAT活力和GSH含量显著降低(P<0.05),MDA含量显著升高(P<0.05);与H2O2诱导氧化损伤组相比,BFP干预保护组中Caco-2细胞内的SOD活力、CAT活力和GSH含量总体显著升高(P<0.05,P<0.01),MDA含量极显著降低(P<0.01),并呈现出较好的多糖质量浓度依赖性。研究报道,SOD和CAT是细胞内重要的抗氧化酶,是细胞防御氧化应激的重要组成部分,能有效清除ROS,阴止脂质过氧化,提升机体的抗氧化能力[33-35]。GSH是一种重要的非酶类抗氧化物,具有清除自由基、解毒等多种生理功能。GSH水平是衡量机体抗氧化能力大小的重要因素[36]。MDA是脂质过氧化作用的最终分解产物,其含量是反映脂质过氧化物和ROS水平的重要指标[37]。ROS的过量产生和积累致使细胞膜脂质过氧化,产生脂质过氧化产物MDA,最终引起细胞的氧化损伤或凋亡,所以MDA的含量也可间接反映出细胞氧化应激损伤的程度[32,37]。以上实验结果表明,BFP能显著提高H2O2诱导氧化损伤Caco-2细胞内SOD和CAT活力以及GSH水平,有效清除氧化损伤细胞内的ROS,阴止脂质的过氧化,显著降低MDA含量,从而保护Caco-2细胞免受H2O2诱导的氧化损伤。这和上述BFP能通过显著降低H2O2诱导氧化损伤细胞内ROS水平来缓解细胞氧化损伤的结果相一致。

表1 BFP对H2O2诱导氧化损伤Caco-2细胞内SOD活力、CAT活力、GSH含量和MDA含量的影响(n=6)Table 1 Effect of BFP at different concentrations on SOD activity, CAT activity, GSH level and MDA content in Caco-2 cells induced by H2O2 (n = 6)
2.6 BFP对H2O2诱导Caco-2细胞凋亡的影响
细胞内ROS含量的增加和/或抗氧化剂含量的减少、氧化还原稳态破坏以及脂质、蛋白质、DNA等生物大分子的不可逆氧化修饰等氧化应激均会导致细胞凋亡信号产生[38]。凋亡又称程序性细胞死亡,是机体正常细胞更新、免疫系统的正常发育、激素依赖性细胞萎缩、胚胎发育和化学诱导的细胞死亡等过程的重要组成部分,但不适当的细胞凋亡(太少或太多)是诱发多种疾病(如神经退行性疾病、缺血性损伤、自身免疫性疾病和多种类型的癌症等)的重要因素之一[39]。BFP对H2O2诱导Caco-2细胞凋亡调控作用的结果如图6所示。对照组中,正常生长的Caco-2细胞的细胞核呈现出弥散均匀的低强度蓝色荧光,表明Caco-2细胞没有发生显著的凋亡现象(图6A);H2O2诱导氧化损伤组中,Caco-2细胞的细胞核呈现固缩致密高度染色的高强度蓝色荧光,表明Caco-2细胞发生显著的凋亡现象(图6B);H2O2诱导氧化损伤的Caco-2细胞经不同质量浓度的BFP干预保护后,细胞核染色的荧光强度呈现出显著的多糖质量浓度依赖性变化,荧光强度随着多糖质量浓度升高逐渐降低(图6C~E),高质量浓度多糖干预的氧化损伤细胞核的荧光强度明显减弱,细胞核呈现出弥散均匀的低强度蓝色荧光状态(图6E)。以上实验结果表明,BFP能够有效抑制H2O2诱导Caco-2细胞的细胞凋亡,缓解细胞的氧化损伤。

图6 BFP对H2O2诱导氧化损伤的Caco-2细胞凋亡的影响Fig.6 Effect of BFP at different concentrations on apoptosis in Caco-2 cells induced by H2O2
2.7 BFP对H2O2诱导Caco-2细胞内Caspase-3和Caspase-9活力的影响
Caspases是富含半胱氨酸的天冬氨酸特异性蛋白酶,Caspase家族信号通路在细胞凋亡的发生过程中起着至关重要的作用[40-41]。Caspase-3是细胞凋亡过程中的关键蛋白酶,其活化与细胞DNA断裂和细胞凋亡的形成联系极为密切[42]。Caspase-9是线粒体凋亡途径的上游分子,Caspase-9的激活与ROS有密切关系[43]。因此,本实验分析了BFP对H2O2诱导Caco-2细胞内Caspase-3和Caspase-9活力的影响。如图7所示,与对照组相比,H2O2诱导氧化损伤组中的Caco-2细胞内Caspase-3和Caspase-9活力显著升高;经不同质量浓度的BFP干预保护后,H2O2诱导氧化损伤的Caco-2细胞内Caspase-3和Caspase-9活力随多糖质量浓度增加显著下降,表明BFP能够有效抑制H2O2氧化损伤引起的细胞凋亡,进而保护Caco-2细胞。这和上述BFP能够有效缓解H2O2诱导Caco-2细胞凋亡的结果相符合。
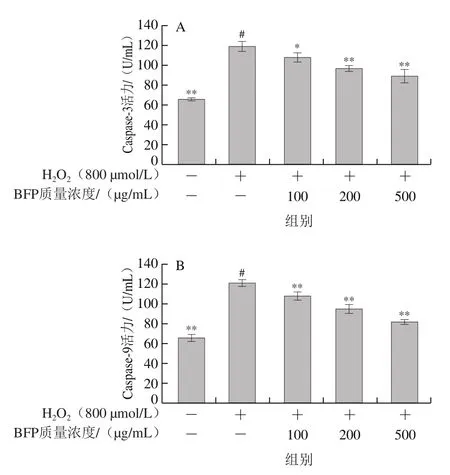
图7 BFP对H2O2诱导氧化损伤的Caco-2细胞Caspase-3(A)、Caspase-9(B)活力的影响Fig.7 Effect of BFP at different concentrations on the activities of caspase-3 (A) and caspase-9 (B) in Caco-2 cells induced by H2O2
3 讨 论
氧化应激是常见的应激损伤,内源性和/或外源性不良刺激会打破氧化系统和抗氧化系统相对平衡的状态,使机体处于氧化应激状态[44]。氧化应激主要表现为细胞内产生过量的ROS,导致细胞损伤和凋亡等[9]。胃肠道是体内ROS与膳食抗氧化剂相互作用的重要部位,ROS的过量产生会引起肠上皮细胞的损伤[45-46]。因此,人体的抗氧化系统需要外源抗氧化剂来有效地避免氧化应激的发生。近年来,多糖作为天然抗氧化剂的研究与开发利用已经引起了广泛的关注。王群[47]建立了Caco-2细胞模拟肠道屏障模型,证明了螺旋藻多糖能预防H2O2诱导的Caco-2细胞的氧化损伤;王明星等[48]发现猴头菌多糖能显著降低H2O2诱导的Caco-2细胞凋亡,降低细胞中MDA的含量,提高SOD活力及乳酸脱氢酶含量,提示猴头菌多糖的抗UC活性与其减少细胞的氧化应激相关;何传波等[49]发现仙草多糖可增加细胞内抗氧化酶活性,减少脂质过氧化物生成,有明显的氧化损伤保护作用。这些研究表明,天然膳食多糖可作为潜在的机体外源抗氧化剂有效抵抗氧化应激引起的细胞损伤。
本实验利用H2O2建立Caco-2氧化损伤模型,分析了BFP对Caco-2细胞氧化损伤的保护作用。实验结果表明,BFP在实验质量浓度(0~1 000 µg/mL)范围内对Caco-2细胞的细胞活力无显著影响。经800 μmol/L H2O2处理Caco-2细胞模型4 h之后,Caco-2细胞内ROS水平与对照组(未经H2O2处理)相比显著升高,引起细胞氧化应激损伤[21]。与此同时,氧化损伤组中Caco-2细胞的抗氧化酶(SOD和CAT)活力和非酶类抗氧化物GSH水平与对照组相比显著下降,MDA含量则显著升高,表明在H2O2诱导下,Caco-2细胞内产生大量超氧化物自由基,过量的自由基可能会抑制抗氧化酶活性,导致氧化损伤细胞内的SOD、CAT和GSH水平与对照组相比显著下降,自由基的清除能力减弱,进一步加重细胞氧化损伤程度[35]。另一方面,过量的自由基使细胞内的多不饱和脂肪酸发生脂质过氧化反应,产生MDA等代谢产物,进而导致细胞膜的通透性增加[37]。此外,细胞内Caspase-3和Caspase-9活力显著升高,加速了细胞凋亡。然而,在加入BFP进行保护后,BFP能够显著抑制H2O2诱导氧化应激损伤Caco-2细胞模型内ROS的生成,有效清除ROS,显著提高SOD、CAT活力和GSH的水平,并显著降低细胞内MDA的产生量,阴止脂质的过氧化。同时,BFP能够显著下调H2O2诱导氧化应激损伤的Caco-2细胞模型内Caspase-3和Caspase-9活力,缓解氧化应激损伤引起的细胞凋亡,使细胞维持正常形态,保护Caco-2细胞免受氧化损伤。
综上所述,BFP可有效缓解H2O2诱导的Caco-2细胞氧化应激损伤,具有潜在预防由氧化应激引起的肠道炎症的应用价值。本研究结果可丰富红毛藻的食品营养学理论基础,为其开发预防肠道炎症的精准营养食品提供科学依据。

