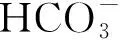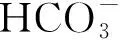碳酸酐酶对猪链球菌生长及抗氧化应激的影响
陈琳,王硕玥,姚火春,吴宗福
(南京农业大学动物医学院,江苏 南京 210095)
猪链球菌(Streptococcussuis)是猪的重要细菌性病原,可引致猪的败血症、脑膜炎、心内膜炎、关节炎等症状,在全球范围内对养猪业造成重大的经济损失;猪链球菌还是重要的人畜共患病病原,可导致生猪从业人员感染或致病。猪链球菌血清型众多,根据不同荚膜多糖的抗原性,可分为29种传统血清型(1~19、21、23~25、27~31、1/2)、Chz血清型、26种新荚膜基因簇菌株(NCL1~26)及部分未定型菌株,其中血清2型对人和猪的致病性最强[1-5]。
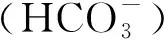
本课题组前期通过比较蛋白组学方法发现,猪链球菌碳酸酐酶(S.suiscarbonic anhydrase,SCA)在H2O2处理组显著上调表达,提示其参与猪链球菌抗氧化应激[16]。通过NCBI序列比对,发现sca在至今已公布的67株猪链球菌全基因组中均有分布,但其在猪链球菌中的生物学功能及在致病中的作用未见报道。本试验构建sca无痕缺失株,比较野生株与缺失株在不同条件下的生长能力,以及通过H2O2应激、小鼠巨噬细胞RAW264.7吞噬与存活、猪全血存活等试验阐明其在猪链球菌抗氧化应激中的作用,为深入了解猪链球菌致病机制及防控该类疫病提供参考。
1 材料与方法
1.1 主要试剂
THB培养基购自美国BD公司;绵羊血购自北京鼎国生物科技有限公司;DMEM(Dulbecco’s modified eagle medium)培养基购自美国Thermo Fisher Scientific公司;胎牛血清购自美国Gibco公司;2×Rapid Taq Master Mix、DNA片段回收试剂盒购自南京诺唯赞生物科技有限公司。
1.2 菌株、细胞和培养条件
猪链球菌2型野生株SC070731由南京农业大学世界动物卫生组织(OIE)猪链球菌病参考实验室保存,分离自患脑膜炎病猪[17]。猪链球菌在THB液体培养基或THB固体培养基中于37 ℃培养箱或摇床(180 r·min-1)条件下培养,需要时添加终质量浓度100 μg·mL-1壮观霉素(spc)。小鼠巨噬细胞RAW264.7(ATCCTIB-71)购自美国ATCC公司,在含10%胎牛血清的DMEM培养基中,于37 ℃、5% CO2培养箱培养。
1.3 缺失株Δsca的构建
缺失株的构建参照文献[18],引物见表1,由南京擎科生物有限公司合成。采用两步筛选法,第1步以壮观霉素耐受(spc)为正向筛选,第2步以蔗糖敏感(sacB)作为反向筛选,经染色体基因组自身同源重组完成无痕替换。
1.3.1 spc耐受正向筛选以SC070731基因组为模板,以Δsca-A/B为引物对扩增上游同源臂AB;以sacB-F/R为引物对扩增sacB-spc片段(sacB-spc重组基因盒由南京农业大学OIE猪链球菌病参考实验室保存,可直接用于PCR模板);以SC070731基因组为模板,以Δsca-C/D为引物对扩增下游同源臂CD;混合AB、sacB-spc、CD片段为模板,以Δsca-A/D为引物对进行融合PCR。PCR反应程序:95 ℃ 3 min;95 ℃ 30 s,54 ℃ 30 s,72 ℃ 5 min,30个循环;72 ℃ 10 min。用10 g·L-1琼脂糖凝胶电泳分离PCR 3段融合产物,使用DNA胶回收试剂盒切胶回收。挑取SC070731单菌落,于37 ℃、180 r·min-1摇床培养至对数期,按 1∶40 (体积比)转接至4 mL THB液体培养基,培养至A600≈ 0.04~0.05(约20~60 min);取100 μL菌液,添加5 μL信号肽(GNWGTWVEE)和10 μL上述 PCR 3段融合产物,37 ℃、5% CO2培养箱静置培养2 h,涂布TS平板(含100 μg·mL-1spc的THB固体培养基);次日挑取单菌落,以Δsca-G1/G2和Δsca-E1/E2为引物对进行有痕缺失株的PCR鉴定。

表1 本试验所用引物序列Table 1 Primers sequences in this study
1.3.2sacB反向筛选以SC070731基因组为模板,用Δsca-A/B1为引物对扩增上游同源臂AB1;用SC070731基因组为模板,以Δsca-C1/D为引物对扩增下游同源臂C1D;以混合的AB1、C1D片段为模板,用Δsca-A/D为引物对进行融合PCR。PCR反应程序:95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 2 min,30个循环;72 ℃ 10 min。用10 g·L-1琼脂糖凝胶电泳分离PCR 2段融合产物,使用DNA胶回收试剂盒切胶回收。挑取SC070731有痕缺失株Δsca单菌落于37 ℃、180 r·min-1摇床培养至对数期,按1∶40转接至4 mL THB液体培养基,培养至A600≈ 0.04~0.05(约20~60 min);取100 μL菌液,添加5 μL信号肽和 10 μL 上述PCR 2段融合产物,于37 ℃、5% CO2培养箱静置培养2 h,涂布于THB平板(含100 g·L-1蔗糖的THB固体培养基),含SacB片段的菌无法在含蔗糖的平板上生长;次日挑取单菌落以Δsca(inter)-F/R为引物对进行无痕缺失株的PCR鉴定,且用Δsca-A/D为引物对扩增产物并送至苏州金唯智生物科技有限公司测序。
1.4 野生株和Δsca株在不同条件下生长曲线的测定
1.4.1 在CO2缺乏和CO2丰富条件下的生长曲线挑取SC070731和Δsca株单菌落,37 ℃、180 r·min-1摇床培养至对数生长期(A600≈0.6),按1∶100(体积比)转接至10 mL THB液体培养基后,分别置于普通培养箱(CO2缺乏)和5% CO2培养箱(CO2丰富),于37 ℃条件下静置培养;每隔1 h测1次A600值。分别绘制各菌株的生长曲线,每个菌株3个生物学重复。
1.4.2 不同浓度NaHCO3条件下Δsca株的生长曲线挑取SC070731和Δsca株单菌落,37 ℃、180 r·min-1摇床培养至对数生长期,按1∶100转接至10 mL THB液体培养基后,添加不同浓度的 NaHCO3于THB液体培养基,使NaHCO3终浓度分别为10、30和40 mmol·L-1,37 ℃条件下于普通培养箱(CO2缺乏)静置培养,每隔3 h测1次A600值。分别绘制各菌株的生长曲线,每个菌株3个生物学重复。
1.4.3 添加不同代谢中间产物后Δsca株的生长曲线挑取SC070731和Δsca株单菌落,37 ℃、180 r·min-1摇床培养至对数生长期,按1∶100转接至10 mL THB液体培养基后,分别向培养基添加体积分数均为0.1%的Tween-80、Tween-20、Tween-40和0.01 mmol·L-1十六烷酸、0.01 mmol·L-1油酸,37 ℃普通培养箱(CO2缺乏)静置培养,每隔3 h测1次A600。分别绘制各菌株的生长曲线,每个菌株3个生物学重复。
1.5 野生株和Δsca株抗氧化应激能力的测定
挑取SC070731和Δsca株单菌落,37 ℃、180 r·min-1摇床培养至对数期,按1∶100转接至5 mL THB液体培养基(1∶50加血清)培养至A600≈ 0.6。各取500 μL菌液,用THB液体培养基稀释10倍至 5 mL,加入20 μL 30%(体积分数)H2O2(终浓度40 mmol·L-1),37 ℃条件下置5% CO2培养箱20 min后,取 100 μL 用PBS(pH7.2)进行10倍比稀释;选择3个合适浓度,涂布THB平板并进行计数。阴性对照不添加H2O2,处理步骤同上。相对存活率=活菌数20 min/活菌数0 min。每个菌株3个生物学重复。
1.6 野生株和Δsca株抗吞噬与存活能力的测定
挑取SC070731和Δsca株单菌落,37 ℃、180 r·min-1摇床培养至A600≈0.6,按1∶100转接5 mL THB液体培养基,培养至A600≈0.6。各取5 mL菌液,4 ℃、8 000 r· min-1离心5 min后,用PBS(pH7.2)洗涤2次,DMEM重悬至A600≈0.6。取(5.0~7.0)×105mL-1RAW264.7细胞铺入24孔板(每孔中有500 μL含10%血清的DMEM培养液),生长12~18 h。吸弃培养液,DMEM洗涤3次后,用台盼蓝法计算每孔所含的细胞数,并以感染比(细菌∶细胞)≈ 20∶1将菌液分别添加到24孔板中。37 ℃、800 r·min-1离心10 min后,37 ℃条件下置5% CO2培养箱孵育1 h。用不含血清的DMEM将RAW267.4细胞洗涤3次后,在含100 μg·mL-1庆大霉素和5 μg· mL-1青霉素的DMEM培养基中分别培养1和3 h,洗涤3次后,加1 mL ddH2O形成低渗条件,使细胞胀裂后,对每孔进行细菌计数。吞噬率为抗生素处理1 h后巨噬细胞内的细菌数占原始接菌数的比值。将抗生素处理1 h后的巨噬细胞内细菌数作为100%,计算3 h细菌在巨噬细胞内的存活率。胞内存活率=活菌数3 h/活菌数1 h。每个试验重复3次。
1.7 野生株和Δsca株在猪全血中存活能力的测定
采集经ELISA检测猪链球菌抗体为阴性的健康猪血液备用。挑取SC070731和Δsca株单菌落,37 ℃、180 r·min-1摇床培养至A600≈0.6,按1∶100转接至5 mL THB液体培养基,再培养至A600≈0.6。各取1 mL菌液,4 ℃、8 000 r·min-1离心5 min,用PBS(pH7.2)洗涤2次;用适量PBS(pH7.2)重悬细菌,使细菌量达到 5.0×106CFU·mL-1;取一部分菌液进行倍比稀释,以确认加入血液中的细菌数;另取0.1 mL细菌悬液与0.9 mL新鲜猪血液混匀于2 mL EP管,37 ℃条件下置5% CO2培养箱静置培养,每隔15 min上下颠倒轻缓混匀1次,1 h后取0.1 mL全血培养物进行倍比稀释,涂THB平板计数,以确认细菌在猪血液中的存活率;将细菌悬液与THB液体培养基在上述同等条件下孵育作为阴性对照。试验重复3次。
1.8 统计分析
2 结果与分析
2.1 缺失株Δsca的构建和鉴定
采用两步筛选法构建缺失株Δsca。用引物对Δsca(inter)-F/R扩增sca基因内部片段,野生株SC070731能扩增出495 bp片段,Δsca株不能扩增出该片段(图1-A)。用引物对Δsca-A/D区分野生株和Δsca株,野生株SC070731能扩增出2 414 bp片段,Δsca株能扩增出1 919 bp片段(图1-B)。上述结果表明,Δsca株构建成功。
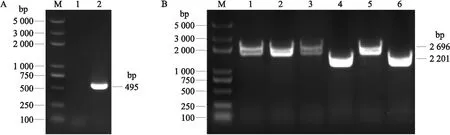
图1 不同引物对缺失株Δsca的PCR鉴定Fig.1 PCR identification of Δsca strain by different primer pairs A. 引物对Δsca(inter)-F/R扩增sca基因内部片段(M. Marker;1. Δsca株;2. 野生株SC070731)。B. 引物对Δsca-A/D区分野生株和缺失株(M. Marker;4、6. Δsca株;1、2、3、5. SC070731)。A. The primer pairs Δsca(inter)-F/R amplified the internal fragment of sca(M. Marker;1. Δsca strain;2. The wild-type strain SC070731). B. The primer pairs Δsca-A/D identified the wild-type strain and the deletion mutant strain(M. Marker;4,6. Δsca strain;1,2,3,5. SC070731).
2.2 SCA对猪链球菌生长的影响
如图2-A所示:Δsca株在CO2缺乏下的生长受到显著抑制,生长12 h后A600值低于0.5。如图2-B所示:在5% CO2下,虽然Δsca株的迟缓期(接种后0~4 h)较野生株长,但平台期(接种后10 h)的生长水平基本恢复到与野生株相同的水平,生长12 h后A600值均接近1.6。
从图2-C可知:随着培养基中NaHCO3浓度的提高,Δsca株在CO2缺乏条件下的生长逐渐增强,与NaHCO3浓度呈正相关。由图2-D可知:在CO2缺乏下,分别添加0.01 mmol·L-1不饱和脂肪酸(UFA)油酸或0.1% Tween-80、0.1% Tween-20等UFA衍生物后显著促进Δsca株生长;而分别添加0.1% Tween-40、0.01 mmol·L-1十六烷酸等饱和脂肪酸衍生物对Δsca株的生长没有影响。

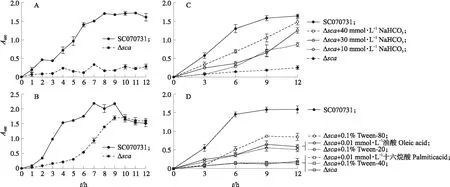
图2 SC070731和Δsca株在不同条件下的生长曲线Fig.2 The growth curve of SC070731 and Δsca strain under different conditions A. CO2缺乏,SC070731和Δsca株的生长曲线;B. 5% CO2下SC070731和Δsca株的生长曲线;C. CO2缺乏,添加不同浓度NaHCO3后Δsca株的生长曲线;D. CO2缺乏,添加不饱和脂肪酸及其衍生物后Δsca株的生长曲线。A. The growth curves of SC070731 and Δsca strain in the absence of CO2;B. The growth curves of SC070731 and Δsca strain under 5% CO2;C. In the absence of CO2,the growth curves of Δsca strain after adding different concentrations of NaHCO3;D. In the absence of CO2,the growth curves of Δsca strain after adding unsaturated fatty acid(UFA)or UFA derivatives.
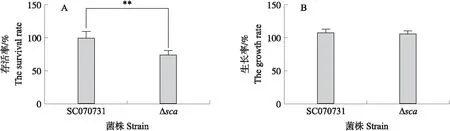
图3 SCA对SC070731抗氧化应激能力的影响Fig.3 The effects of SCA on the oxidative stress response of SC070731 A. 40 mmol·L-1 H2O2作用20 min,SC070731和Δsca株在THB液体培养基中的存活率;B. SC070731和Δsca株在不添加H2O2的THB液体培养基中孵育20 min的生长率(阴性对照)。 **P<0.01。下同。A. After 40 mmol·L-1H2O2 treatment for 20 min,the survival rates of SC070731 and Δsca strain in THB liquid medium;B. The growth rates of SC070731 and Δsca strain in THB liquid medium without H2O2 for 20 min(negative control). **P<0.01. The same bellow.
2.3 SCA对猪链球菌抗氧化应激能力的影响
在40 mmol·L-1H2O2的THB液体培养基中,37 ℃、5% CO2培养箱作用20 min后,野生株SC070731存活率为99.48%,而Δsca株存活率极显著降低,为74.04%(P<0.01)(图3-A)。阴性对照显示,野生株SC070731和Δsca株在不添加H2O2的THB液体培养基孵育20 min后,生长无显著性差异(图3-B)。证明SCA参与猪链球菌的抗氧化应激。
2.4 SCA对猪链球菌抗巨噬细胞吞噬与存活能力的影响
产生活性氧是巨噬细胞杀菌的主要方式之一。采用小鼠巨噬细胞RAW264.7,探究SCA对猪链球菌抗巨噬细胞吞噬能力以及对在巨噬细胞内存活能力的影响。如图4-A所示:RAW264.7细胞对野生株SC070731和Δsca株的吞噬率无显著差异(P>0.05)。存活试验(图4-B)显示:经抗生素处理3 h后,野生株SC070731的存活率为77.98%,而Δsca株的存活率显著下降,仅为38.93%(P<0.01)。证明SCA不是猪链球菌的抗吞噬因子,其主要通过抗氧化应激的方式促进猪链球菌在巨噬细胞中存活。
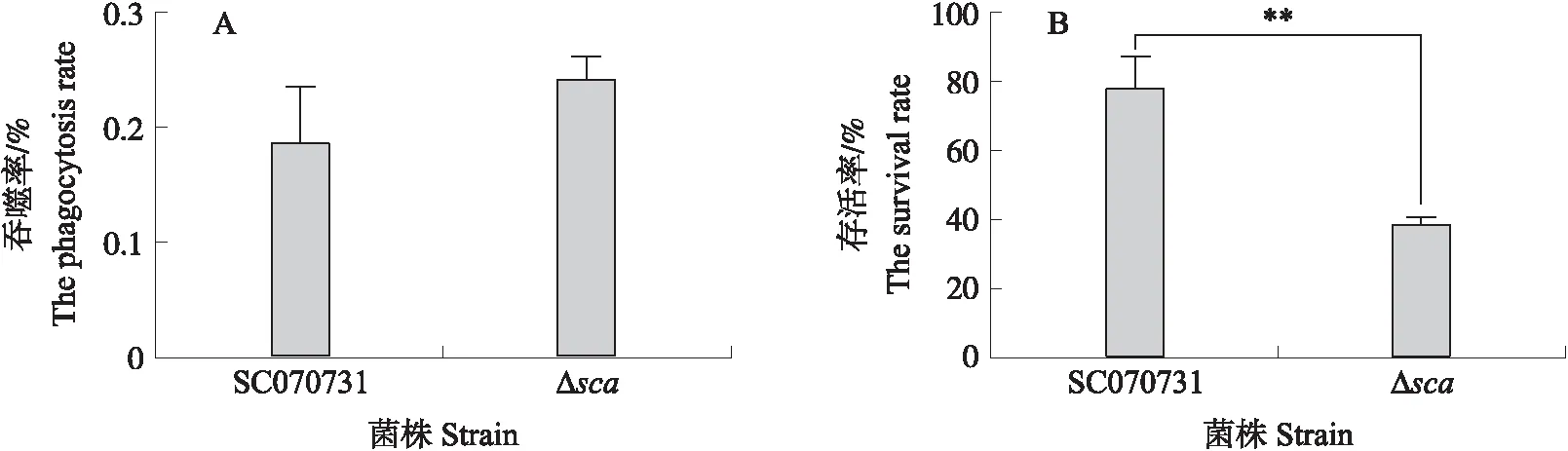
图4 SC070731和Δsca株的RAW264.7吞噬(A)与存活(B)试验Fig.4 RAW264.7 phagocytosis(A)and survival(B)assay of SC070731 and Δsca strain
2.5 SCA对猪链球菌在猪全血中存活能力的影响
为引起宿主致病,猪链球菌首先必须要能在宿主血液中存活[19],且产生活性氧是血液中的免疫活性细胞杀菌的主要方式之一。如图5-A所示:在猪血液中孵育1 h,野生株的存活率为110.02%,表明其不仅可抵抗血液中免疫活性细胞清除,还可生长;而Δsca株的存活能力极显著下降,仅为51.39%(P<0.01)。阴性对照(图5-B)显示,野生株SC070731和Δsca株在THB液体培养基中孵育1 h,生长无显著性差异。证明SCA与猪链球菌在猪血液中存活相关。
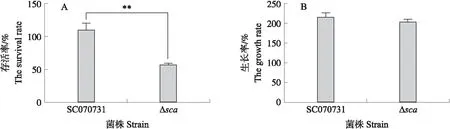
图5 SCA对SC070731在猪全血中存活能力的影响Fig.5 The effects of SCA on survival ability of SC070731 in pig blood A. 在健康猪血液中孵育1 h的存活率;B. 在THB液体培养基中孵育1 h的生长率(阴性对照)。A. The survival rates of SC070731 and Δsca strain in pig blood after incubated for 1 h;B. The growth rates of SC070731and Δsca strain in THB liquid medium after incubated for 1 h(negative control).
3 讨论