房室结消融联合希氏束远端起搏治疗心房颤动介导的心肌病1 例
杨明晖 张荣峰
大连医科大学附属第一医院心血管内科,辽宁大连 116011
心房颤动介导的心肌病(atrial fibrillation-mediated cardiomyopathy,AMC)是由Qin 等[1]提出的一种心力衰竭类型,主要指心房颤动是导致心力衰竭或使原有心力衰竭恶化的唯一病因,且心房颤动恢复窦律或控制室率后心功能迅速恢复。AMC 可以发生不可逆的心房和心室的重构,因此及时诊断和干预对优化临床结果至关重要。与药物治疗相比,心房颤动消融可能改善AMC 患者的远期预后。在心房颤动消融成功后,有较多患者左心室功能恢复。尽管目前对于AMC 的研究取得了一些进展,但本研究对AMC 的流行病学、机制、诊断、管理策略和预后等方面仍然存在较多不足。对于无法耐受药物及射频消融治疗的AMC 患者目前亦缺乏临床治疗经验。2019 年4 月大连医科大学附属第一医院(以下简称“我院”)收治1 例老年男性患者,因AMC 间断应用胺碘酮,转为窦性心律后心力衰竭可得到控制,但之后因胺碘酮副作用致肺间质纤维化,故停用胺碘酮,且患者心房纤维化重,行导管消融成功率低,风险大。房室结消融可实现心房颤动合并心力衰竭患者的室率控制,希氏束起搏是通过传导束起搏,是真正意义上生理性起搏,多项研究显示[2-5]希氏束起搏可维持和恢复心脏电和机械同步性,尤其希氏束远端起搏能够获得理想的起搏参数。故我院对患者进行了房室结消融联合希氏束远端起搏治疗后,术后随访心力衰竭明显改善。本文就该项治疗技术在无法行导管消融治疗的AMC 中的应用体会进行报道分析及文献复习。
1 病例资料
患者男性,73 岁,因“反复胸闷、气短10 年,加重半月”于2019 年4 月就诊于我院。既往否认高血压、糖尿病、冠心病、心脏瓣膜病等基础疾病;戒酒7 年;否认吸烟史。2009 年出现活动后胸闷气短,伴夜间阵发性呼吸困难,于我院查心电图提示心房颤动。心脏超声:左室内径(left ventricular diameter,LV)54 mm,左房内径(left atrial diameter,LA)45 mm,右室内径(right ventricular diameter,RV)28 mm,二尖瓣轻中度反流,射血分数(left ventricular ejection fractions,LVEF)28%。予以华法林抗凝,β 受体阻滞剂控制心室率,症状改善后出院。2013 年前因呼吸困难加重再次入院,心电图提示仍为心房颤动,予胺碘酮转为窦性心律后心衰症状明显改善。复查心脏超声:LV 52 mm,LA 4 mm,RV 2 mm,二尖瓣轻度反流,LVEF 45%。此后患者间断服用胺碘酮维持窦性心律,但心房颤动仍间断发作。2015 年行肺CT 提示肺间质纤维化,并遵医嘱停用胺碘酮治疗。2019 年4 月活动后出现呼吸困难伴双下肢水肿入住我院心律失常诊疗中心。入院查体:T 36℃,P 100 次/min,R 20 次/min,BP 110/70 mmHg(1 mmHg=0.133 kPa)。半卧位,无颈静脉怒张,双肺底可闻及湿啰音。心界向左扩大,心率120 次/min,律绝对不齐,第一心音强弱不等,各瓣膜听诊区未闻及杂音,双下肢无水肿。动态心电图:全程心房颤动,总心搏数103 627 次,最快心率155 次/min,最慢心率47 次/min。心脏超声:LV 53 mm,LA 46 mm,RV 28 mm,二尖瓣轻中度反流,LVEF 29%。肺CT:双肺间质纤维化、肺气肿、肺大泡(图1)。
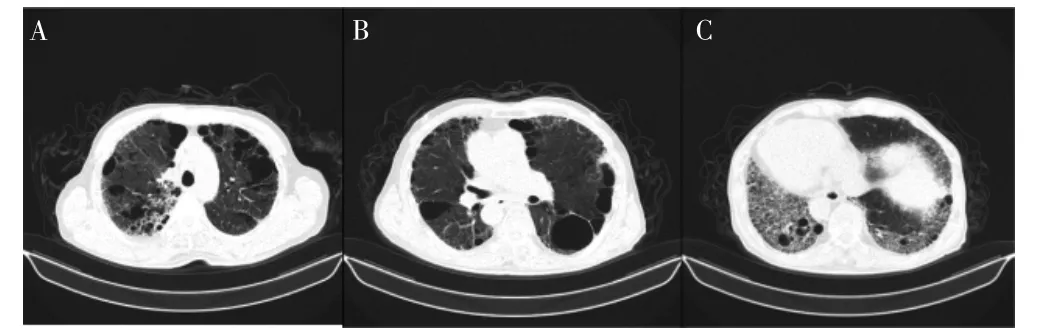
图1 患者入院时肺CT
心脏超声:LA 46 mm,LV 53 mm,RV 28 mm,LVEF 29%。该病例节律控制能够改善患者心脏功能,但患者心房颤动病史较长、左房重构明显、肺间质纤维化程度重,且后续无法应用维持窦律药物,导管消融成功率较低,故具备房室结消融联合生理性起搏的适应症[6-7]。治疗过程:入院后予达比加群110 mg bid,抗凝;比索洛尔5 mg qd,控制心室率;培哚普利2 mg qd改善心肌重构;呋塞米40 mg bid 及螺内酯20 mg qd,利尿;硝酸异山梨酯泵入扩血管,减轻心脏负荷;地高辛0.25 mg qd,强心等治疗。在完善相关检查,除外手术禁忌后行房室结消融联合希氏束远端起搏术,术中经腋静脉穿刺后植入右心室导线至右心室低位间隔部并连接临时起搏备用。移动鞘管(C315HIS,美国美敦力公司)接近三尖瓣环进行标测寻找到希氏束,主动固定导线(3830,美国美敦力公司)由近至远标记希氏束电位。见图2。
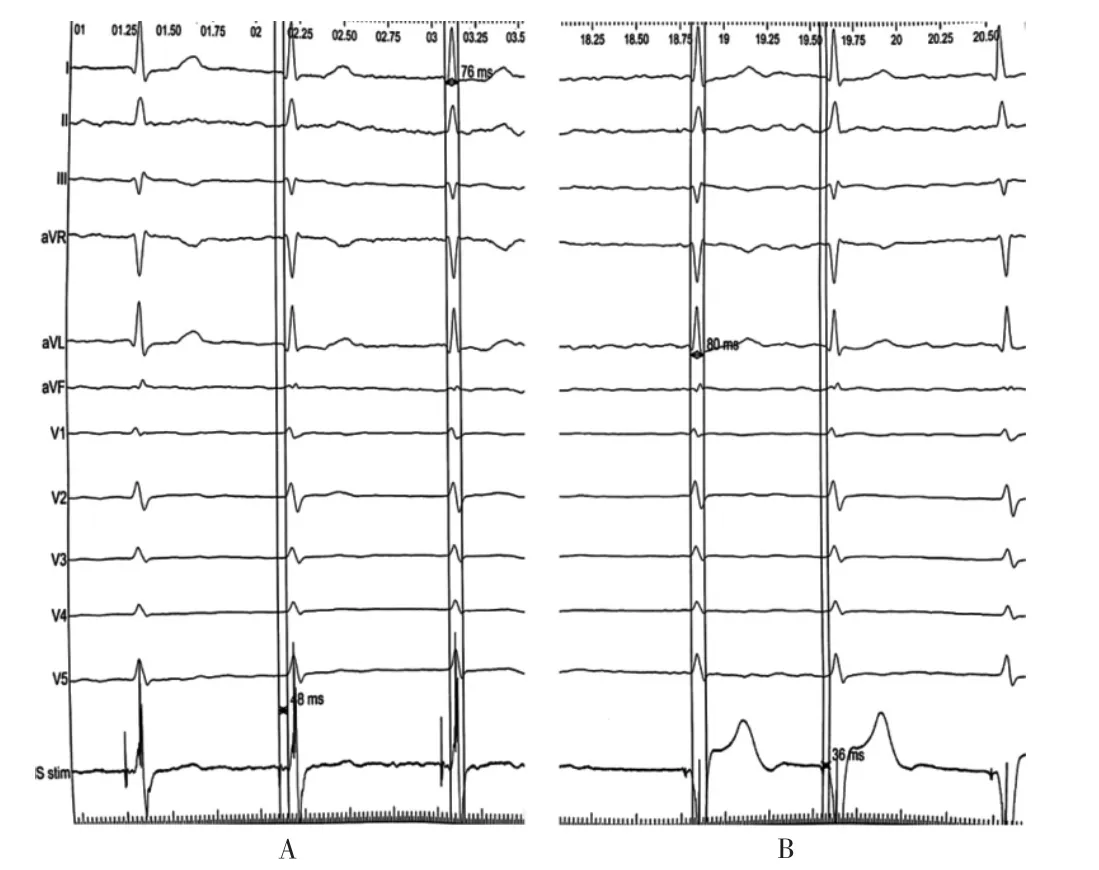
图2 希氏束电位及标测
希氏束远端夺获希氏束QRS 更窄,于希氏束远端固定电极,希氏束夺获阈值1 V/0.4 ms,阻抗800 Ω,感知8 mV。参数满意。以3830 电极为参照,经右股静脉标记希氏束到近端,略微再向房侧回撤消融房室结,见图3。术前及术后心电图,见图4。
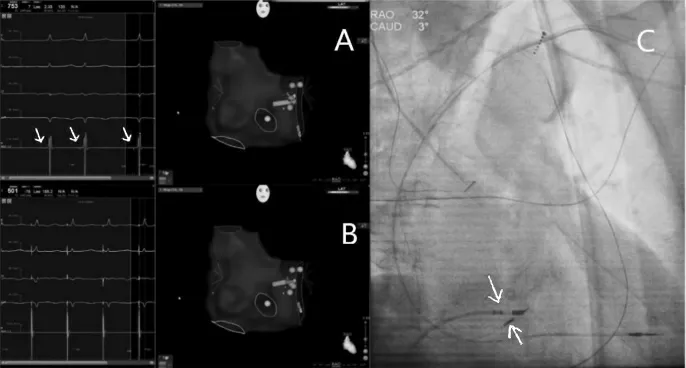
图3 房室结消融三维与二维图像
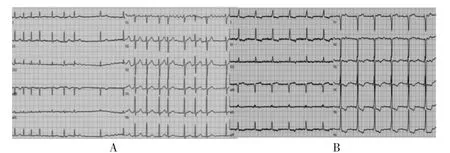
图4 住院心电图
随访:术后1、3、6 个月随访,患者无夜间阵发性呼吸困难,活动耐量显著改善,心脏超声指标显著改善,见表1。
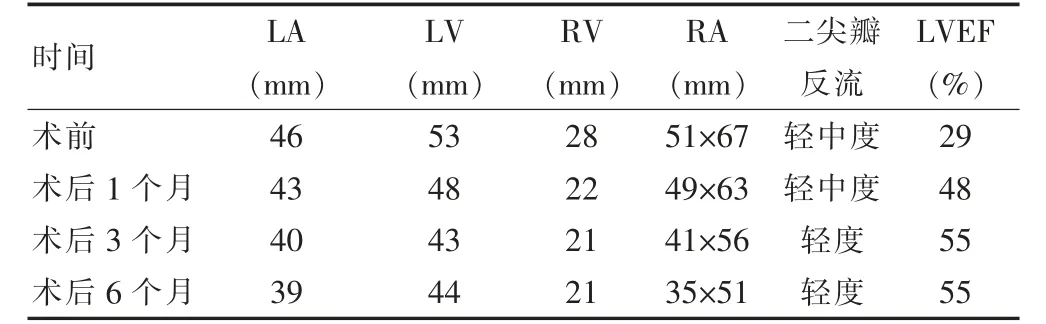
表1 术前、术后随访患者心脏超声结果
2 讨论
AMC 是心力衰竭的一个重要的可逆病因,但在目前的临床实践中,对AMC 的诊断及认识仍不足。在AMC 中,心房颤动被认为是心功能不全的唯一原因,或使原有心肌病或心力衰竭患者的心功能不全加重。有学者[8-10]研究发现,导管消融术后,58%~76%的心力衰竭患者心功能恢复正常,提示AMC 在心房颤动合并心力衰竭患者中比例不低,应予以引起重视。其病理生理机制目前尚不明确,快速心室率被认为是AMC 的主要原因之一,但一项研究[11]显示在67 例行心房颤动导管消融的心力衰竭患者中,仅有22%的患者静息心室率>100 次/min,然而却有75%的患者心功能恢复正常。AMC 在临床上可能并不少见,该患者有长期大量饮酒史,符合酒精性心肌病的诊断,但该患者戒酒7 年,心功能并未改善,且逐年恶化,但应用胺碘酮转为窦性心律后心功能能够恢复,后因不能耐受胺碘酮副作用及心房纤维化重,不宜行导管消融等原因,故行房室结消融联合希氏束起搏后心功能迅速恢复,且随访6 个月心功能均正常,提示AMC 是导致该患者心功能恶化的主要原因。因此,临床上合并心房颤动的不明原因心力衰竭的患者应考虑心房颤动介导心肌病的可能。
AMC的治疗与常规心力衰竭的治疗有所不同,从AMC 病例生理机制看,节律控制应是首选的治疗方案,导管消融是心房颤动维持窦律的有效方案之一。CASTLE-AF[12]是一项评估导管消融与药物治疗对心房颤动合并心力衰竭远期预后影响的随机对照试验,研究中纳入363 例患者(LVEF<35%),随机分配到药物治疗组和导管消融组。随访5 年,导管消融组的全因死亡率和心力衰竭再住院率组成的复合终点事件,较药物治疗组下降16%,然而心房颤动合并心力衰竭的导管消融治疗仍然面临挑战,如成功率、消融策略、并发症等问题。在心力衰竭患者中,胺碘酮是节律控制的主要药物,AF-CHF 研究中节律控制组胺碘酮应用比例高达82%,但与室率控制组相比心力衰竭患者临床预后并未改善,且胺碘酮的副作用在应用中仍需重视。该患者在间断服用胺碘酮2 年后,出现严重的肺间质纤维化。除节律控制外,室率控制亦应作为AMC 一线治疗方案,但Mulder 等[13]研究显示,在心房颤动合并心衰患者中,严格室率控制并未改善心衰患者预后。β 受体阻滞剂是AMC 患者应用最广泛的室率控制药物,而一项荟萃分析纳入了11 个随机对照实验研究[14],结果发现β 受体阻滞剂虽然可降低窦性心律合并心力衰竭患者死亡率(HR=0.73,95%CI:0.67~0.79,P <0.001),但并未降低心房颤动合并心力衰竭患者的死亡率(HR=0.96,95%CI:0.81~1.12,P=0.58)。钙离子拮抗剂在HFrEF 患者中应用受到限制,地高辛被证实增加心房颤动患者死亡率。因此,药物在AMC 患者室率控制的价值仍需探讨。临床上对于AMC 患者采取何种治疗方案,应根据具体病例情况具体分析。希氏束由特殊的心肌细胞组成,该心肌细胞从房室结延伸到膜状室间隔,是最生理性的起搏方式[15]。为了能够规范希氏束起搏的临床应用及研究,国际希氏束工作专家组发布了永久希氏束起搏的专家共识,其中提出希氏束起搏的定义,包括选择性和非选择性希氏束起搏,共识中推荐非选择性希氏束起搏,因局部心肌夺获可用于自身备用,安全性更高[16]。目前推荐希氏束起搏适用于持续性心房颤动伴心力衰竭需房室结消融,心室起搏支持的患者;房室传导阻滞希氏束以下传导功能保留的患者;病态窦房结综合征伴有长PR 间期,需行心室起搏的患者等[7,17]。由我国专家提出的希浦系统起搏中国专家共识即将发布。该例患者心力衰竭程度较重,心房颤动持续时间较长,心房纤维化较重,胺碘酮所致的肺间质纤维化等因素导致行心房颤动导管消融成功率较低,且患者耐受性差,风险较大,但该患者有效节律控制可能使患者心功能获益。多项研究[7,18-22]证实房室结消融联合希氏束起搏能够改善心房颤动合并心力衰竭患者心脏功能,希氏束起搏的成功率85.0%~96.2%。该患者行房室结消融联合希氏束起搏后心功能恢复正常,并尽可能做到房室结消融而避免损伤希氏束。房室结消融成功的标准为完全性房室传导阻滞伴稳定的交界区逸搏心率[21]。一般在右侧消融达到完全性房室传导阻滞的成功率为95%~97%,房室结消融并发症的发生率为3.2%,必要时术前放置临时起搏器,给予高频率起搏[24-25]。因此对于药物治疗无效、反复消融失败、预期再次消融成功率不高、高龄的快心室率心房颤动伴心力衰竭患者,房室结消融+希浦系统起搏应是较好的治疗选择,房室结消融联合希氏束起搏有望成为治疗AMC 的主要策略之一,其远期治疗价值仍需观察。未来仍需要设计大型、前瞻性、随机对照试验来进一步证实。

