耐盐桑黄菌株筛选及其驯化
李羚,郭立忠,李树文
(青岛农业大学生命科学学院/山东省应用真菌重点实验室,山东青岛 266109)
桑黄是一类硬质多孔菌的总称,在分类上属于真菌界担子菌门(Basidiomycota),伞菌纲(Agaricomycetes),刺革菌目(Hymenochaetales),刺革菌科(Hymenochaetaceae),桑黄孔菌属(Sanghuangporus)[1-2],其药用价值在秦汉时期《神农本草经》、唐代《药性论》、宋代《大观本草》、明朝《本草纲目》、清代《四库全书》和当代《中药大辞典》等众多的医学著作中都有记载和说明[3-4]。现代研究发现桑黄子实体和菌丝体中含有多种化合物,包括多糖类、黄酮类、三萜类、吡喃酮类、多酚类、生物碱、香豆素类等成分,具有抗肿瘤、保肝、降血糖、抗血管生成、抗氧化、抗炎、增强免疫等药理作用,广泛用于药品、保健品、食品和护肤品中[5-7]。为了获得大量的子实体和菌丝体,已经开展了桑黄的人工培养研究,包括桑黄原种固体培养、桑黄菌丝液体发酵和桑黄人工子实体栽培[8-10],其中子实体栽培的原料有段木栽培和代料栽培。段木栽培方式为畦床埋土栽培[11-12],代料栽培采用的方式包括直接出菇、埋土栽培和吊袋栽培,研究表明埋土栽培产量高且水分管理方便[13]。
我国盐碱地资源量多且分布广泛,其高效利用对我国耕地农业生产能力的提升、国家粮食安全的保障具有重要意义,并且其可持续利用技术研发及管理研究已受到国内外学者的高度重视[14]。本文以实验室保存的能够进行人工栽培的桑黄菌株为研究对象,从海水盐度和NaCl浓度两个方面进行耐盐菌株的筛选研究,为未来盐碱地埋土栽培产桑黄子实体以及海水发酵培养桑黄菌丝体产活性物质的研究提供菌株资源和实践指导。
1 材料与方法
1.1 菌株
3株桑黄菌株采集自黑龙江、山东和云南,分别命名为桑黄HLJ、桑黄SYS、桑黄W,其中桑黄HLJ为暴马桑黄(Sanghuangporusbaumii),桑黄SYS和桑黄W为桑树桑黄(Sanghuangporussanghuang),保存于山东省应用真菌重点实验室。
1.2 培养基
PDA培养基,成分为马铃薯200 g,葡萄糖20 g,琼脂20 g,蒸馏水1 000 mL。灭菌条件:115 ℃,20 min。
1.3 试验方法
1.3.1 不同海水盐度对桑黄菌丝生长的影响
海水取自青岛市即墨区鳌山卫海域,手持式折射仪测量初始盐度为3.2%,用蒸馏水稀释盐度分别为0.8%和1.6%的溶液,加入PDA粉末,配置盐度分别为0%、0.8%、1.6%、3.2%的PDA培养基,倒平板后接种菌饼,28 ℃培养,直尺测量并记录不同培养时间的菌落直径(每个浓度做3次重复,以下同)。
1.3.2 不同NaCl浓度对桑黄菌丝生长的影响
PDA培养基中加入不同质量的NaCl,配制NaCl含量分别为0%、0.3%、0.6%、1%(w/v)的培养基,其他过程与1.3.1相同。
1.3.3 耐盐菌株传代驯化
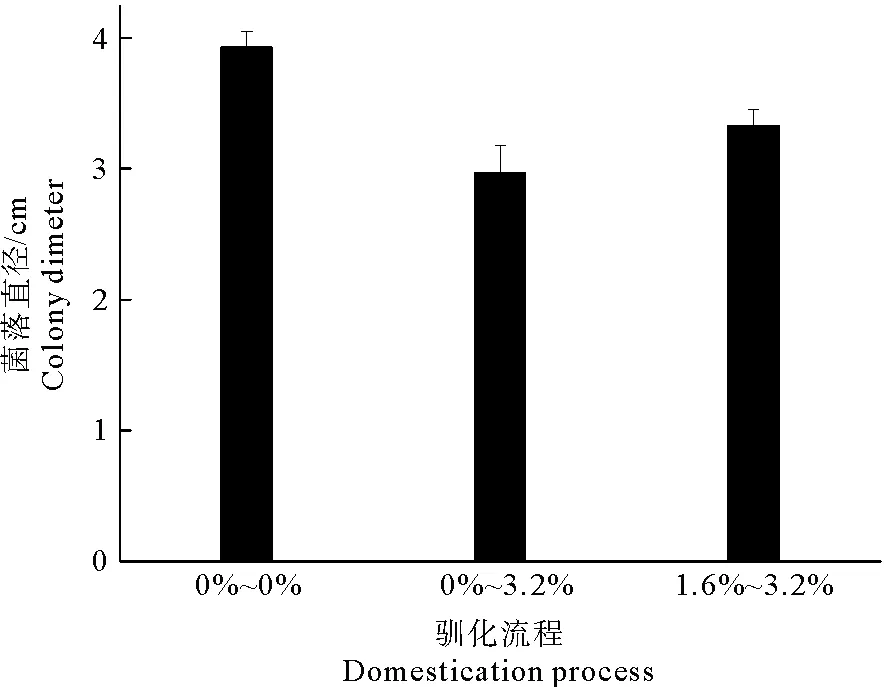
菌株接种到0.8%海盐培养基中培养5 d后,8 mm打孔器打孔成菌饼,取菌饼接种到0.8%培养基中培养1代后,再转接到1.6%培养基中培养5 d,然后再转接到1.6%培养基中培养5 d,最后接种到3.2%培养基中培养测量,该过程经过了海盐含量分别为0.8%和1.6%的1次同盐度的驯化培养后进行转接(记为1.6%~3.2%);在1.6%同盐度接种时,进行盐度0%的接种,培养后接种盐度3.2%培养基(记为0%~3.2%),作为传代驯化的对照。具体过程如图1所示,接种过程和测量过程与1.3.1 相同。

图1 耐盐菌株传代驯化流程Fig.1 Continuous passage acclimatization of saline-tolerant strains
1.4 数据统计与处理
试验结果采用Mean±SD表示,重复3次。采用Excel 2016进行数据统计和方差分析;采用OriginPro 8.5进行绘图。
2 结果与分析
2.1 海水盐度对桑黄菌丝生长的影响
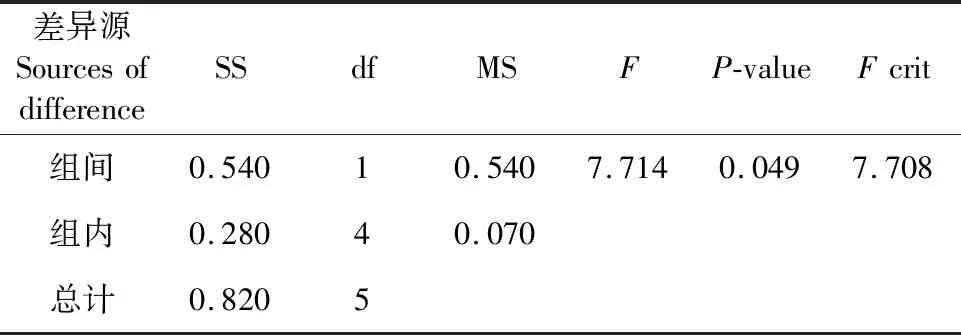
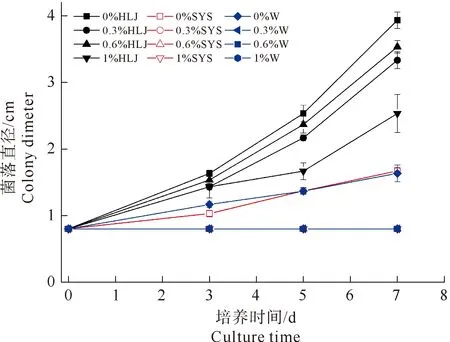
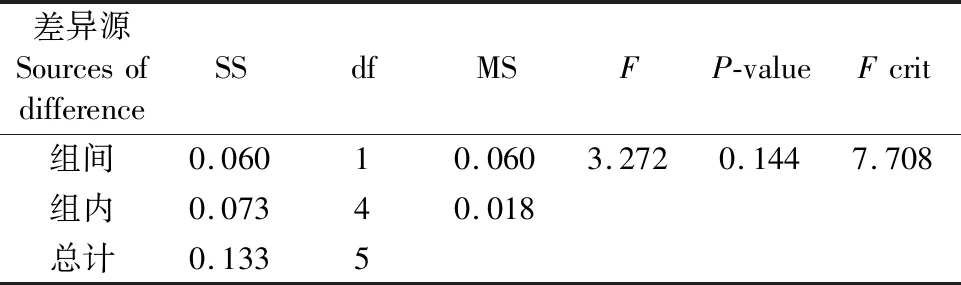
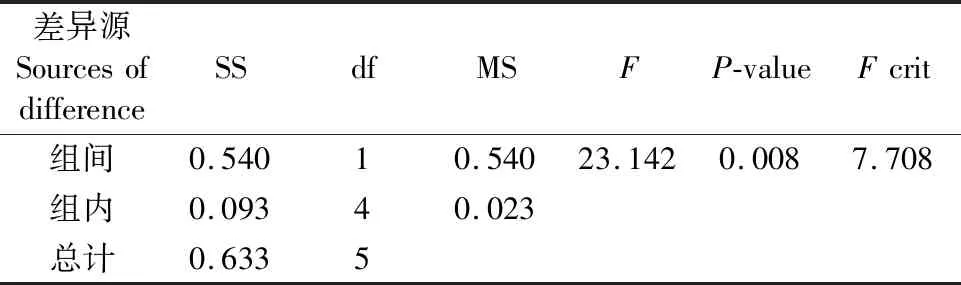
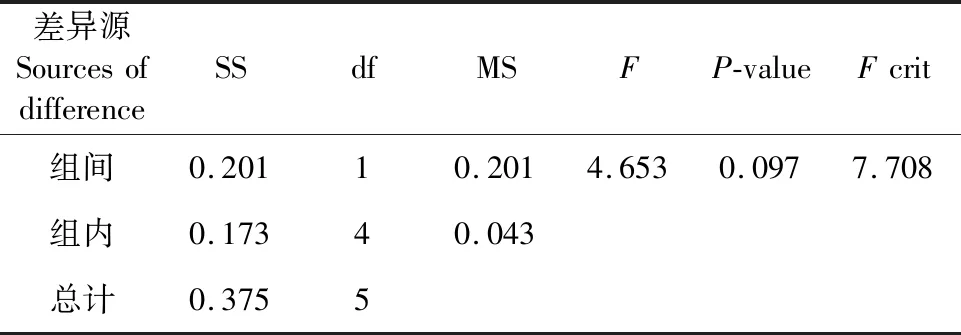
由图2可知,桑黄HLJ可在盐度为0%、0.8%、1.6%和3.2%的培养基上生长,平均生长速率分别为0.56 cm/d、0.57 cm/d、0.58 cm/d和0.38 cm/d,盐度为0.8%和1.6%时其菌丝生长速率与无盐度时相当;盐度3.2%时抑制了菌丝生长,抑制率为12%,且与对照比较(如表1所示)具有显著的抑制性(Fcrit 图2 海水盐度对菌丝生长的影响Fig.2 The effect of salinity of sea water on mycelial growth 表1 3.2%盐度和对照对HLJ菌丝生长影响的方差分析Table 1 Anova analysis of mycelial growth of strain HLJ cultured with salinity of 3.2% and 0% 由图3所示,桑黄HLJ能够在NaCl浓度为0%、0.3%、0.6%、1%的培养基上生长,平均生长速率分别为0.56 cm/d、0.47 cm/d、0.50 cm/d和0.36 cm/d,与对照0%生长速度比较,0.3%、0.6%、1%的NaCl浓度抑制菌丝的生长,抑制率分别为16%、11%和36%,其中盐度为0.6%时抑制率低于0.3%。通过方差分析可知(表2),Fcrit>F,二者差异不明显,不能说明0.6% NaCl的抑制程度低于0.3%,出现上述结果为试验误差导致的。0.3%、0.6%和1% NaCl浓度抑制桑黄SYS和桑黄W的菌丝生长,7 d内平均生长速率为0 cm/d。可见,与桑黄SYS和桑黄W比较,桑黄HLJ对NaCl盐度的抗性较强。综上所述,下一步以桑黄HLJ进行耐盐驯化试验,以提高其耐盐性。 图3 NaCl浓度对菌丝生长的影响Fig.3 The effect of NaCl concentration on mycelial growth 表2 0.3%和0.6%盐度对HLJ菌丝生长影响的方差分析Table 2 Anova analysis of mycelial growth of strain HLJ cultured with salinity of 0.3% and 0.6% 由图4所示,传代驯化后即1.6%~3.2%桑黄HLJ在3.2%盐度培养基生长速度为0.48 cm/d,只传代没有驯化直接接种3.2%盐度培养基即0%~3.2%桑黄HLJ生长速度为0.42 cm/d,对照不含盐的培养基即0%~0%桑黄HLJ传代后的生长速度为0.56 cm/d。可见,与对照比较,1.6%~3.2%传代驯化后的菌株的生长速度受到明显的抑制作用(Fcrit 图4 桑黄HLJ菌株驯化结果Fig.4 The acclimatization of strain HLJ 表3 0%~0%和1.6%~3.2%盐度对HLJ菌丝生长影响的方差分析Table 3 Anova analysis of mycelial growth of strain HLJ cultured with salinity range of 0%~0% and 1.6~3.2% 表4 0%~3.2%和1.6%~3.2%盐度对HLJ菌丝生长影响的方差分析Table 4 Anova analysis of mycelial growth of strain HLJ cultured with salinity range of 0%~3.2% and 1.6~3.2% 桑黄子实体栽培已经实现了畦床埋土栽培出黄的工艺,本研究筛选的耐盐菌株桑黄HLJ具有较强的抗盐能力,存在着在盐碱地畦床埋土栽培出黄的可能性。盐度0.5%以上盐碱地基本上处于荒芜状态,不适合农作物种植,如果将桑黄菌株与中度、重度盐碱地相结合,可开发耐盐碱药用菌,提高盐碱地资源利用率,为盐碱地高值化开发利用提供优质菌种和可行性[15],其盐碱地栽培出黄技术需要进一步研究。 盐度会影响菌丝体的生化组成[16]。目前以海水为溶液,以食用菌、药用菌为研究对象,从事食药用菌海水发酵的报道较少[17]。本研究获得桑黄HLJ菌株在盐度为3.2%海水中虽然受到抑制,但能够生长,依据其抗盐特性进而可探索其在高盐条件下活性物质的种类、产量以及可能的新型活性物质等,从而利用海水,节约淡水资源。 因此,抗盐食用菌菌株的筛选为盐碱地的开发利用、海水发酵活性物质的产生提供了菌株资源。 桑黄HLJ、桑黄SYS、桑黄W对海水盐度和NaCl抗性不同,其中桑黄HLJ抗盐能力强于桑黄SYS和桑黄W。 桑黄HLJ经过海水盐度传代驯化培养后,其生长速度比没有经过驯化菌株略有提高,但是二者差异不显著,且与对照比较,仍然受到显著性的抑制作用,生长抑制率为15%。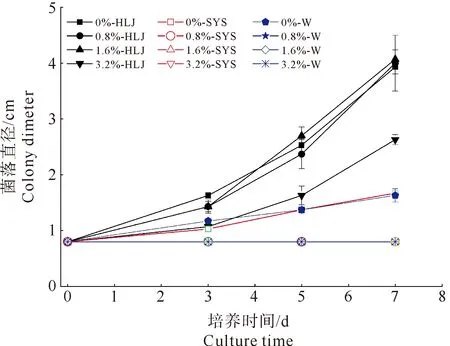
2.2 NaCl浓度对桑黄菌丝生长的影响
2.3 桑黄HLJ耐盐驯化
3 讨论
4 结论

