接种苹果炭疽叶枯病菌对苹果叶片相关酶活性及基因表达的影响
刘瑛双,房中文,TURAKULOV Kh S,刘春晓,董超华,张玉刚
(1.青岛农业大学园艺学院/青岛市园艺植物遗传改良与育种重点实验室,山东青岛 266109;2.诸城市农技推广中心,山东诸城 262200;3.乌兹别克斯坦科学院遗传所,塔什干州 702151;4.青岛农业大学生命科学学院)
在我国,苹果不仅是人们日常生活中最常见的水果之一,也是世界四大水果之一[1],它的产量及品质会直接影响其商品价值。在苹果生产中,各种病害频繁发生,因此开展苹果抗病研究对苹果产业的可持续发展至关重要。苹果炭疽菌叶枯病(Glomerella leaf spot,GLS)是近年来在我国苹果主产区流行起来的一种危害严重的真菌性病害,该病于1988年首次在巴西被报道,2009年之后在我国山东、陕西、河南等苹果主产区蔓延。该病是由围小丛壳菌Glomerellacingulata(Stonem)Spauld&Schrenk(有性态)引起的[2-3],会导致苹果的早期落叶、侵染果实致其产生坏死性斑点,严重危害我国苹果产业发展。我国北方地区,夏季高温多湿,是该病的高发期。
自然界许多病原微生物都可入侵植物致其发病,但大自然中的植物多数情况下都能正常生长,这表明植物与病原微生物是共同进化的。这一过程中,植物建立了一套能够防御病原菌入侵的天然免疫系统[4-6]。自从1978年Fridovich提出生物超氧离子自由基学说后,研究人员开始广泛关注保护酶与植物抗病性之间的关系。近年来发现了很多与植物抗病相关的酶,主要涉及水解酶、氧化酶和抗氧化酶等[7-9],其中研究最多的有多酚氧化酶(polyphenoloxidas,PPO)、超氧化物歧化酶(superoxide dismutase,SOD)、过氧化物酶(peroxidase,POD)、过氧化氢酶(catalase,CAT)等。PPO广泛存在于自然界的各种植物中,通过合成木质素以及醌类化合物来保护植物[10-13]。木质素是维管组织细胞壁的主要成分,它能抵御病原物的入侵。醌类物质不仅能毒杀病原菌,而且还能对已经感染的组织发挥作用[14]。植物体受到病菌入侵后会产生更多的活性氧和自由基,对植物细胞产生毒害作用。而SOD能够催化活性氧生成过氧化氢和氧气,从而减弱该作用[15]。该反应主要与过氧化物酶(POD),过氧化氢酶(CAT)等共同发挥作用[16]。POD普遍存在于植物各个组织中,不仅能催化各类还原剂的氧化反应,也能生成醌类化合物和木质素。相关研究表明,POD的活性与植物抗病性呈正相关[17]。CAT也在植物体内普遍存在,主要存在于乙醛酸循环体、过氧化物酶体和线粒体中,在病原菌侵染植物过程中发挥重要的防御作用。植物体受到病原菌入侵初期,水杨酸抑制CAT的活性,导致H2O2含量快速增加,并生成氧分子,从而触发苯甲酸生成水杨酸的反应,增强超敏反应,抵御病原菌的侵染[18]。
1 材料与方法
1.1 材料
1.1.1 植物材料
选择青岛农业大学现代农业科技示范园保存的‘嘎拉’和‘富士’枝条为材料。采样后在实验室内将苹果炭疽叶枯病菌接种到苹果叶片上,分别在接菌后0 h、12 h、24 h、36 h、48 h、60 h、72 h采样,立即放入液氮中速冻,于-80 ℃冰箱中保存。
1.1.2 供试病菌
实验室保存的苹果炭疽叶枯病菌。
1.1.3 相关分子生物学试剂
实时荧光定量PCR试剂盒ChamQ SYBR Color qPCR Master MIX购自诺唯赞公司,反转录试剂盒PrimeScript RT reagent Kit with gDNA Eraser (Perfect Real Time)购自TaKaRa公司,RNA提取试剂盒RNAprep Pure Plant Kit购自TIANGEN公司。
1.1.4 试验仪器
PCR仪(Eppendorf)、低温高速离心机(Eppendorf)、超净工作台、DYY-II型电泳仪、凝胶成像系统、金属浴、恒温振荡器、高压蒸汽灭菌锅、移液枪、超纯水仪、ABI实时定量分析仪、Nanodrop 2000微量分光光度计、DNase/RNase-free离心管。
1.2 试验方法
1.2.1 菌种的培养及悬浮孢子液的配制
将炭疽叶枯病病原菌接种到 PDA培养基中,放置于25 ℃培养箱培养5 d。挑取菌丝,接种于查化培养基中,放于25 ℃、200 r/min摇床中培养3 d。
查化培养基(0.5 L)配方为:KNO35 g,KH2PO42.5 g,MgSO4·7H2O 1.25 g,Fe2(SO4)30.01 g,蔗糖 25 g,H2O 0.5 L。
1.2.2 分生孢子萌发力测定
将苹果炭疽病菌孢子悬浮液滴在洁净的单凹载玻片上,然后盖上盖玻片,放入湿盒中,在25 ℃ 培养箱中培养12 h。在显微镜下观察孢子的萌发,平均萌发力在 20%以上则可用于后续试验。
1.2.3 苹果炭疽叶枯病菌的人工接种及样品采集
田间选取‘嘎拉’和‘富士’一年生枝条,顶端带有 3~4 片幼叶,将样品放于含有水的泡沫箱内,采集完成后迅速带回实验室。首先用 75%的酒精对叶片进行消毒30 s,接着用无菌水清洗1 min,清洗过程重复3次,然后将枝条插入提前消毒好的泡沫箱内,并在箱子底部加入少许无菌水,将配好的孢子悬浮液用喷壶喷到叶片的正反面,用无菌水喷施苹果叶片作对照,每组设3个重复,并将装有枝条的泡沫箱置于25 ℃培养箱。分别在接种后的0 h、12 h、24 h、36 h、48 h、60 h进行采样。所有采集的叶片立即投入液氮中速冻,并于-80 ℃保存。
1.2.4 酶液提取及测定方法
称取 0.5 g 叶片放于提前冷却的研钵中,加入液氮并快速研磨,研磨均匀后,加入装有酶活性测定提取缓冲液的离心管中,于 4 ℃、12 000 r/min 离心,上清液即为粗酶液。SOD 活性的测定方法参照 ROTH等[19]进行。PPO 的活性测定方法参照 FEHRMANN等[8]方法。POD 活性测定方法参照 LIN等[20]进行。CAT 的活性是根据 H2O2的减少量来衡量的,其测定方法参照AEBI[21]进行。每个处理重复 3 次。
1.2.5 植物总RNA的提取及cDNA的合成
采用TIANGEN公司的RNAprep Pure Plant Kit试剂盒,利用液氮研磨法进行植物总RNA的提取,按照试剂盒说明进行操作。使用Nanodrop2000分光光度计检测RNA的浓度,1%的琼脂糖凝胶电泳检测RNA的完整性。将RNA提取液保存于-80 ℃冰箱。
采用TaKaRa公司的PrimeScript RT reagent Kit with gDNA Eraser (Perfect Real Time)试剂盒进行cDNA的合成:冰上配制去基因组DNA反应液,依次将1 μg 总 RNA,2 μL 5×gDNA Eraser Buffer,1 μL gDNA Eraser加入至体积为0.2 mL灭菌的离心管中,用RNase Free dH2O补足至10 μL,42 ℃ 2 min;向上述反应液中依次加入1 μL PrimerScript RT Enzyme Mix I,1 μL RT Primer Mix,4 μL 5×PrimerScript Buffer 2 (for Real Time),用 RNase Free dH2O补足20 μL,37 ℃ 反应15 min后85 ℃ 反应5 s ,反应完成后得到cDNA溶液。将cDNA溶液置于-20 ℃保存。
1.2.6 实时荧光定量PCR反应体系
采用诺唯赞公司的ChamQ SYBR Color qPCR Master Mix试剂盒进行荧光定量PCR反应:
反应体系配置如下:在96孔反应板中依次加入2 × ChamQ SYBR Color qPCR Master Mix (Low ROX Premixed),Primer1 0.4 μL,Primer2 0.4 μL,50 × ROX Reference Dye 1 0.4 μL,cDNA 1μL,ddH2O 7.4 μL,cDNA 1 μL,RNase Free ddH2O 7.4 μL。
定量PCR反应程序参照该产品说明书。
引物的特异性扩增采用其中一个样本,根据熔解曲线验证引物扩增出单一的峰值即可。以苹果的GAPDH为内参基因,每组设3个重复,调整各模板浓度至合适浓度,数据分析采用2-ΔΔCt方法计算。
引物由上海生工生物有限公司合成,具体序列如表1。

表1 实时荧光定量PCR相关引物序列信息Table 1 qRT-PCR related primer sequence information
1.3 数据统计与分析
利用Excel软件、GraphPad Prism软件对试验数据进行分析和绘图。
2 结果与分析
2.1 菌种的培养及孢子悬浮液的获得
将苹果炭疽叶枯病菌菌饼接种于PDA培养基中,置于25 ℃培养箱中培养5 d(图1A),挑取培养基中正常生长的菌丝,接种于查化培养基中,25 ℃、200 r/min摇床培养3 d。将获得的悬浮孢子液用灭菌纱布过滤,除去培养基中的菌丝。吸取200 μL孢子悬浮液,滴在洁净的单凹载玻片上,置于显微镜下观察(图1B),然后盖上盖玻片,放入湿盒中,在25 ℃ 培养箱中培养12 h,在显微镜下观察孢子的萌发。
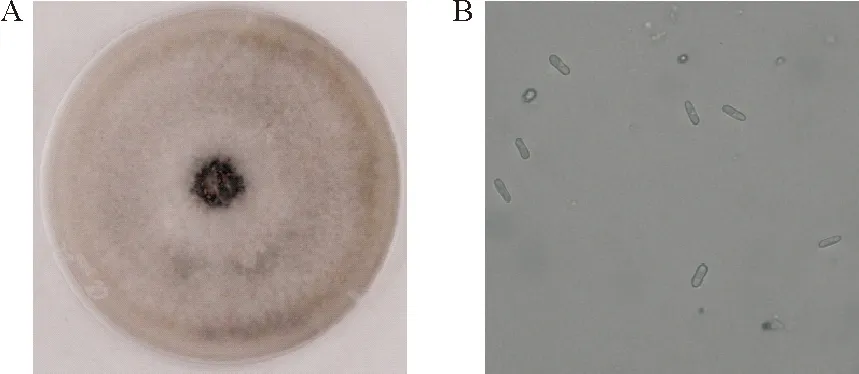
A:生长5 d的原菌菌丝;B:孢子悬浮液A:The mycelium grew for 5 days;B:The spore suspension图1 苹果炭疽叶枯病原菌菌丝及孢子Fig.1 Hypha and spores of GLS in apple
2.2 相关酶活性变化规律分析
2.2.1 SOD酶活性变化分析
SOD 是一种含有金属辅基的活性蛋白酶,在生物体内普遍存在,它可以通过清除植物体内的氧自由基使细胞免受损害。根据图2所示,接种后‘富士’和‘嘎拉’叶片中SOD 酶活性变化趋势相似。在整个处理时期,SOD 酶活性呈现逐渐增加的趋势,在36 h时酶活性达到最大值。在 ‘富士’和‘嘎拉’中,以接种后0 h叶片的酶活性做对照,接种后36 h、48 h及60 h叶片的酶活性增加,并且具有极显著差异,而其他处理则没有显著差异。综上所述,在‘富士’和‘嘎拉’叶片上接种炭疽叶枯病菌可以引起SOD酶活性的增加。
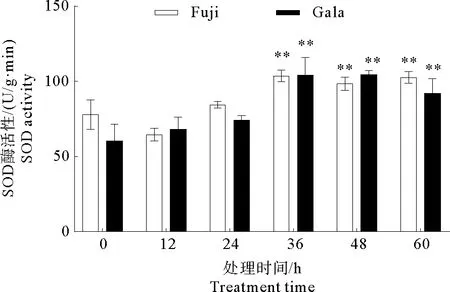
图2 ‘富士’和‘嘎拉’苹果接种炭疽叶枯病菌后SOD活性的变化Fig.2 Changes of SOD activity after inoculation by Glomerella cingulata on ‘Gala’and ‘Fuji’apple leaves注:* * 极显著差异,P<0.01。Note:* * Significant extremely difference,P<0.01.
2.2.2 PPO酶活性变化分析
PPO与植物抵御病原菌入侵有关。一方面,它可以形成醌类物质直接发挥作用,另一方面,催化合成的醌类物质和木质素可以形成保护性屏障防止病菌侵害。根据图3所示,接种后‘富士’和‘嘎拉’叶片中PPO酶活性变化趋势相同,在36 h内PPO活性呈现逐渐升高的趋势,36 h出现峰值,之后呈现下降趋势。在‘富士’和‘嘎拉’中,以接种后0 h叶片酶活性为对照,其他处理组叶片的酶活性增加,并且具有极显著差异。综上所述,在‘富士’和‘嘎拉’叶片上接种炭疽叶枯病菌可以引起PPO酶活性的增加。
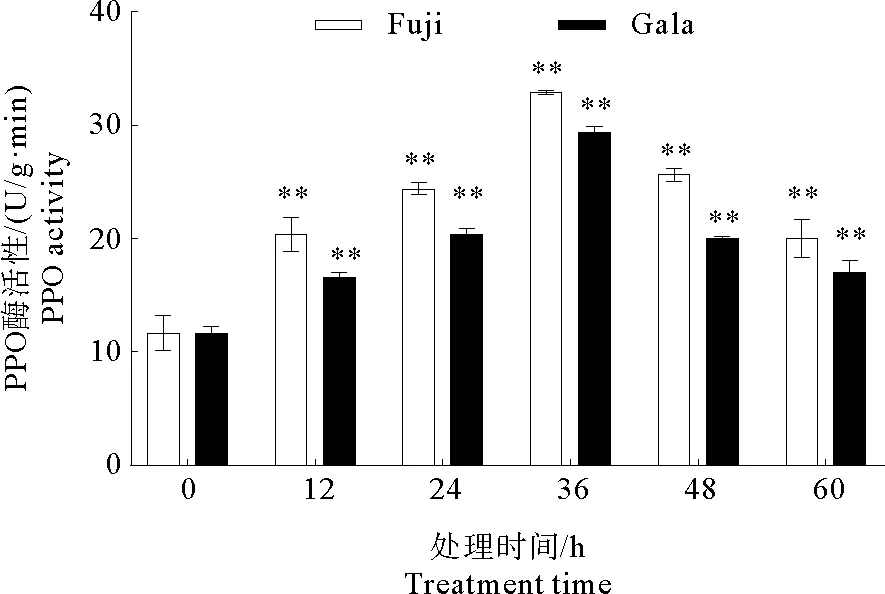
图3 ‘富士’和‘嘎拉’苹果接种炭疽叶枯病菌后PPO活性的变化Fig.3 Changes of PPO activity after inoculation by Glomerella cingulata on ‘Gala’and ‘Fuji’apple leaves注:* * 极显著差异,P<0.01。Note:* * Significant extremely difference,P<0.01.
2.2.3 POD酶活性变化分析
POD能催化过氧化氢(H2O2)水解生成H2O。H2O2是经过氧化酶催化产生的细胞毒性物质,清除植物细胞内的 H2O2可以对细胞起到保护作用。POD参与植物组织中木质素的形成,是生成木质素的最后一步反应的酶。根据图4所示,接种后‘富士’和‘嘎拉’叶片中POD酶活性变化趋势相似。从总体上说,接种后POD酶活性呈现缓慢上升的趋势,随后快速上升并在48 h时达到峰值,48 h后酶活性下降。在‘富士’中,以接种后0 h叶片酶活性为对照,接种后其它处理组叶片的酶活性增加,其中24 h的酶活性差异显著,36 h、48 h、60 h的酶活性差异极显著。在“嘎拉”中,以接种后0 h叶片酶活性为对照,接种后24 h叶片的酶活性具有显著差异,接种后48 h和60 h叶片的酶活性具有极显著差异,其他处理组叶片的酶活性无显著差异。综上所述,在‘富士’和‘嘎拉’叶片上接种炭疽叶枯病菌可以引起POD酶活性增加。
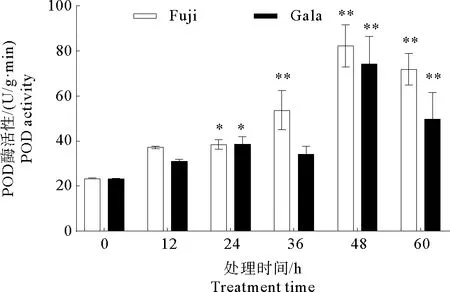
图4 ‘富士’和‘嘎拉’苹果接种炭疽叶枯病菌后POD活性的变化Fig.4 Changes of POD activity after inoculation by Glomerella cingulata on ‘Gala’and ‘Fuji’apple leaves注:* 显著差异,P<0.05,* * 极显著差异,P<0.01。Note:* Significant difference,P<0.05,* * Significant extremely difference,P<0.01.
2.2.4 CAT酶活性变化分析
CAT是植物防御体系中的关键酶之一,主要功能是清除植物体内的过氧化氢,使细胞免受毒害。根据图5所示,接种后‘富士’和‘嘎拉’叶片中CAT酶活性变化趋势相同,在36 h内CAT酶活性均呈上升趋势,在36 h出现峰值,之后呈现下降趋势。在‘富士’中,以接种后0 h叶片的酶活性为对照,接种后12 h叶片的酶活性没有显著差异,其他处理的叶片酶活性具有极显著差异。在‘嘎拉’中,以接种后0 h叶片的酶活性为对照,其他处理的叶片的酶活性都具有极显著差异。综上所述,在‘富士’和‘嘎拉’叶片上接种炭疽叶枯病菌可以引起CAT酶活性增加。
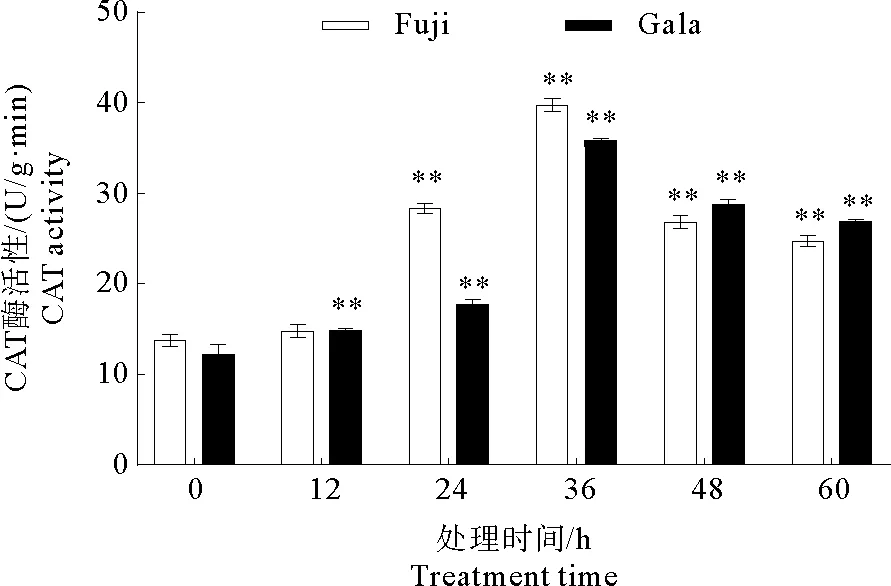
图5 ‘富士’和‘嘎拉’苹果接种炭疽叶枯病菌后CAT活性的变化Fig.5 Changes of CAT activity after inoculation by Glomerella cingulata on ‘Gala’and ‘Fuji’apple leaves注:* * 极显著差异,P<0.01。Note:* * Significant extremely difference,P<0.01.
2.3 相关酶活性基因的表达分析
2.3.1 SOD酶相关基因表达量分析
在苹果中,SOD基因主要编码Mn/Fe-SOD蛋白,GenBank注册号为GU321225。根据图6所示,接种病菌后,‘富士’和‘嘎拉’中SOD基因表达量明显升高,在接种后24 h左右达到峰值。在‘富士’中,以接种后0 h该基因的表达量为对照,接种后48 h该基因的表达量没有显著差异,其他处理组具有极显著差异。在‘嘎拉’中,与对照组相比,其他处理组基因表达量具有极显著差异。综上所述,在‘富士’和‘嘎拉’叶片上接种苹果炭疽叶枯病原菌可以使SOD基因的表达量增加。
2.3.2 PPO酶相关基因表达量分析
PPO基因(GeneID:103446446)在苹果中主要编码的是多酚氧化酶。根据图7所示,接种病菌后该基因表达量发生改变。在‘富士’中,以接种后0 h该基因的表达量为对照,其他处理组该基因的表达量具有极显著差异,具体表现为先减少后增加。在‘嘎拉’中,与对照相比,接种后48 h和60 h该基因表达量具有极显著差异,其他处理组无显著差异。从总体上看,‘富士’中该基因的表达量高于‘嘎拉’。综上所述,在‘富士’和‘嘎拉’叶片上接种苹果炭疽叶枯病原菌可以使PPO基因的表达量增加。
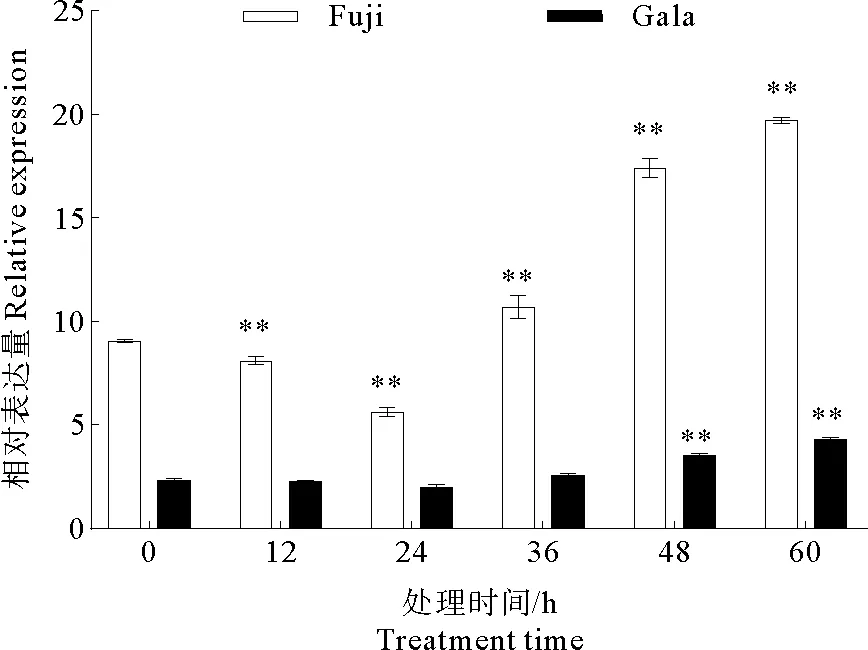
图7 PPO基因表达的定量分析Fig.7 Quantitative analysis of PPO gene expression注:* * 极显著差异,P<0.01。Note:* * Significant extremely difference,P<0.01.
2.3.3 POD酶相关基因表达量分析
苹果的POD基因主要编码POD酶。根据图8所示,在接种病菌后该基因的表达量增加。在‘富士’中,以接种后0 h该基因的表达量为对照,接种后48 h该基因的表达量减少,其他处理组该基因的表达量增加,具有极显著差异。在‘嘎拉’中,接种后24 h和36 h该基因的表达量增加,与对照组相比具有极显著差异,而其他处理组没有显著差异。从总体上看,‘富士’中该基因的表达量高于‘嘎拉’。综上所述,在‘富士’和‘嘎拉’叶片上接种苹果炭疽叶枯病原菌可以使POD基因的表达量增加。
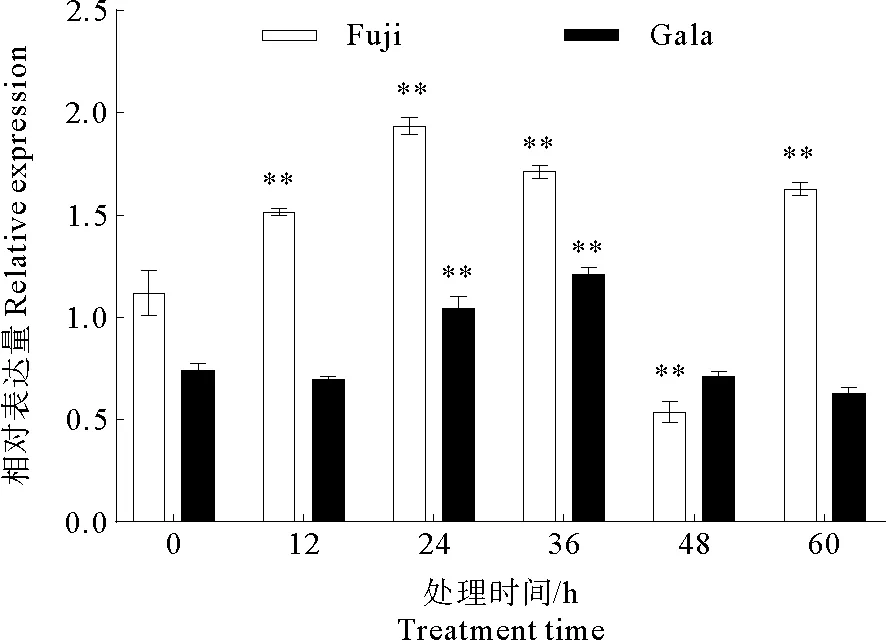
图8 POD基因表达的定量分析Fig.8 Quantitative analysis of POD gene expression注:* * 极显著差异,P<0.01。Note:* * Significant extremely difference,P<0.01.
2.3.4 CAT酶相关基因表达量分析
苹果中CAT1基因(GU321226)能够编码CAT酶。根据图9所示,接种病菌前后CAT1基因表达量总体呈现出先升高后降低的趋势,在24 h左右达到峰值,并且该基因在‘富士’和‘嘎拉’中表达量差别不大。在‘富士’中,与对照相比,接种60 h后该基因表达量无明显差异,而其他处理组具有极显著差异。在‘嘎拉’中,与对照相比,接种48 h后该基因的表达量无明显差异,而其他处理组具有极显著差异。综上所述,在‘富士’和‘嘎拉’叶片上接种苹果炭疽叶枯病原菌可以使CAT1基因的表达量增加。
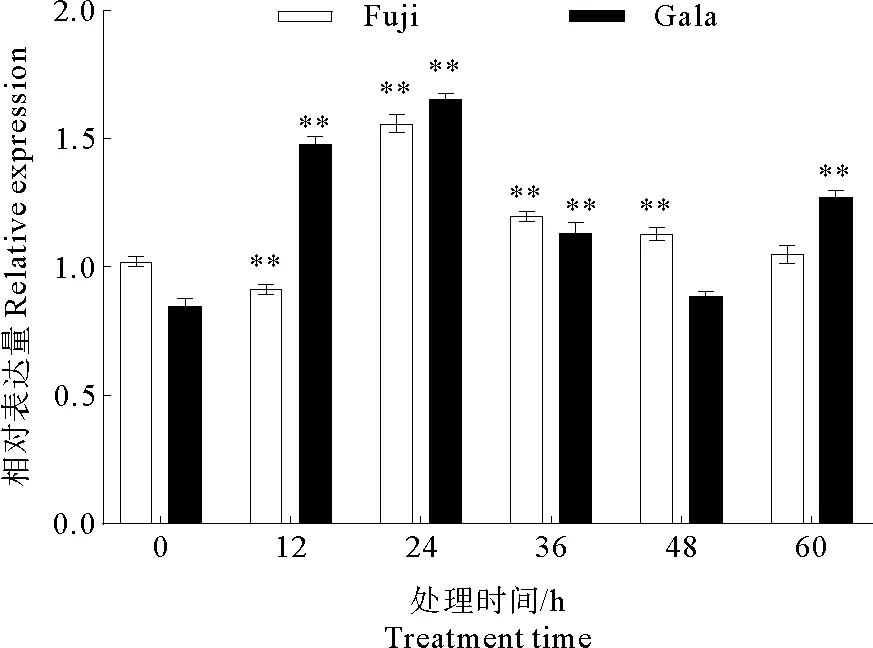
图9 CAT1基因表达的定量分析Fig.9 Quantitative analysis of CAT1 gene expression注:* * 极显著差异,P<0.01。Note:* * Significant extremely difference,P<0.01.
4 讨论与小结
苹果炭疽叶枯病是严重威胁苹果产业的病害,发病时可以导致90%以上苹果树叶脱落,影响果实发育。当植物受到病原体入侵时,会启动其体内的防御机制,通过体内活性氧和自由基的积累,来达到抑制病原体入侵的作用。但是这种防御机制既能杀死外源病原体,又会对植物自身的细胞产生毒害作用,最典型的就是当真菌入侵植物体时,植物会形成坏死的病斑从而抑制真菌扩散。在这种情况下就需要植物体内的酶系统来清除过多的活性氧和自由基。SOD、POD、CAT 3种酶作为植物防御系统中重要的酶类,共同构成清除活性氧的一个系统[22]。PPO和 POD 是植物体内普遍存在的酚类物质氧化酶,两者具有协同作用[23]。之前的研究发现,胶孢炭疽菌能够感染宁夏灵武长枣,引起SOD、PPO和POD酶活性呈现先增加后降低的趋势[23]。玉米幼茎细胞受 HT-毒素胁迫后 ,CAT酶活性呈现早期下降,后期上升的趋势[24]。
本试验通过室内人工接种苹果炭疽叶枯病菌的方式模拟植物在自然状态下的感病状态,通过测定分析SOD、PPO、POD以及CAT酶活性,发现在人工接种病原菌后4种酶的活性都有明显的提高,这说明SOD、PPO、POD、CAT在苹果抗炭疽叶枯病中发挥着重要的作用。通过实时荧光定量PCR研究这4种酶相关基因的表达量,研究发现:SOD、POD以及CAT 2种酶所对应的基因表达量变化都呈现先增加后降低的趋势,而PPO对应的基因呈现先减少后增加的趋势,并且‘富士’表达量明显高于‘嘎拉’。这些研究结果表明SOD、PPO、POD以及CAT与苹果抗炭疽叶枯病密切相关。该研究为深入了解植物保护酶与植物抗病之间关系提供了一定的理论基础,对植物的抗病研究具有一定的现实意义。

