加速部分乳腺照射的研究进展
王梓萌 向作林
对整个乳房进行长达5周的放疗加或不加1~2周的瘤床局部加量是早期乳腺癌保乳手术后的标准治疗方法[1]。但是,过大的照射面积和过长的照射周期可能会增加患者的治疗负担和经济压力,甚至降低患者的治疗意愿,不利于远期生存[2-3]。此外,多项研究[4-6]表明,保乳术后的局部复发大多发生在瘤床周围。因此,加速部分乳腺照射(accelerated partial breast irradiation,APBI)的概念被提出,即使用单次分割更高剂量的射线照射到瘤床周围有限体积的乳房组织,而不是整个乳房,从而缩小照射面积,缩短治疗时间。目前已有多项临床研究针对不同的APBI技术进行了疗效和安全性等方面的评估,包括术中放疗(intraoperative radiation therapy,IORT)、立体定向部分乳腺照射(stereotactic partial breast irradiation,SPBI)、无创图像引导近距离乳腺放疗(non-invasive image-guided breast brachytherapy,NIBB)、术前加速部分乳腺照射(preoperative accelerated partial breast irradiation,PAPBI)和质子加速部分乳腺照射(proton accelerated partial breast irradiation)等,不同技术各具特点。本文将从APBI的照射技术、疗效和安全性等方面进行综述。
1 APBI技术
1.1 近距离放疗
1.1.1 组织间插植 组织间插植是一种多管的近距离放疗,保乳术后在全身麻醉下将多根细针或导管穿过瘤床,在瘤床及其外放1~2 cm的区域进行一至数排置管。放疗总剂量可以采用45~50 Gy的低剂量率或30~34 Gy的高剂量率[7-9]。但组织间插植操作和治疗计划复杂,广泛应用需要更多时间。
1.1.2 Mammosite Mammosite是一种单管球囊近距离放疗装置,有两个内腔,置入乳腺后由一个内腔注入盐水使球囊膨胀填充原瘤腔,经另一个内腔,在球囊的中心置入一个高剂量率放射源。常用的治疗方法是34 Gy/10次,2 次/d[10]。Mammosite设备简单、易于操作,但Mammosite是单导管,剂量分布不能根据手术腔的变化而变化,在瘤腔不规则或肿瘤接近乳腺边缘时不适用。
1.2 外照射
目前早期乳癌保乳术后的APBI外照射技术主要有3D适形放疗(three-dimensional conformal radiotherapy,3D-CRT)、调强放疗(intensity modulated radiation therapy,IMRT)和电子线外照射。外照射在术后实施,可以参考完整的病理结果制定靶区范围和剂量,并可使靶区剂量均匀分布,常用处方剂量为38.5 Gy/10次,每天2次[10-11]或30 Gy/5次,2天1次[12]。
2 APBI疗效和安全性
近期共有7项比较早期乳腺癌保乳术后全乳腺放疗(whole breast irradiation,WBI)和APBI的随机对照研究(表1)。2013年西班牙一项小样本随机对照研究比较了102例分别接受全乳照射或使用3D-CRT进行APBI治疗的早期乳腺癌保乳术后患者,5年的随访结果显示两组的局部复发率、生存率、美容效果和晚期皮肤毒性发生率均无明显差异,但与WBI相比,APBI减少了对健康组织的急性副反应和辐射剂量(P<0.01)[13]。同年,布达佩斯一项随机研究中,130例患者接受全乳照射,128例患者接受组织插植部分乳腺照射,虽然APBI和WBI组的10年局部复发率(5.9%vs5.1%),10年总生存率(80%vs82%),癌症特异性生存率(94%vs92%)和无病生存率(85%vs84%)的差异均无统计学意义,但APBI组显示出了更优良的美容效果(81%vs63%,P<0.01)[14]。之后该研究发布的20年长期随访结果也得出类似的结果[7]。意大利一项Ⅲ期研究将WBI与使用调强放疗技术的APBI进行对比,520例患者随机以1∶1分配到两组,APBI组使用30 Gy/5次的处方剂量,5年和10年的随访结果显示APBI和WBI组的局部复发率和生存率差异不大,其中10年局部复发率分别为2.5%和3.7%(P=0.40),但是APBI组在降低急性、晚期副反应以及美容效果方面优于WBI组[12,15]。GEC-ESTRO是一项非劣性研究(可接受的两组复发率差别为3%),1 184例患者分别接受全乳照射和近距离放疗,5年局部复发率(APBIvsWBI:1.44%vs0.92%,P=0.42)满足非劣性标准,生存率(95.6%vs97.3%,P=0.11)、无病生存率(94.5%vs95.0%,P=0.79)差异均无统计学意义[8]。同时,该研究随后也发布了晚期毒副反应和美容结局报告:在晚期2~3级皮肤副反应方面,APBI组显示出了更好的效果(10.7%vs6.9%,P=0.02);美容效果方面则分别由医师、护士、患者进行评估,3种评价方法均显示两组的美容结局无显著差异[9]。RAPID也是一项非劣性研究(可接受的两组复发率差别为1.5%),2 135例患者分别接受全乳放疗和3D适形APBI[11]。该研究中,8年同侧乳腺复发率(ipsilateral breast tumor recurrence,IBTR)WBI组为2.8%,APBI组为3.0%,符合非劣性标准。但在晚期毒性和美容效果方面,RAPID取得了与其他研究相反的结果:相较于WBI组(142/1 065),晚期毒副反应在APBI组更常见(346/1070,P<0.0001),美容并发症也更常见。研究者认为这可能与每天2次照射导致间隔时间不足以修复致死性损伤有关,而每天1次的照射方案值得探索。最新一项Ⅱ期研究[16]使用tomo-APBI对38.5 Gy/10次、每天1次的分割模式进行了研究,在76个月的中位随访时间中,2例患者出现同侧乳腺复发,局部控制率为99.4%;皮肤的急性毒性发生率为7.7%(1级)和0.6%(2级),晚期毒性发生率为4.4%(1级)和1.1%(2级),未发生3/4级毒性,仅有2%的患者和2%的医师评估美容结局为中等或不良,提示每天1次的分割方案安全可行,但仍需要随机对照试验进一步验证。NSABP B-39/RTOG 0413研究[10]是目前纳入例数(4 216例)最多的一项随机对照研究。该研究采用等效性设计,符合等效性的标准是对于观察到的危险比(HR)、90%CI在0.667至1.500之间。在10年的中位随访时间中,WBI组的IBTR为3.9%,APBI组为4.6%(HR=1.22,90%CI:0.94~1.58)。尽管该结果未达到统计等效性,但两组10年IBTR的绝对差异仅为0.7%,在临床可接受范围内;两组总生存率差异无统计学意义(91.3%vs90.6%,P=0.35),晚期毒性和美容结局亦无明显差异。IMPORT研究纳入了2 018例患者,分成3个治疗队列。然而,与其他研究不同的是,该研究者在WBI和APBI组采用了相同的剂量分割模式,均为40 Gy/15次,且两组均采用场中调强放疗。WBI组使用标准正切光束,而APBI组使用的正切光束,只是在长度上有所减少,宽度没有变化。结果WBI组的5年局部复发率为1.1%(95%CI:0.5%~2.3%),APBI组为0.5%(95%CI:0.2%~1.4%)。满足非劣性标准;且总体生存率差异无统计学意义(95.0%vs96.3%,P=0.693),但APBI相较WBI组可改善急性和晚期毒性,而美容效果方面差异不大[17]。
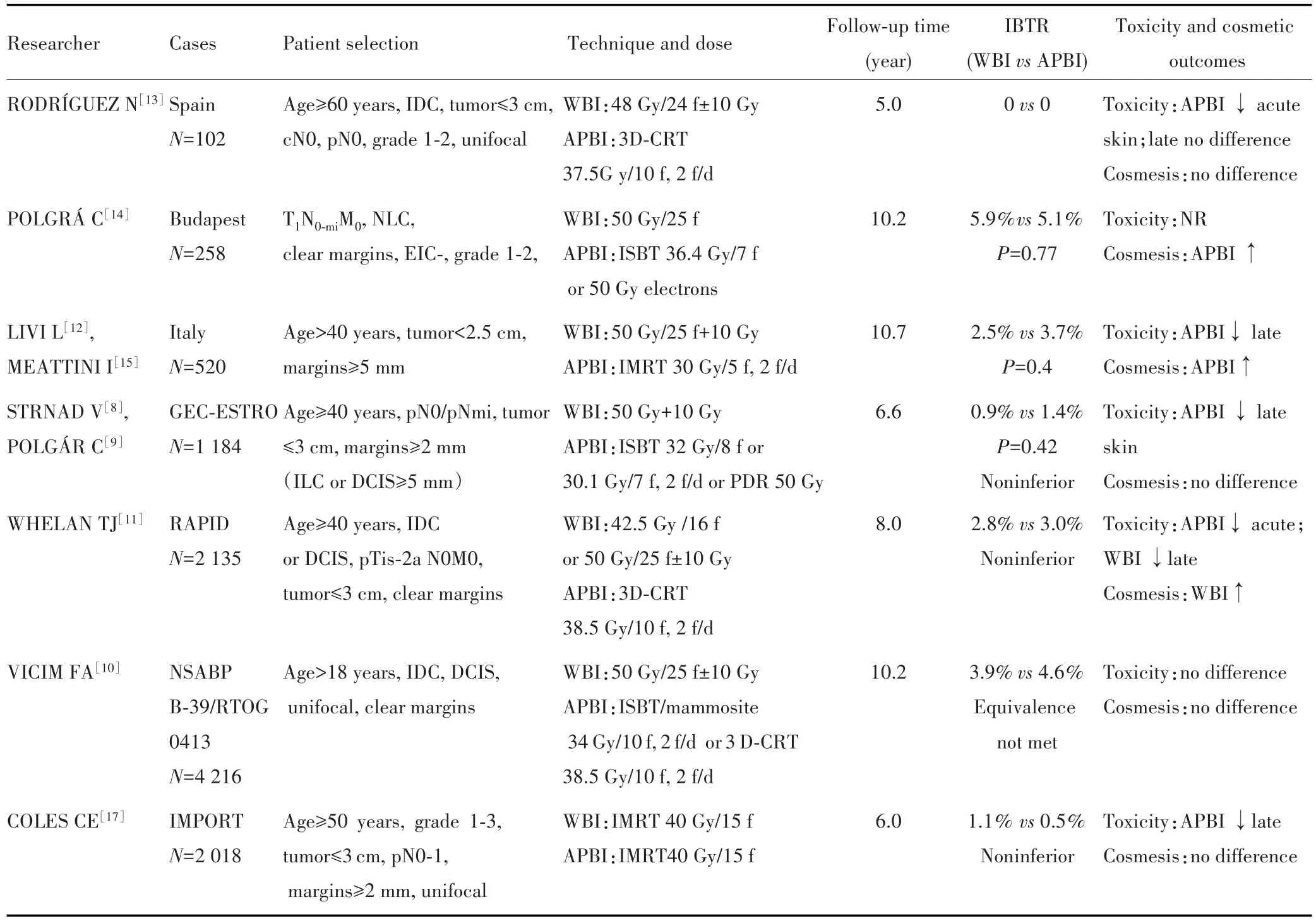
表1 WBI和APBI的随机对照试验对比Tab.1 Randomized controlled trials comparing WBI and APBI
综合以上7个随机对照试验,共10 433例患者入组。就局部控制而言,APBI与WBI相比,无劣势,也无显著的临床差异,5~10年局部复发率的绝对差异在0.2%~0.8%之间。随着这些临床研究的结果公布,2017年ASTRO共识更新了APBI的适用人群:年龄≥50岁,肿瘤大小≤2 cm,切缘宽度≥2 mm,N0期,ER阳性,无脉管侵犯的早期乳腺癌,并且有条件纳入低危乳腺导管内原位癌(钼靶筛查发现,肿瘤大小≤2.5 cm,低中级别,切缘宽度≥3 mm)[18]。
3 新技术的应用
3.1 IORT
术中放疗虽然可以将治疗时间缩短至1 d,但现有证据并不能证明术中放疗在局部控制方面的优势。ELIOT研究纳入了1 305例患者,IORT组患者瘤床接受术中单次剂量21 Gy的电子线照射,5年局部复发率显著高于WBI组(4.4%vs0.4%,P<0.0001),而5年生存率差异无统计学意义(96.8%vs96.9%,P=0.59)[19]。TARGIT-A研究[20]共纳入3 451例患者,研究的主要终点为5年同侧乳腺复发率,IORT组采用直径1.5~5.0 cm的球形施源器,给予瘤床50 kV的X线照射20~45 min,结果显示5年IBTR仍显著高于WBI组(3.3%vs1.3%,P=0.042),而乳腺癌相关死亡率差异无统计学意义(2.6%vs1.9%,P=0.56)。其中,2 298例术前随机、术中放疗和手术同时进行的患者,APBI组和WBI组的5年局部复发率分别为2.11%和0.95%(P=0.28)[21];1 153例术后随机、在术后重新打开瘤床进行术中放疗的患者,APBI组和WBI组的5年局部复发率分别为3.96%和1.05%(P=0.052),提示术中放疗与肿瘤切除手术同时进行更有利于患者[22]。
3.2 SPBI
立体定向放射治疗越来越多地应用于体部肿瘤,通过与MR或CT等影像设备连接,将高剂量射线精准的集中在肿瘤靶区内[23]。LEE[24]和 MÉSZÁROS[25]等研究均应用射波刀进行SPBI,治疗剂量分别为30 Gy/5次和20 Gy/4次,初步结果均表明使用射波刀进行APBI治疗早期乳腺癌安全可行,急性和晚期毒性较轻,并且具有良好的美容效果。RAHIMI等[26]进行的Ⅰ期剂量提升试验采用30.0 Gy、32.5 Gy、35.0 Gy、37.5 Gy和40.0 Gy的5次分割模式研究美容效果的改变情况,结果表明5种剂量模式3年后的美容效果均未发生明显恶化,基线和3年后的美容优良比例分别为86.3%和89.8%,但是目前SPBI入组的例数较少,长期随访数据值得期待。
3.3 NIBB
NIBB通过位于外部并连接到乳房压缩固定板的专用施源器,使用远程定位的后载192Ir高剂量率光源来放射。一项使用NIBB-APBI的Ⅱ期研究纳入40例患者,照射剂量为34 Gy/10次,结果所有患者耐受性均良好,仅3%的患者出现3级急性皮肤反应,未出现3级以上的晚期副反应[27]。这项技术的优势在于可以提供高度精确的治疗,与同样无创的外照射相比,可减少治疗体积。然而由于术后瘤腔大小各异,并不是所有患者都适合这种乳房压缩固定方式。
3.4 PAPBI
PAPBI目前虽然处在研究的早期阶段,但现有研究表明这是一种可行的方法,手术并发症少,美容效果也可观[28-29]。BOSMA等[29]进行的多中心Ⅱ期试验纳入了60岁以上、浸润性单灶乳腺非小叶腺癌133例,术前接受40 Gy/10次或30 Gy/5次的放疗,放疗结束6周后对病灶进行保乳手术。在5年的随访时间内,共18例术后发生并发症(14%),局部复发率为3%,77%(6个月)至82%(5年)的患者对其美容效果“满意”或“非常满意”。
3.5 质子加速部分乳腺照射
质子放疗使用质子束代替经典的光子或X射线束,由于布拉格峰的存在,高剂量的辐射会在到达终点后陡然下降,降低了对远端健康组织的辐射影响,因此在乳腺照射时可以保护远端重要脏器如肺和心脏[30]。一项使用质子加速部分乳腺照射的Ⅱ期试验采用34 Gy/10次,每天2次的分割剂量,中期结果显示,1年和2年的局部控制率和生存率均为100%[31]。但目前质子放疗费用昂贵,其推广和应用需要进一步探索。
4 小结
现有的研究表明,早期乳腺癌保乳术后APBI的局部控制与WBI相比,无劣势也无显著的临床差异。但是总体上,APBI可以缩短治疗时间、减轻治疗压力、降低对正常组织的辐射剂量,因此对于符合指南标准的患者来说,APBI也许是不错的替代选择。目前针对中国人群尚无Ⅲ期APBI数据,治疗时大多参照国外研究成果,选取低危早期乳腺癌患者。就技术选择而言,目前为止,只有近距离放疗和外照射放疗的临床试验有10年结果数据,其他照射技术如SPBI、NIBB、PAPBI和质子加速部分乳腺照射等虽然展示了较好的应用前景,但目前仍处于Ⅰ期或Ⅱ期试验阶段,其临床实际应用还需要进一步的Ⅲ期随机对照试验证据。

