LncRNA SNHG20通过miR-520f-3p调控胆管癌细胞增殖和侵袭
关沧海 刘浪 史武江 王健岗 钟翔宇 姜兴明
胆管癌是胆道系统中常见的恶性肿瘤,根据发生部位的不同主要分为肝内胆管癌和肝外胆管癌两类,据统计胆管癌患者的5年生存率不足30%,其原因包括患者早期症状不明显、肿瘤解剖位置不易获得以及缺乏特异性分子标志物等[1-2]。长链非编码RNA(long non-coding RNA,lncRNA)是一类大于200个核苷酸的几乎不能编码蛋白的转录本,微小RNA(microRNA,miRNA)是一种长度为 20~24个核苷酸的小单链非编码RNA。目前许多lncRNA和miRNA已被证明在肿瘤的发生发展中发挥重要作用[2-5]。其中lncRNA小核仁RNA宿主基因20(small nucleolar RNA host gene 20,SNHG20)最早在肝细胞癌研究中被发现[6]。而miR-520f-3p是一种肿瘤相关miRNA,目前已被证实在胶质瘤和肝癌中发挥抑癌作用[7-8],但是在胆管癌中 SNHG20 和 miR-520f-3p的关系及其临床价值和生物学作用尚未阐明。本研究探讨lncRNA SNHG20和miR-520f-3p对胆管癌细胞增殖和侵袭能力的调控及机制,以期为胆管癌诊断和治疗提供新思路。
1 材料与方法
1.1 主要材料与仪器
收集哈尔滨医科大学附属第二医院2012年3月至2014年3月收治的20例胆管癌患者肿瘤组织及相应癌旁正常组织,所有组织均经病理学诊断。所有患者术前均未接受放化疗。本研究经哈尔滨医科大学附属第二医院伦理审查委员会批准,研究对象知情同意。
人正常胆管上皮细胞系HIBEC和胆管癌细胞系CCLP-1、QBC939、RBE、TFK-1购自中国科学院上海生命科学研究院细胞资源中心;胎牛血清、DMEM培养基、TRIzol试剂盒和LipofectamineTM3000均购自美国 Invitrogen 公司;si-NC、si-SNHG20、miR-NC、miR-520f-3p mimics、inh-NC和 miR-520f-3p inhibitor由上海吉玛制药技术有限公司合成;cDNA逆转录试剂盒和SYBR Green Master mix试剂盒购自瑞士Roche公司;双荧光素酶报告基因试剂盒和CCK-8试剂盒购自美国Promega公司。
1.2 细胞培养和转染
胆管癌细胞 CCLP-1、QBC939、RBE、TFK-1和胆管上皮细胞HIBEC在37℃、5%CO2条件下,用含10%胎牛血清的DMEM培养基进行培养,培养至70%汇合度时进行传代培养(传代时间不超过6个月)。转染前将胆管癌细胞CCLP-1接种于6孔板中,待细胞融合度达40%~50%时,按照LipofectamineTM3000转染试剂说明书的方法分别将 si-SNHG20、si-NC、miR-520f-3p mimics、miR-NC、miR-520f-3p inhibitor和 inh-NC转染至 CCLP-1 细胞。转染后继续培养24 h,取对数生长期细胞进行后续实验。
1.3 qRT-PCR检测基因表达
用TRIzol试剂盒提取上述细胞的总RNA,并通过逆转录试剂盒将RNA反转录成cDNA,然后用SYBR Green Master mix试剂盒和C1000热循环仪进行qRT-PCR实验,选取GAPDH和U6分别作为SNHG20和miR-520f-3p的内参。引物序列如下:SNHG20上游为 5'-ATGGCTATAAATAGATACACGC-3',下游为 5'-GGTACAAACAGGGAGGA-3';miR-520f-3p上游为5'-GCCGAGAAGTGCTTCCTTTTA -3',下游为5'-CT-CAACTGGTGTCGTGGA-3';GADPH 上游为 5'-GGG-AGCCAAAAGGGTCAT-3',下游为 5'-GAGTCC-TTC-CACGATACCAA-3';U6上游为5'-GCTTCGGCAGCA-CATATACTAAAAT-3',下游为 5'-CGCTTCACGAATT-TGCGTGTCAT-3'。PCR扩增条件:95 ℃ 10 min,95 ℃12 s,60 ℃ 30 s,72 ℃ 30 s,共40个循环。所有检测均在96孔板进行,每个样本设3个平行孔,实验重复3次。实验结果采用2−△△Ct法对目的基因进行表达量相对定量分析。
1.4 CCK-8法检测细胞增殖能力
将转染后呈对数生长期的各组细胞,用胰酶消化后以1 000/孔接种于96孔板中,每组5个复孔,分别在0 h、24 h、48 h和72 h时向每孔加入10 μL的CCK-8溶液,继续培养4 h,然后利用酶标仪检测450 nm波长处的吸光度(A)值,评价细胞的增殖能力。
1.5 平板克隆实验检测细胞克隆形成能力
将转染后的细胞制成细胞悬液并进行细胞计数,以400/孔的浓度接种至6孔板中,加入完全培养基至2 mL后摇匀。培养14 d后,用多聚甲醛固定30 min,结晶紫溶液染色30 min,然后拍照、计数,观察各组细胞的克隆形成能力。
1.6 划痕实验检测细胞的迁移能力
将5×105个转染相应载体的CCLP-1细胞接种至6孔板,细胞融合度达90%后,用直尺和枪头在板中划线,用PBS洗3次后加入无血清培养基。分别在培养0 h和24 h时用荧光倒置显微镜观察划痕距离。
1.7 Transwell实验检测细胞侵袭能力
预先在Transwell小室上层铺一层Matrigel基质膜,将转染后浓度为1×105/mL的细胞悬液(200 μL)接种于Transwell上室,并在下室加入800 μL含10%血清的培养基。继续培养24 h,取出小室并用棉签轻轻擦去上室残留的细胞,甲醛固定30 min,0.1%的结晶紫染色30 min,再利用倒置显微镜(×100)观察侵袭细胞,3个复孔均随机选择3个视野进行拍照与计数。
1.8 双荧光素酶报告基因实验检测SNHG20和miR-520f-3p 的靶向作用
利用在线数据库StarBase预测SNHG20与miR-520f-3p 的互补位点,对 SNHG20 与 miR-520f-3p的结合序列以及突变后的序列片段进行扩增,并将扩增后的片段分别插入到荧光素酶报告基因质粒中,从而构建SNHG20野生型(WT-SNHG20)和突变型(MUT-SNHG20)表达载体。取CCLP-1细胞接种至96孔板中,再利用LipofectamineTM3000分别将野生型和突变型SNHG20的双荧光素酶报告基因质粒与 miR-520f-3p mimics和 NC mimics共转染至呈对数生长期的CCLP-1细胞,每组3个复孔。按照试剂盒说明书的方法培养48 h,然后检测每孔相对应的荧光素酶活性。
1.9 统计学方法
采用SPSS 22.0软件对数据进行统计分析。计量资料以均数±标准差(±s)表示。采用配对t检验比较SNHG20和miR-520f-3p在肿瘤组织和癌旁正常组织的表达水平;单因素方差分析SNHG20和miR-520f-3p在不同胆管癌细胞中的表达情况,若组间差异有统计学意义,进一步的多重比较采用Tukey检验;两组独立样本均数的比较采用独立样本t检验。以双侧P<0.05表示差异有统计学意义。
2 结果
2.1 胆管癌组织和细胞系中SNHG20和miR-520f-3p的表达
qRT-PCR检测结果显示,相较于癌旁正常组织,SNHG20在胆管癌组织中明显高表达(1.567±0.755vs3.195±1.529,t=4.014,P=0.002),miR-520f-3p 呈低表达(3.202±0.862vs1.605±1.019,t=3.826,P=0.003),见图1A~B。与正常胆管上皮细胞系HIBEC相比,胆管癌细胞系CCLP-1、QBC939、RBE、TFK-1中SNHG20呈高表达,其中CCLP-1细胞的表达最高(t=26.482,P=0.004);而 miR-520f-3p在胆管癌细胞系的表达水平明显降低,其中CCLP-1细胞的表达最低(t=19.464,P=0.023),见图1C~D。因此,选择CCLP-1进行后续实验。
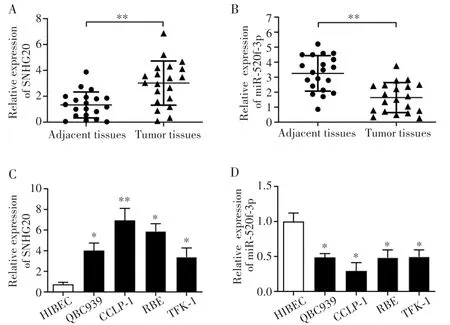
图1 SNHG20和miR-520f-3p在胆管癌组织和细胞系中的表达Fig.1 Expression of SNHG20 and miR-520f-3p in cholangiocarcinoma tissues and cell lines
2.2 敲低SNHG20能抑制胆管癌CCLP-1细胞的增殖能力
qRT-PCR检测结果显示,si-SNHG20组CCLP-1细胞中SNHG20的表达水平低于si-NC组(t=16.253,P=0.029),见图2A。CCK-8 实验结果显示,与 si-NC组比较,si-SNHG20 组CCLP-1细胞在72 h时的细胞增殖能力明显降低(t=14.683,P=0.035),见图2B;平板克隆实验结果显示,si-SNHG20组细胞克隆数量减少(t=12.936,P=0.002),见图2C。
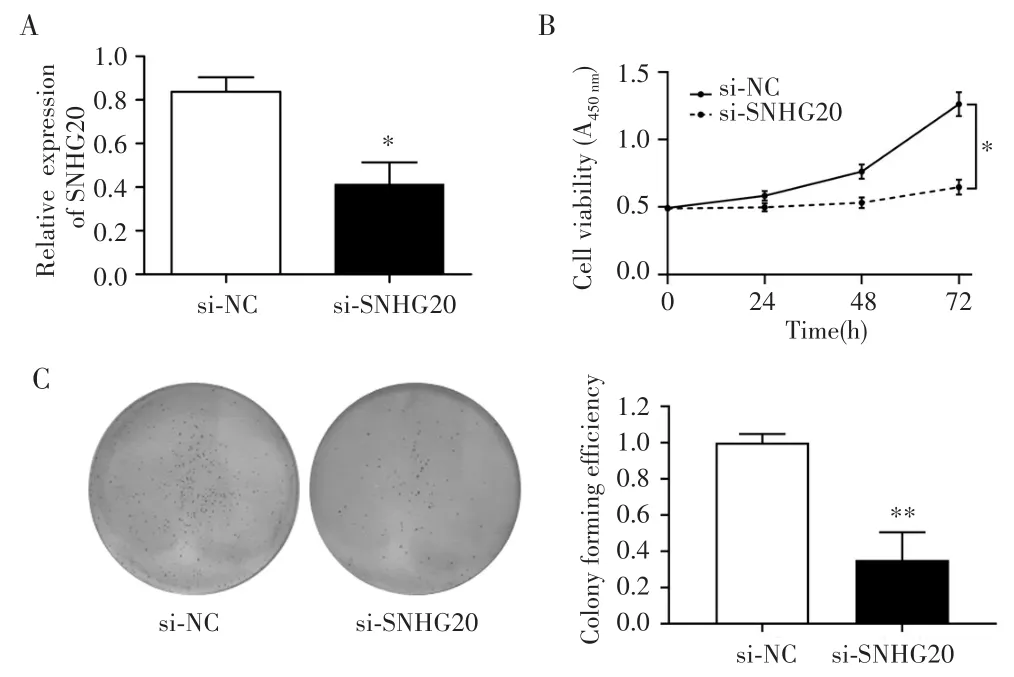
图2 敲低SNHG20对胆管癌CCLP-1细胞增殖能力的影响Fig.2 Effect of knocking down SNHG20 on the proliferation of cholangiocarcinoma CCLP-1 cells
2.3 敲低SNHG20能减弱胆管癌CCLP-1细胞的迁移和侵袭能力
划痕处理24 h后,与si-NC组比较,si-SNHG20组CCLP-1细胞迁移能力降低(t=6.356,P=0.026),见图3A。Transwell实验结果显示,与 si-NC 组比较,si-SNHG20组CCLP-1细胞侵袭能力明显减弱(t=7.845,P=0.032),见图3B。
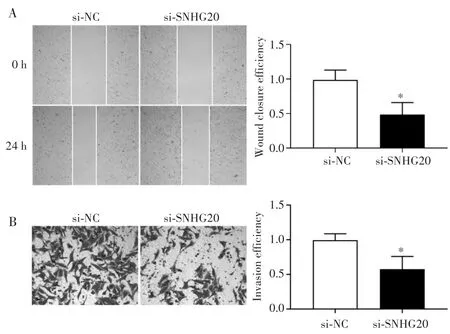
图3 敲低SNHG20对胆管癌CCLP-1细胞迁移和侵袭能力的影响Fig.3 Effect of knocking down SNHG20 on the migration and invasion of cholangiocarcinoma CCLP-1 cells
2.4 SNHG20靶向调控miR-520f-3p
在线数据库StarBase预测结果显示,SNHG20和miR-520f-3p存在相同的结合序列,见图4A;敲低SN-HG20后,miR-520f-3p在CCLP-1细胞中的表达明显升高(t=11.633,P=0.048),见图 4B;双荧光素酶报告基因实验结果显示,共转染 miR-520f-3p mimics和WT-SNHG20的CCLP-1细胞的荧光素酶活性显著降低(t=15.424,P=0.031),见图4C。
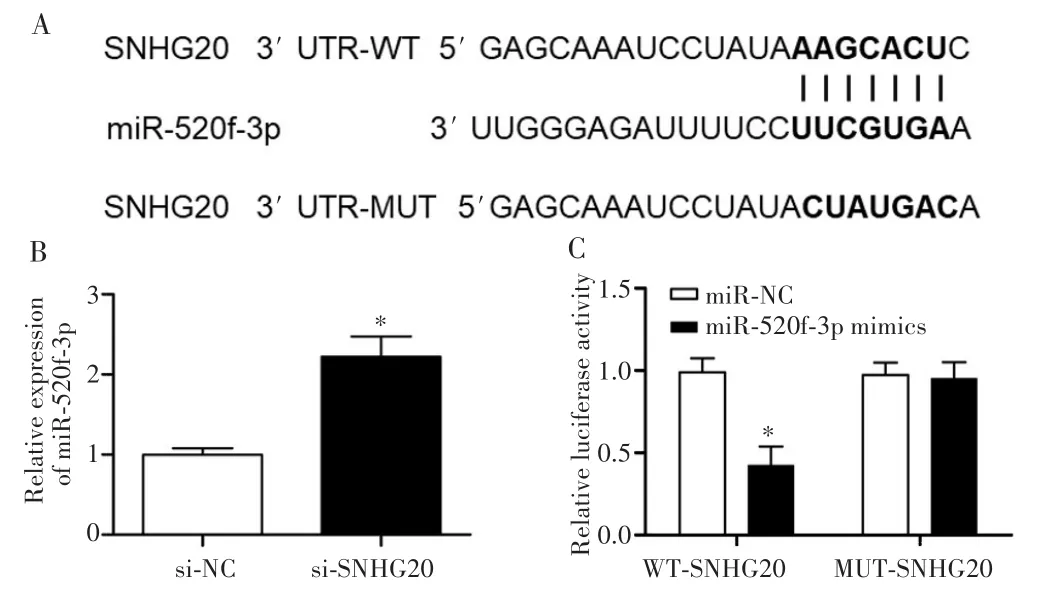
图4 SNHG20调控miR-520f-3p的表达Fig.4 SNHG20 regulated the expression of miR-520f-3p
2.5 沉默miR-520f-3p可逆转敲低SNHG20对CCLP-1细胞增殖和侵袭的抑制作用
qRT-PCR检测结果显示,与si-NC+inh-NC组相比,共转染si-SNHG20+inh-NC后miR-520f-3p的表达明显升高(t=13.631,P=0.042);而相比于si-SNHG20+inh-NC 组,si-SNHG20+inh-miR-520f-3p 组 CCLP-1细胞中 miR-520f-3p的表达明显受抑制(t=12.875,P=0.047),见图5A。CCK-8和Transwell侵袭实验结果显示,与 si-NC+inh-NC 组相比,共转染 si-SNHG20+inh-NC后CCLP-1细胞的增殖活力以及侵袭能力明显降低(t=8.461,P=0.017;t=13.431,P=0.027);而敲低miR-520f-3p则可以逆转下调SNHG20对CCLP-1细胞增殖和侵袭的抑制作用(t=10.533,P=0.002;t=8.683,P=0.037),见图5B~C。
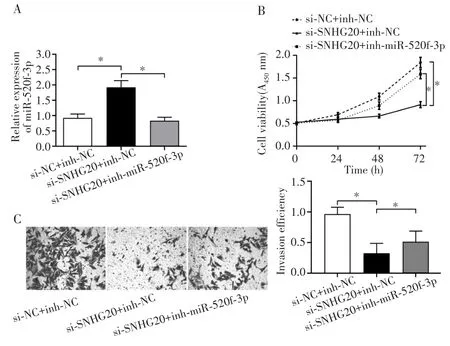
图5 SNHG20通过调控miR-520f-3p影响胆管癌细胞的增殖和侵袭Fig.5 SNHG20 influenced the cells proliferation and invasion of cholangiocarcinoma by regulating miR-520f-3p
3 讨论
手术切除是目前治疗胆管癌最有效的手段,但大多数胆管癌患者直到晚期才被发现,难以通过手术进行根治。因此,探索胆管癌发生发展的分子生物学机制以及有效的分子标志物十分必要。lncRNA在肿瘤发生和发展中具有重要作用,其中lncRNA SNHG20在多种肿瘤中异常高表达并通过多种调控机制发挥促癌作用[9-12]。例如,高表达SNHG20能够激活Wnt/β-catenin或EMT信号通路促进非小细胞肺癌和卵巢癌的恶性生物学行为,通过内源性竞争机制吸附miR-495和miR-6516-5p方式分别加快乳腺癌和前列腺癌肿瘤细胞的增殖、侵袭迁移[13-16]。此外,miRNA在肿瘤的发生发展过程中也起到重要作用。例如,miR-520f-3p在胶质瘤中通过抑制下游转录因子TFAP4的表达从而发挥抑癌作用[7]。在肝癌细胞中转录因子AR通过调控miR-520f-3p/SOX9而影响肝癌细胞的恶性生物学行为[8]。本研究首先检测SNHG20和miR-520f-3p在胆管癌组织和细胞中的表达,发现不管在胆管癌组织或胆管癌细胞中SNHG20和miR-520f-3p均呈异常表达,其中SNHG20呈高表达而miR-520f-3p呈低表达。进一步选择表达差异最明显的CCLP-1细胞进行功能实验,发现抑制SNHG20表达能够限制CCLP-1细胞的恶性生物学行为,包括增殖、迁移和侵袭能力。既往研究发现,lncRNA可以与下游mRNA竞争性结合miRNA,miRNA也能直接结合lncRNA或通过影响相关转录因子的表达间接调控lncRNA,从而加快或减慢肿瘤的发生发展[17]。因此,本研究通过生物信息网站预测,发现SNHG20与miR-520f-3p存在相同的结合位点,miR-520f-3p过表达可降低携带 WT-SNHG20细胞的荧光素酶活性,而敲低SNHG20可使CCLP-1细胞中miR-520f-3p表达升高,说明SNHG20可靶向调控miR-520f-3p的表达。本研究进一步通过挽救实验证实外源性敲低miR-520f-3p可以逆转沉默SNHG20对CCLP-1细胞增殖和侵袭的抑制作用。
综上所述,本研究结果表明SNHG20在胆管癌中呈高表达,SNHG20对胆管癌细胞增殖和侵袭的促进作用与其靶向结合并下调miR-520f-3p表达有关。然而本研究局限于体外细胞学水平,SNHG20/miR-520f-3p调控胆管癌细胞增殖的上下游分子机制仍需进一步探索和研究。

