高肺转移人源骨肉瘤细胞系的建立及鉴定
支文兰 常君丽 胡少朴 王晓波 赵福来 孙星媛 马小平 杨燕萍
骨肉瘤是儿童和青少年最常见的原发性恶性骨肿瘤,主要起源于长骨干骺端,具有恶性度高、早期易转移和死亡率高等特点[1]。新辅助化疗联合保肢术治疗可使无转移骨肉瘤患者5年生存率达70%[2],但肺转移患者的5年生存率仍不足30%[3]。然而,20%的骨肉瘤患者确诊时已存在肺转移,且90%有微转移灶[4-5],因此即使手术也仍有80%的患者发生复发转移[6]。由此可见,探索骨肉瘤发生肺转移的机制,从而有效控制肺转移是提高骨肉瘤患者生存率的关键[7]。本研究以人源骨肉瘤143B细胞为亲本细胞,采用GFP和荧光素酶标记143B细胞后注射到4周龄BALB/c裸鼠胫骨内,建立胫骨内原位注射肺转移瘤模型,同时建立了一株具有高度肺转移能力的骨肉瘤细胞亚系143B-HLM,为后续探索骨肉瘤肺转移发生机制提供了实验基础。
1 材料与方法
1.1 主要试剂及仪器
MEM细胞培养基、胎牛血清(FBS)、胰蛋白酶、青霉素-链霉素购自美国Gibco公司;二甲基亚砜(DMSO)、新霉素(G418)购自美国Sigma公司;磷酸盐缓冲液(PBS)购自瑞典Medicago公司;RIPA裂解液、SDS-PAGE凝胶配制试剂盒、BCA蛋白浓度测定试剂盒、HRP-标记山羊抗兔IgG、HRP-标记山羊抗鼠IgG购自碧云天公司;波形蛋白(Vimentin)、锌指转录因子(Slug)、β-actin抗体购自英国Abcam公司;荧光显微镜购自日本Olympus公司;pENTER-EGFP质粒、plv-lu-ciferase荧光素酶质粒购自美国Genomeditech公司;小动物生物发光活体成像系统购自美国Perkin Elmer公司;xCELLigenceRTCADP实时细胞分析仪购自德国Roche公司;称重仪、游标卡尺购自上海精密科学仪器有限公司。
1.2 细胞系来源与培养
人源骨肉瘤细胞系143B(ATCC®CRL-8303TM)购自美国ATCC公司细胞库,用含10% FBS、100 U/mL青霉素和100 μg/mL链霉素的MEM培养基,在37℃、5% CO2培养箱中培养。
1.3 动物来源与饲养
本实验使用的4周龄、雄性裸鼠(BALB/c-nude)购于杭州子源实验动物科技有限公司[许可证号:SCXK(浙)2019-0004],共12只,每组6只。动物实验获上海中医药大学动物管理和委员会批准,符合实验动物伦理规范(动物伦理批号:PZSHTCM200731014),严格按照国际实验动物相关要求进行实验。所有裸鼠均饲养于上海中医药大学实验动物中心SPF级饲养室。
1.4 质粒转染与抗性筛选
将250µL无血清无抗生素MEM培养基分别与5 μg pENTER-EGFP 质粒、plv-luciferase荧光素酶质粒混合,同时将250 μL无血清无抗生素MEM培养基与3 μL LipofectamineTM2000混合 5 min,静置15 min后,加入在6孔细胞培养板中常规培养24 h的143B细胞,分别转染72 h后弃去含转染试剂的培养基,用无菌PBS冲洗2遍、经胰蛋白酶消化后将细胞接种到100 mm细胞培养皿中,加入含300 μg/mL G418的筛选培养基,每天观察细胞状态,2~3 d更换1次新鲜筛选培养基,直至除去所有G418阴性细胞,然后更换含低浓度G418的培养基维持培养,常规传代。
1.5 建立143B细胞胫骨内原位注射肺转移瘤模型
收集处于对数生长期、细胞融合度约为80%的GFP和荧光素酶标记的143B细胞,重悬到MEM培养基并与Matrigel胶按1∶1的比例均匀混合,制成浓度为1×107/mL的细胞悬液。取10 μL注射到裸鼠的左侧胫骨内,建立胫骨内原位注射肺转移瘤模型。6周后以颈椎脱臼法处死裸鼠,分离原位瘤体及肺转移瘤体。
1.6 小动物生物发光活体成像系统实时监测原位及肺转移瘤生长
接种骨肉瘤细胞6周后,用生理盐水稀释的D-荧光素钾盐(15 mg/kg)注射至腹腔15 min后,吸入异氟烷气体麻醉裸鼠,用小动物生物发光活体成像系统观察胫骨内原位注射骨肉瘤肺转移瘤模型中原位及肺转移骨肉瘤的生长状况,采用Xenogen Bioluminescent Images V2.50.1软件定量分析肿瘤体积。
1.7 肺转移结节分离与G418阳性细胞筛选
将GFP和荧光素酶标记的143B细胞接种于裸鼠胫骨内,6周后,用小动物生物发光活体成像系统观察确认裸鼠模型原位肿瘤形成,同时遮盖原位肿瘤的荧光信号,确认裸鼠模型出现明显的肺转移结节。出现明显肺转移结节后处死裸鼠,解剖分离整体肺,在显微镜的明视场及荧光下对肺组织中的骨肉瘤转移结节进行机械分离。切碎后用预冷的无菌PBS冲洗3次,胶原酶A(1 mg/mL)于37 ℃下消化30 min,加入0.025%胰蛋白酶继续在37℃中消化20 min,制备单细胞悬液,离心保留细胞沉淀,并接种于含G418的完全培养基,然后进行抗性筛选和扩增。以同样的方法再次接种于裸鼠胫骨内,经分离、筛选和扩增,将经过2次体内循环获得的细胞命名为143B-HLM,详细操作流程见图1。
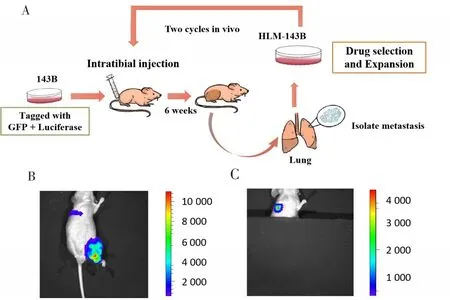
图1 建立高肺转移骨肉瘤细胞系143B-HLM的流程示意图Fig.1 Flowchart of the process of establishing a high lung metastasis osteosarcoma cell line 143B-HLM
1.8 xCELLigence RTCADP多功能实时无标记细胞分析仪检测细胞迁移能力
在xCELLigenceRTCADP实时细胞分析仪匹配的CIM-Plate板下室按 165 μL/孔添加细胞趋化液(含10%FBS的完全培养基),上室按40 μL/孔添加无血清培养基,组装上下室,37℃孵育30 min平衡后,将100 μL用无血清培养基重悬的细胞(2×105/mL)接种到上室,室温静置30 min后上机进行实时检测。
1.9 Western blot检测蛋白表达
采用预冷的PBS冲洗在10 cm细胞培养皿贴壁生长的143B及143B-HLM细胞2次,每个培养皿加入500 μL的RIPA裂解液,在冰上裂解20 min后,提取总蛋白质,并用BCA法检测蛋白质浓度。将等质量(20 μg)蛋白质与上样缓冲液按1∶1比例混匀后,在100℃下变性5 min,经SDS-PAGE凝胶电泳分离后转膜90 min。用快速封闭液封闭15 min,加入一抗Vimentin(1∶1 000)、Slug(1∶1 000)、β-actin(1∶2 000),4℃孵育过夜。次日,TBST洗膜3次(5 min/次),加入二抗HRP-标记山羊抗兔IgG、HRP-标记山羊抗鼠IgG,室温孵育1 h,TBST洗膜3次(5 min/次)。按1∶1比例配制ECL显影液,在Bio-rad成像分析仪上曝光,分析蛋白质条带。
1.10 RT-qPCR检测目的基因mRNA的相对表达量
采用TRIzol法提取细胞总RNA后,紫外分光光度计检测RNA浓度,按照37℃15 min、85℃5 min的逆转录反应逆转录成cDNA,于4℃下保存。以cDNA产物为模板,进行PCR扩增,引物序列见表1。PCR反应体系(20 μL):4 μL 5×Buffer,1 μL Enzyme mix,1 μL OligdT primer,1 μL Random primer,1.4 μL RNA(total),11.6 μL DEPC。PCR反应条件:95 ℃ 3 min,95℃10 s,60℃30 s,共40个循环。以GAPDH为内参,采用2−△△Ct法计算目的基因mRNA的相对表达量。

表1 RT-qPCR引物序列Tab.1 Primer sequences for RT-qPCR
1.11 统计学方法
采用SPSS 24.0软件进行统计分析,符合正态分布且方差齐时,两组均数比较采用独立样本t检验,以双侧P<0.05为差异有统计学意义。
2 结果
2.1 143B-HLM细胞对裸鼠体内骨肉瘤生长的影响
为检测143B-HLM细胞对体内骨肉瘤生长的影响,收集处于对数生长期的143B细胞和143B-HLM细胞,在裸鼠胫骨髓腔内注射骨肉瘤细胞(1×105个/只)制备胫骨内原位注射肺转移瘤模型,造模第2天开始每周测量1次肿瘤体积与裸鼠体重,42 d后将所有裸鼠安乐死。研究结果显示,注射143B-HLM细胞的裸鼠肿瘤体积较注射143B细胞的裸鼠明显减小(t=3.889,P=0.007,图2A~B),但裸鼠体重未受明显影响(t=1.109,P=0.30,图2C),且两组裸鼠均无死亡现象。

图2 143B-HLM细胞对裸鼠体内骨肉瘤生长的影响Fig.2 Effect of 143B-HLM cells on the growth of osteosarcoma in vivo
2.2 143B-HLM细胞在体内的肺转移能力增强
在荧光显微镜下观察解剖离体肺,确定每组裸鼠肺转移结节生长情况。结果显示,与143B细胞制备的肺转移瘤模型比较,143B-HLM细胞制备的裸鼠模型肺部GFP荧光信号增强(图3A);荧光显微镜下,平均肺转移结节的荧光信号强度显著增高(t=4.172,P=0.002,图3B),肺转移的裸鼠数目也高于143B细胞组,其中注射143B-HLM细胞的裸鼠肺转移率为100%,143B组的肺转移率为66.67%(图3C)。
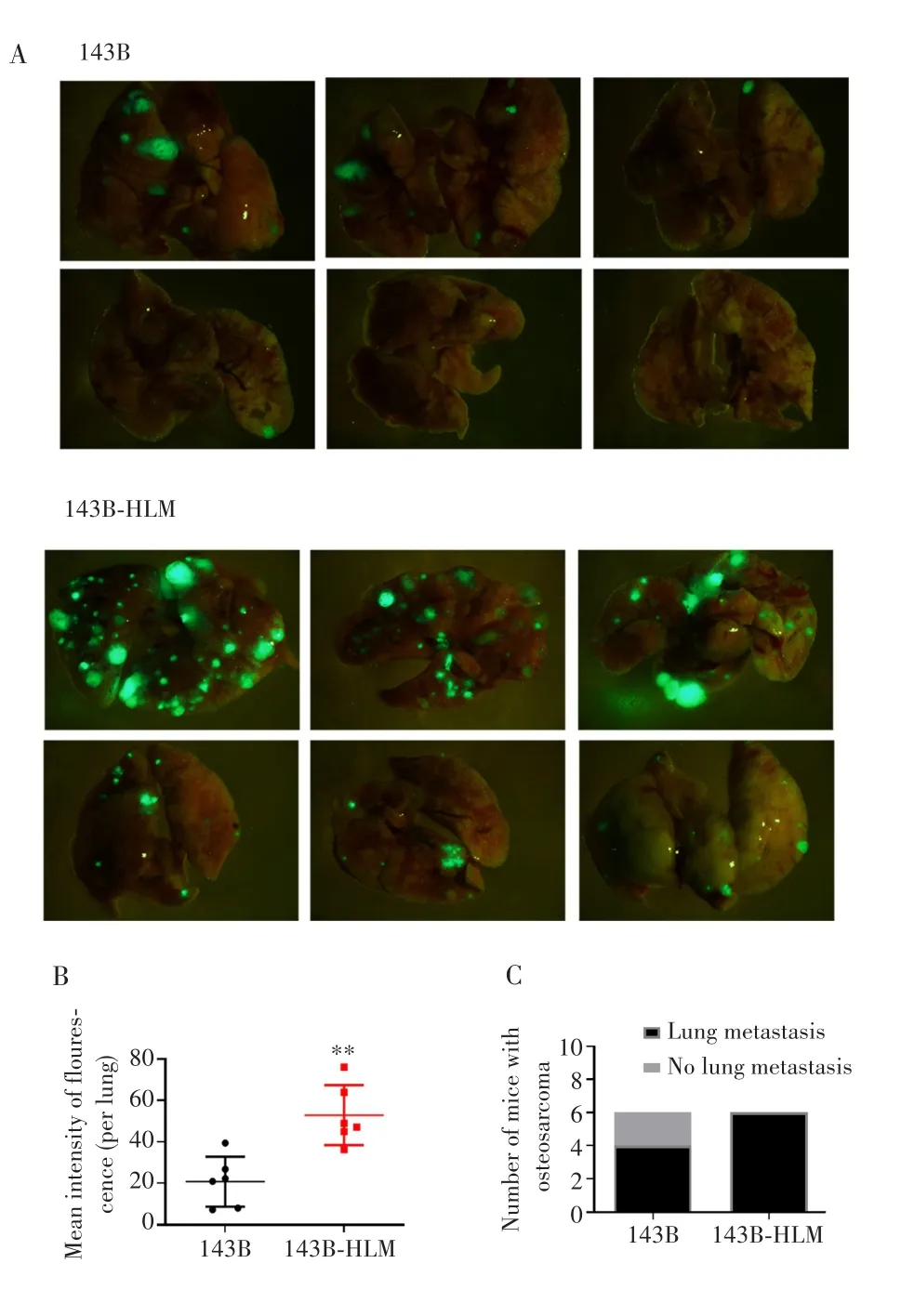
图3 倒置荧光显微镜下观察离体肺GFP标记的骨肉瘤细胞转移情况Fig.3 Metastasis of GFP-labeled osteosarcoma cells in isolated lung observed by inverted fluorescence microscopy
2.3 143B-HLM细胞在体外的迁移能力增强
xCELLigence实时细胞仪监测结果(图4)显示,与143B细胞相比,143B-HLM细胞的体外迁移能力显著增强。Westernblot实验(图5)显示,143B-HLM细胞中Vimentin(t=4.376,P=0.008)和Slug(t=1.376,P=0.032)的蛋白表达量高于143B细胞。RT-qPCR实验(图6)结果显示,143B-HLM细胞中Vimentin(t=15.410,P=0.001)、Slug(t=4.467,P=0.001)、Snail(t=3.799,P=0.004)和Survivin(t=2.806,P=0.017)的 mRNA 表达量均高于143B细胞。
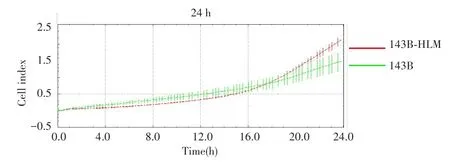
图4 xCELLigence实时细胞仪监测细胞迁移能力Fig.4 Cells migration ability detected by xCELLigence real-time cytometry monitoring

图5 Western blot检测细胞中Vimentin和Slug蛋白表达量Fig.5 Protein expression of Vimentin and Slug detected by Western blot

图6 RT-qPCR检测细胞中Vimentin、Snail、Slug和Survivin的mRNA表达量Fig.6 The mRNA expression of Vimentin,Snail,Slug and Survivin detected by RT-qPCR
3 讨论
骨肉瘤是一种原发性恶性骨肿瘤,大约20%的病例表现出微转移或远端转移肿瘤,其中最常见的是肺转移[8]。因此,对骨肉瘤肺转移发病机制的研究备受关注[9],而建立具有高肺转移能力的人骨肉瘤细胞系,有助于揭示骨肉瘤肺转移的发生机制。目前已有此类细胞,如K7M2和 K12细胞[10-15]。但是 K7M2和K12细胞都是小鼠源的骨肉瘤细胞系,并不能真实反映人体中的病理状态。相比之下,人骨肉瘤细胞系能更好地反映骨肉瘤患者的临床特征,也更有利于研究结果临床转化应用。既往研究显示,相较于其他人骨肉瘤细胞株MNNG、HOS及TE85,143B细胞株表现出最强的增殖迁移能力,且143B细胞致瘤性和转移性较高,但143B细胞的异种移植动物模型的转移率仅为50%[16]。也有研究通过骨肉瘤细胞与间充质干细胞共培养体系诱导获得具有高迁移能力的骨肉瘤细胞系,并且在体外实验中证实该细胞系的迁移能力显著增强,但在体内实验中的效果仍不稳定[17]。
本研究建立了一株具有高肺转移能力的人源骨肉瘤细胞系143B-HLM。通过体内外检测发现,与注射亲本143B细胞的裸鼠相比,注射143B-HLM细胞的裸鼠更容易形成自发性肺转移,肺转移结节数也更多。此外,与以往研究的小鼠细胞系或转化的人骨肉瘤细胞系的动物模型相比,本研究通过体内循环筛选的自发性肺转移143B-HLM细胞构建的异种移植模型还可以显著影响细胞系中的上皮间质转化(EMT)相关基因及蛋白的表达。EMT是恶性肿瘤细胞发生的特征性“移行态”表现,是正常上皮细胞转化为具有间质表型细胞的生物学过程[18]。EMT通过介导细胞迁移和浸润相关基因表达如Vimentin、Snail、锌指转录抑制因子(Slug)和调亡抑制基因(Survivin)等,使细胞迁移能力及浸润能力表型增强,最终导致肿瘤发生转移[19]。EMT还是恶性肿瘤发生转移级联反应的初始触发因子,在恶性肿瘤转移过程中发挥着至关重要的作用。为此,本研究进一步检测了143B-HLM细胞中迁移和浸润相关分子标志物的表达,结果显示Vimentin、Snail、Slug和 Survivin在 143B-HLM 细胞中的表达水平均升高,推测这些表型的改变可能使143B-HLM细胞获得比143B细胞更容易发生肺转移的能力。
综上所述,人骨肉瘤肺转移细胞通过在裸鼠体内循环筛选及分离后,再经胫骨内原位注射建立的肺转移人源骨肉瘤细胞系具有较好的肺转移能力,可为探索骨肉瘤肺转移发生机制提供有效的细胞模型,同时为探索骨肉瘤肺转移早期诊断、预防和治疗新的分子靶标奠定基础。

