高通量生物信息学分析对经皮冠状动脉介入术后支架内再狭窄过程核心发病基因以及通路的预测①
蔡 睿 王维铁
(吉林大学临床医学院,长春130021)
2017年中国疾病负担研究报告显示缺血性心脏病是我国排名第二位的导致人群寿命损失的疾病,死亡率大约为123.9/10万,占总死亡人数的16.7%[1]。目前经皮冠状动脉介入(percutaneous coronary intervention,PCI)是治疗缺血性心脏病的一种主要手段,但是PCI术后支架内再狭窄(instent restenosis,ISR)成为了影响远期生存率的一种主要并发症[2]。有研究指出,新生内膜增生是ISR发生的主要病理改变[3],但针对支架内新生内膜增生治疗并未达到预期的效果[4]。因此ISR分子发病机制及基因靶向治疗需要继续探索。本研究通过基因测序及高通量生物信息学分析的方法对PCI术后ISR的机制进行研究,以期寻找到ISR发病的核心基因及分子通路,为后续的血清学诊疗标志物及药物治疗靶点提供理论依据。
1 材料与方法
1.1 基因测序对象与分组 GEO数据库搜索与PCI术后ISR相关的基因测序结果,选取GSE46560为研究对象(11例印度人样本)。其中6例PCI术后ISR患者作为研究组,5例PCI术后支架内未狭窄的患者作为对照组。其中研究组男性5例,女性1例,平均年龄为(60.33±16.10)岁。对照组男性4例,女性1例,平均年龄为(60.40±10.53)岁。Trizol法提取全部患者空腹外周血RNA,然后检测RNA的质量和纯度,其中纯度的检测标准为1.8≤260/280≤2.1。将符合标准的RNA进行基因测序,测序结果详见GEO数 据 库(GSE46560,https://www.ncbi.nlm.nih.gov/geo/query/acc.cgi?acc=GSE46560)。
1.2 高通量生物信息分析方法 对基因测序的原始数据采用R语言及limma数据包进行均一化校准,删除差异表达量过大或者过小的基因。其后应用GEO2R计算模块筛选差异基因。对筛选的差异基因应用GraphPad Prism 7绘制火山图进行可视化处理,其后应用基因热图在TBtools软件进行聚类分析。将全部差异基因应用DAVID在线软件进行基因符号转换及KEGG信号通路的预测。全部差异表达基因符号输入蛋白互作网络(PPI)在线分析软件,进行基因互作关系预测,并将预测结果输入Cyto‐scape软件进行可视化处理。对全部差异基因间的互作关系进一步生物信息学分析,应用cytohubba软件(Cytoscape内置应用)预测核心发病基因,对排名前10位的发病基因再次进行聚类分析,根据Degree评分筛选出分数最高的基因。
1.3 统计学方法 所有原始数据用R语言软件进行分析。差异基因筛选标准位差异倍数≥2以及P<0.05为差异有统计学意义。KEGG信号通路富集基因最少为2且P<0.05。PPI筛选标准为基因间联系>0.4。
2 结果
2.1 基因测序原始数据矫正 对总共49395个编码基因进行检测,原始数据结果均一性较差(图1A)。随后应用R语言及limma包进行数据均一化处理,筛除离散度较大的数据,校准后的数据均一性较好(图1B)。

图1 基因芯片原始数据分析Fig.1 Analysis of microarray raw data
2.2 GEO2R筛选均一化处理后的数据 其中差异上调表达的基因96个,差异下调表达的基因184个,对全部基因进行可视化后的火山图见图2A。将差异表达的基因进行聚类分析,结果显示差异基因数据源间具有相似性(图2B)。
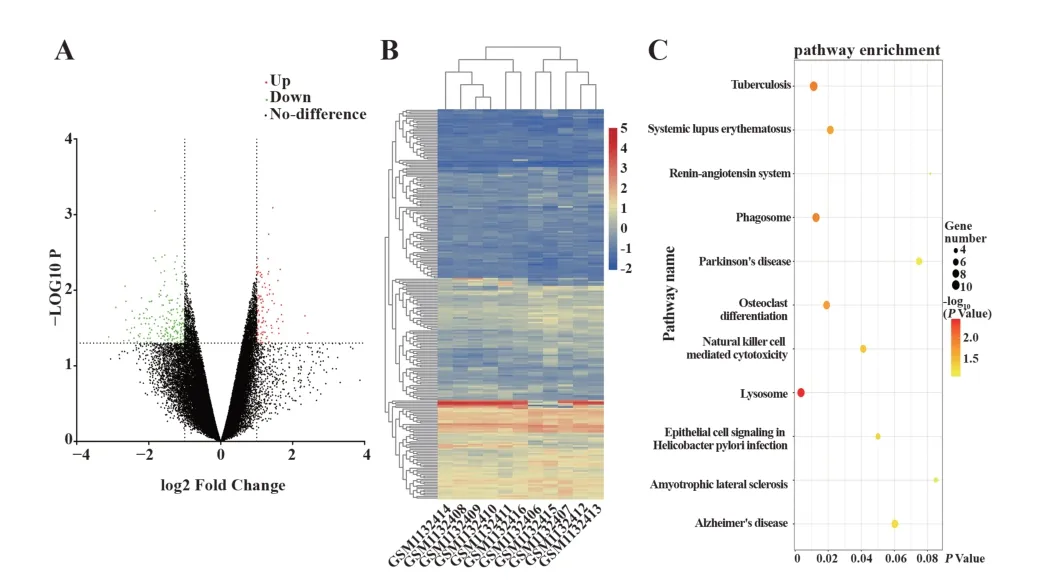
图2 差异基因聚类分析Fig.2 Cluster analysis of differential genes
2.3 差异表达基因信号通路分析 为了方便差异基因的生物信息学分析,使用DAVID在线数据库将全部差异基因成功转换为基因符号。将280个差异表达的基因符号进行KEGG信号通路聚类分析,发现hsa04142:溶酶体为富集程度最高的信号通路(图2C、表1)。
表1 KEGG信号通路聚类分析(±s,n=280)Tab.1 Clustering analysis of KEGG signaling pathway(±s,n=280)
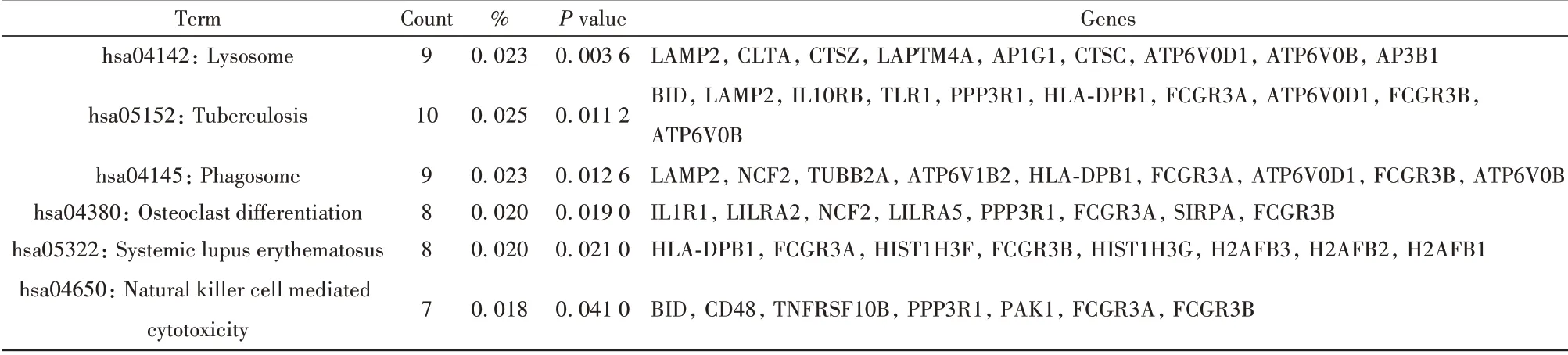
表1 KEGG信号通路聚类分析(±s,n=280)Tab.1 Clustering analysis of KEGG signaling pathway(±s,n=280)
Term hsa04142:Lysosome hsa05152:Tuberculosis hsa04145:Phagosome hsa04380:Osteoclast differentiation hsa05322:Systemic lupus erythematosus hsa04650:Natural killer cell mediated cytotoxicity Count 9109887%0.0230.0250.0230.0200.0200.018P value 0.00360.01120.01260.01900.02100.0410 Genes LAMP2,CLTA,CTSZ,LAPTM4A,AP1G1,CTSC,ATP6V0D1,ATP6V0B,AP3B1 BID,LAMP2,IL10RB,TLR1,PPP3R1,HLA-DPB1,FCGR3A,ATP6V0D1,FCGR3B,ATP6V0B LAMP2,NCF2,TUBB2A,ATP6V1B2,HLA-DPB1,FCGR3A,ATP6V0D1,FCGR3B,ATP6V0B IL1R1,LILRA2,NCF2,LILRA5,PPP3R1,FCGR3A,SIRPA,FCGR3B HLA-DPB1,FCGR3A,HIST1H3F,FCGR3B,HIST1H3G,H2AFB3,H2AFB2,H2AFB1 BID,CD48,TNFRSF10B,PPP3R1,PAK1,FCGR3A,FCGR3B
2.4 核心发病基因预测 将280个差异表达的基因输入STRING在线软件进行PPI互作网络分析,结果显示共有262个基因之间具有相互联系,联系线为344条,平 均 评 分 为2.63,PPI富 集P值 为9.84e−05。将PPI互作关系信息应用Cytoscape进行可视化处理。进一步计算全部PPI信息数据后,cy‐tohubba显示排名前10为的发病基因为HCK(14分)、STAT5A(11分)、CAT(11分)、CXCR1(10分)、ARRB2(10分)、CD300A(10分)、MCM2(9分)、OPRL1(9分)、TLR1(9分)、PINK1(8分),见图3A。对10个发病基因进行聚类分析后显示差异基因数据源间具有相似性(图3B)。综上分析,HCK为PCI术后ISR发病核心基因。

图3 核心发病基因预测Fig.3 Prediction of hub genes
3 讨论
PCI已经成为治疗缺血性心脏病的一种主要手段[2]。临床实践证明药物洗脱支架(DES)能够明显减少裸金属支架的ISR发生率[5],因此DES被迅速和广泛地应用于PCI治疗。然而DES晚期ISR仍然是一个严重的问题,其发生率约为3%~20%[6]。ISR的发生与支架类型、位置、患者合并症及病变复杂性(即病变长度、血管大小和分叉病变)等均相关[7]。其主要由侵袭性内膜增生和新动脉粥样硬化形成引起[3]。有研究针对内膜增生进行干预,但结果不令人满意。因此对于ISR形成的分子机制及相关信号通路仍需进一步探索。
二代测序的迅猛发展使得基因测序变得廉价、便捷,但二代测序过程中也会产生许多离散度较大的数据,如何能够识别无用的数据,迅速锁定核心发病基因是目前测序后研究的重点[8-9]。而生物信息学通过计算机软件分析及计算可以实现大数据矫正及核心发病基因、核心发病通路的锁定。本研究通过对ISR患者及PCI术后支架内未狭窄的患者进行基因测序发现,原始数据离散度较大。分析原因可能与入组患者年龄偏大,机体各脏器衰老有关,因此会出现许多与冠心病及ISR不相关的基因数据。此种情况一方面可以从基因校准前看出,另一方面,即使进行了基因数据均一化处理,聚类出溶酶体相关信号通路可能是ISR发病过程中的关键信号通路,但仍然会出现一些与冠心病无明显关联的基因及信号通路的富集。因此在应用R语言对数据进行矫正后,进一步对全部差异表达的基因进行PPI网络分析,再次剔除18个可能和ISR无关的差异表达的基因。应用cytohubba从基因间的拓扑结构、基因点间的互作关系、关系的密切联系等多维度进行计算后,最终锁定HCK为ISR的核心发病基因。
HCK在调节先天免疫反应、吞噬、细胞存活和增殖、细胞黏附和迁移方面发挥重要作用[10]。此外HCK也被描述为巨噬细胞吞噬功能的关键调节因子[11]。虽然目前ISR具体的发病机制不明,但是HCK参与的免疫、吞噬、炎症及细胞增殖和迁移似乎都能造成新生内膜的形成。其中HCK已被证明是中性粒细胞趋化因子信号的负调节因子,其低表达可促进局部炎症反应的形成,进而激活内皮细胞增殖信号,很有可能导致支架内局部炎症反应的过度激活,进而导致内皮增殖引起ISR[12]。而HCK的形成过程似乎也和溶酶体密切相关,从而参与细胞吞噬过程。在巨噬细胞吞噬体的成熟过程中,位于囊泡结构上的HCK在晚期内质体蛋白Lamp-1的作用下被募集到吞噬体膜上,通过对包含HCK的囊泡进行膜蛋白的检测发现其阳性表达CD63而阴性表达M6PR,提示HCK存在于溶酶体囊泡中,并介导溶酶体的吞噬作用[13]。而溶酶体相关通路是本文通过KEGG筛选出的对差异表达基因富集最为明显的信号通路,其在冠状动脉粥样斑块的形成过程中起关键作用。既往研究指出冠心病和溶酶体酸脂酶活力低下有关,此酶是将胆固醇酯和甘油三酯水解成游离胆固醇、甘油和游离脂肪酸的关键溶酶体酶,可防止脂质在各种组织和细胞中积聚[14]。而酶体酶又可通过降解IL-1、IL-8、TNF-α来调控炎症以及免疫反应[15]。
综上,本文通过对ISR患者基因测序及生物信息学分析,锁定HCK为PCI术后ISR发生的关键基因,而溶酶体介导的相关通路为ISR发病过程中关键的信号通路改变。这是首次通过生物信息学分析的方法推测出来的ISR核心发病基因和关键信号通路,针对HCK及溶酶体通路的干预可能成为未来ISR的基因靶向治疗及血清学诊断标志物。

