BMSCs通过归巢调节哮喘大鼠Th1/ Th2细胞“漂移”①
王 坤 朱慧志 杨 磊 徐晴雯 任冯春 (安徽中医药大学研究生院,合肥230031)
哮喘是Th2 淋巴细胞驱动的气道异质性疾病,其特征是慢性气道炎症、气道高反应性、黏液过度分泌和气道壁重塑[1]。哮喘的气道炎症以Th2 型CD4+T 细胞占主导[2]。发作时控制Th2 细胞分化的转录因子GATA 结合蛋白3(GATA-3)表达迅速上调,使得Th2 相关细胞因子如白介素(IL)-4,IL-5 和IL-13 等生成增多。与此同时,Th1 细胞分化功能下降,诸如IFN-γ、IL-2等Th1细胞因子生成不足,抑制IL-4、IL-10 等Th2 细胞因子基因表达的作用削弱。Th1/Th2细胞因子的比例失衡促进嗜酸性粒细胞活化、黏液分泌增强和IgE 升高,诱发支气管收缩,气流阻塞。由此可见,Th1/Th2 细胞间的失衡(即Th1/Th2“漂移”)是哮喘发病的重要机制,也为哮喘的治疗提供了基础框架[3-4]。哮喘治疗的研究主要集中于减少严重哮喘发作和提高生活质量。间充质干细胞(bone mesenchymal stem cells,BMSCs)可改善包括哮喘在内的各种慢性炎症疾病免疫紊乱状态。研究表明[5-6],BMSCs 具有调节宿主免疫和抑制慢性炎症的作用。尤其是在不同类型的组织损伤和过敏性炎症中,BMSCs 具有保护肺免受各种损伤的能力。哮喘发作时,“休眠”的BMSCs 被“唤醒”,“归巢”到损伤部位,调节Th1/Th2“漂移”,即抑制Th2 过度分泌而减少Th2 细胞因子表达,从而调节免疫微环境、改善气道炎症[7-9]。BMSCs 发挥作用的关键在于其归巢能力及归巢时间。本研究通过CFSE 荧光染色示踪技术观察移植后哮喘大鼠BM‐SCs 向肺组织的归巢情况,借以研究其免疫调节作用,为BMSCs移植治疗哮喘铺垫。
1 材料与方法
1.1 材料
1.1.1 实验动物 清洁级雄性SD 大鼠18 只(体重180~200 g),随机分为3 组,每组6 只:空白组,哮喘模型组(哮喘组),间充质干细胞移植组(归巢组)。以上大鼠均购自安徽医科大学实验动物管理中心。
1.1.2 主要试剂及仪器 卵蛋白(ovalbumin egg,OVA)购自美国Sigma 公司;氢氧化铝凝胶购自美国Sigma 公司;DMEM/L 培养基购自美国Hyclone公司;胎牛血清购自美国Gibco 公司;胰酶消化液、青-链霉素溶液购自碧云天生物技术有限公司;CD29-FITC、CD45-FITC、CD44-PE、CD11b/c-PE 单克隆抗体购自美国eBioscience 公司。IFN-γ、IL-13购自美国R&D Systems 公司。BX51 光学显微镜购自日本OLYMPUS;超声雾化器购自江苏鱼跃医疗设备股份有限公司;流式细胞仪购自美国贝克曼公司。
1.2 方法
1.2.1 BMSCs 分离培养、扩增及鉴定 大鼠经麻醉处死后以培养基冲出其股骨骨髓并重悬,接种于培养瓶中培养。待细胞融合达80%~90% 时,传代;取第3 至5 代细胞用于实验。BMSCs 表面标志物检测:取第4 代BMSCs 调整细胞浓度至1×106个/ml,分别加入荧光标记的抗体(CD29、CD44、CD45、CD11b/c)混匀,4℃避光孵育30 min,PBS 漂洗2 遍以去除未结合的抗体,后用流式细胞仪检测,同型IgG作为相应的阴性对照。
1.2.2 哮喘模型的制备、细胞移植 哮喘模型制备[10]:模型组及BMSCs移植组大鼠于第0天和第7天腹腔内注射致敏液(内含OVA 1 mg和氢氧化铝凝胶100 mg),于第14天将致敏大鼠放置于自制的密闭有机玻璃容器内(长125 cm×宽85 cm×高80 cm),将含1%OVA 的生理盐水混悬液用超声雾化器以最大雾化量雾化吸入,每次雾化30 min,1 次/d,持续7 d。BMSCs 体内移植:在二甲基亚砜(DMSO)中制备了10 mm 的荧光染料羧基荧光素二醋酸盐琥珀酰亚胺(5- and 6-carboxyfluorescein diacetate succinimidyl es‐ter,CFSE)分子探针储备溶液,并在干燥剂下保存于−20℃。采集的细胞在1%PBS 中洗涤,37℃孵育30 min 后用PBS液悬浮,流式细胞术检测CFSE标志细胞(CFSE+cells)比例,同时1×106个/只CFSE+细胞经尾静脉输注法注射到BMSCs移植组大鼠中。
1.2.3 观察指标
1.2.3.1 归巢能力标志物CFSE 检测 流式细胞术检测CFSE 表达。 分别在BMSCs 移植后24 h、48 h、72 h、96 h、120 h、144 h的时间节点将肺组织细胞染色,用100 ml/L胎牛血清的DMEM/L培养基调整细胞密度,以1×105个/孔接种于6孔板内,之后取3 孔用流式细胞仪和荧光显微镜检测荧光强度,其余细胞继续培养直至所测荧光强度与未标记细胞接近。此样本需在FL1 检测通道进行分析,并用流式细胞仪测定激发波长为488 nm 时的荧光强度,利用对数放大器分析门内染色细胞所占的百分比和细胞的平均荧光强度。
1.2.3.2 肺组织病理形态学观察 光镜下观察肺组织苏木精-伊红染色病理变化。取大鼠右下肺组织,石蜡包埋,HE 染色,通过光学显微镜观察肺病理形态学改变,并完成支气管周围炎症细胞浸润程度评分[11]:0 分:几乎无炎症细胞;1 分:散在少许炎症细胞;2 分:较多分布不均的炎症细胞但未聚集成团;3 分:大量炎症细胞,分布较均匀但少见聚集成团;4 分:大量炎症细胞聚集成团。按炎症浸润程度分别记“0、1、2、3、4分”。
1.2.3.3 支气管肺泡灌洗液细胞计数、分类测定大鼠经腹腔注射6% 水合氯醛(0.06 ml/kg)麻醉后抽取肺泡灌洗液,后用瑞氏-吉姆萨染色法进行染色,置光学显微镜下进行细胞分类,包括白细胞计数(WBC)、嗜酸性细胞(eosinophil,E)、巨噬细胞分类(macrophages,Mφ)计数。
1.2.3.4 血清IFN-γ、IL-13检测 采用酶联免疫吸附法检测IFN-γ、IL-13 表达。将平底96 孔聚碳酸酯板在4℃下用碳酸盐包被缓冲液(0.1 mol/L Na2CO3、0.1 mol/L NaHCO3,pH9.6)中1∶1 稀 释的50 ml/孔细胞培养上清液包被过夜。通过在包被缓冲液中连续稀释纯化的抗大鼠IFN-γ、IL-13 抗体的重组人IFN-γ、IL-13 获得标准曲线。去除稀释的上清液或标准液并在室温下用添加有1%W/VBSA 的PBS封闭1 h后,将板与小鼠抗人IFN-γ、IL-13(PBS中2 mg/ml,50 ml/孔)在室温下放置1 h。然后,用含有0.025%V/V Tween-20 的磷酸盐缓冲盐水(PBS)(300 ml/孔)洗涤2次,并与抗小鼠HRP 标记的二抗(0.2 mg/ml 于PBS,50 ml/孔)在室温下放置1 h。加入TMB 比色底物,并在5 min 后使用酶标仪测量450 nm的光密度。
1.2.3.5 T-bet、GATA-3 蛋白检测 采用Western blot 检测T-bet、GATA-3 蛋白表达。具体步骤:使用裂解缓冲液(10 mol/ml Tris-HCl pH7.5,1%TritonX-100、20%甘油,1 mol/ml EDTA,50 mol/ml NaCl 和1 mol/ml PMSF)制备肺总蛋白。将90 µg 蛋白质上样到SDS-聚丙烯酰胺凝胶上,进行电泳,然后转移到硝酸纤维素膜上。然后将印迹的膜与在5%牛奶/TBST 中加入一抗(T-bet、GATA-3 稀释度1∶2000)4℃孵育24 h。在TBST 中洗涤3 次10 min 后,将膜与5%牛奶/PBST 中的辣根过氧化物酶偶联的二抗以1:4000稀释液孵育3 h。最后,将膜在PBST中洗涤3 次,每次10 min,然后使用增强的化学发光系统(ECL)观察显色后胶片曝光,分析表达量。
1.3 统计学方法 使用SPSS12.0 进行统计分析。结果表示为±s。用方差分析对数据进行分析,组间差异比较采用t检验。P<0.05表示有统计学意义。
2 结果
2.1 BMSCs 表面标志物鉴定 BMSCs 表面CD44和CD29 表达量分别为98.3%、表达量为98.4%,呈阳性。CD45和CD11b表达量分别为1.62%、1.14%,呈阴性。见图1。
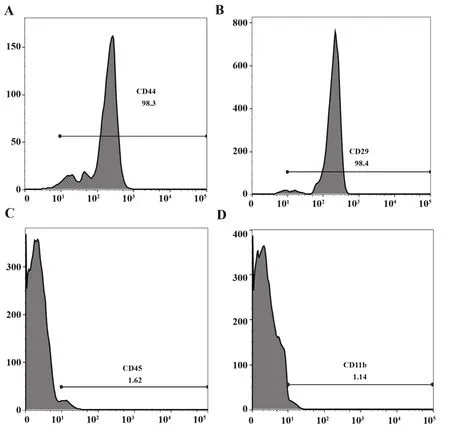
图1 BMSCs表面标志物鉴定Fig.1 Identification of BMSCs surface markers
2.2 哮喘大鼠BMSCs 归巢能力观察 通过BMSCs体内移植至哮喘大鼠,流式细胞术观察归巢能力标志物CFSE 发现,BMSCs 体内移植后CFSE 在肺组织表达逐渐升高,72 h时CFSE表达量达最高峰。后渐下降,至144 h达最低峰。见图2、表1。
表1 哮喘大鼠BMSC归巢能力动态观察(±s,n=3)Tab.1 Dynamic observation of homing ability of BMSCs in asthmatic rats(±s,n=3)
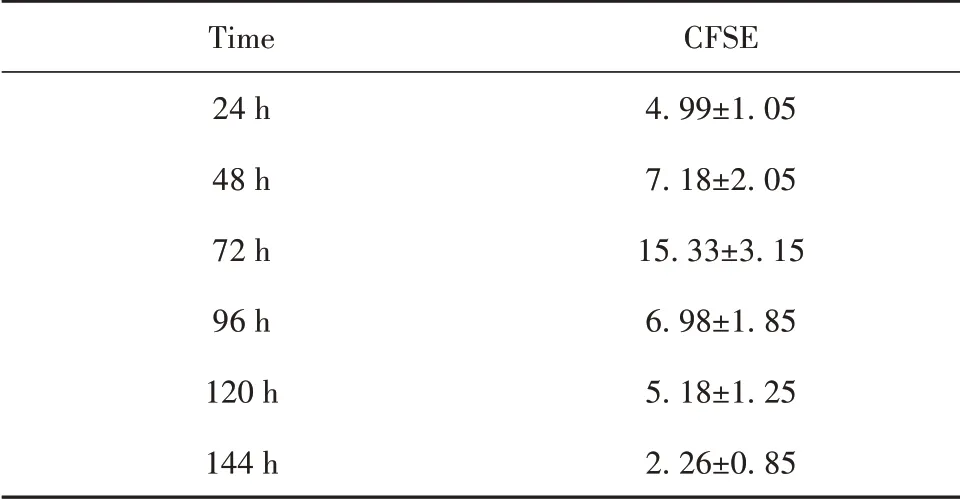
表1 哮喘大鼠BMSC归巢能力动态观察(±s,n=3)Tab.1 Dynamic observation of homing ability of BMSCs in asthmatic rats(±s,n=3)
Time 24 h 48 h 72 h 96 h 120 h 144 h CFSE 4.99±1.057.18±2.0515.33±3.156.98±1.855.18±1.252.26±0.85
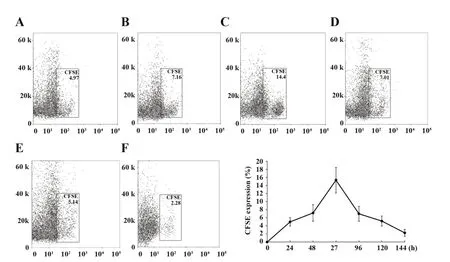
图2 哮喘大鼠CFSE表达Fig.2 CFSE expression in asthmatic rats
2.3 BMSCs 归巢对哮喘大鼠肺部炎症的影响 病理形态学观察发现,BMSCs 移植72 h 后肺组织病理形态学肺泡炎积分(4.45±1.38)较0 h(8.45±2.38)降低(P<0.01)。见图3。

图3 肺组织病理形态学变化Fig.3 Pathological and morphological changes of lung tissue
2.4 哮喘大鼠支气管肺泡灌洗液细胞分类及计数BMSCs移植0 h后,与空白组比较,哮喘组、归巢组WBC、E、Mφ表达升高(P<0.05或P<0.01)。经BMSCs移植72 h后,与哮喘组比较,归巢组WBC、E、Mφ表达降低(P<0.05或P<0.01)。在归巢组,与0 h相比,72 h的WBC、Mφ降低(P<0.05)。见图4、表2。
表2 支气管肺泡灌洗液细胞分类及计数比较(±s,n=6,n/ HP)Tab.2 Comparison of cell classification and count of bronchoalveolar lavage fluid(±s,n=6,n/ HP)
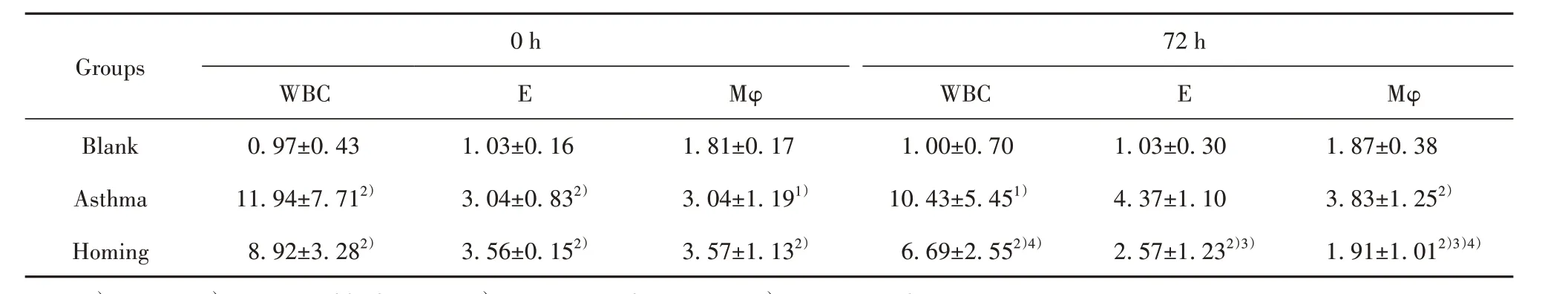
表2 支气管肺泡灌洗液细胞分类及计数比较(±s,n=6,n/ HP)Tab.2 Comparison of cell classification and count of bronchoalveolar lavage fluid(±s,n=6,n/ HP)
Note:1)P<0.05,2)P<0.01 vs blank group;3)P<0.05 vs asthma group;4)P<0.05 vs 0 h.
Groups Blank Asthma Homing 0 h WBC 0.97±0.4311.94±7.712)8.92±3.282)E 1.03±0.163.04±0.832)3.56±0.152)Mφ 1.81±0.173.04±1.191)3.57±1.132)72 h WBC 1.00±0.7010.43±5.451)6.69±2.552)4)E 1.03±0.304.37±1.102.57±1.232)3)Mφ 1.87±0.383.83±1.252)1.91±1.012)3)4)
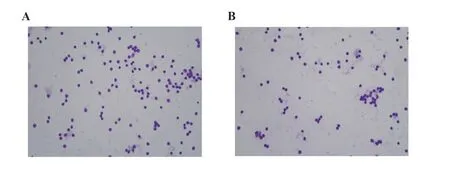
图4 瑞士-吉姆萨染色细胞分类计数(×400)Fig.4 Cell classification by Wright's staining(×400)
2.5 血 清IFN-γ、IL-13 及Th1/Th2(IFN-γ/IL-13)表达比较 与空白组比较,哮喘组、归巢组IFN-γ、Th1/Th2(IFN-γ/IL-13)表达降低,IL-13 表达升高(P<0.05 或P<0.01)。经BMSCs 移植72 h 后,与哮喘组比较,归巢组IFN-γ 表达升高,IL-13 表达降低(P<0.05或P<0.01)。且在归巢组,与0 h比较,72 h的IFN-γ表达、Th1/Th2升高(P<0.05)。见表3。
表3 血清IFN-γ、IL-13表达(±s,n=6,pg/ ml)Tab.3 Serum IFN-γ,IL-13 expression(±s,n=6,pg/ ml)
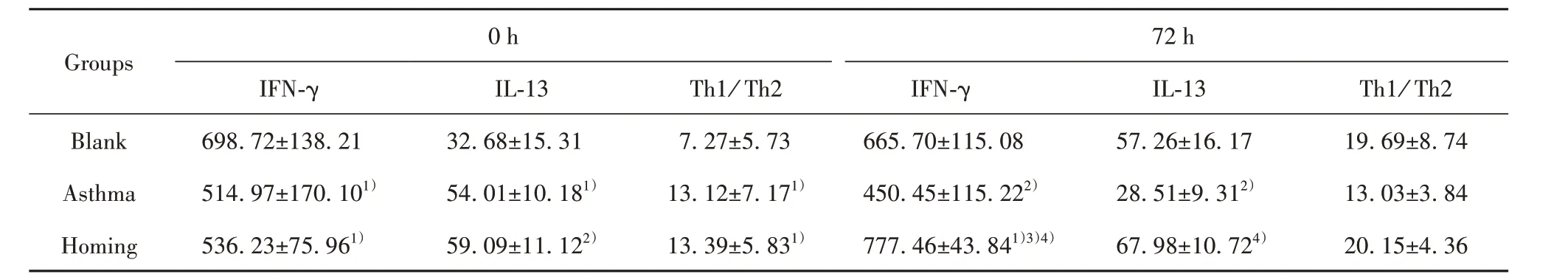
表3 血清IFN-γ、IL-13表达(±s,n=6,pg/ ml)Tab.3 Serum IFN-γ,IL-13 expression(±s,n=6,pg/ ml)
Note:1)P<0.05,2)P<0.01 vs blank group;3)P<0.01 vs asthma group;4)P<0.05 vs 0 h.
Groups Blank Asthma Homing 0 h IFN-γ 698.72±138.21514.97±170.101)536.23±75.961)IL-1332.68±15.3154.01±10.181)59.09±11.122)Th1/ Th27.27±5.7313.12±7.171)13.39±5.831)72 h IFN-γ 665.70±115.08450.45±115.222)777.46±43.841)3)4)IL-1357.26±16.1728.51±9.312)67.98±10.724)Th1/ Th219.69±8.7413.03±3.8420.15±4.36
2.6 肺组织T-bet、GATA-3 蛋白表达 BMSCs 移植0 h 时观察发现,与空白组比较,哮喘组、归巢组T-bet、T-bet/GATA-3 表达 降 低,GATA-3 表 达升高(P<0.05 或P<0.01)。经BMSCs 移植72 h 后,与哮喘组比较,归巢组T-bet、T-bet/GATA-3 表达升高,GATA-3 表达降低(P<0.01)。在归巢组,与0 h 比较,72 h 的T-bet/GATA-3 表达升高,GATA-3 表达降低(P<0.01)。见表4,图5。
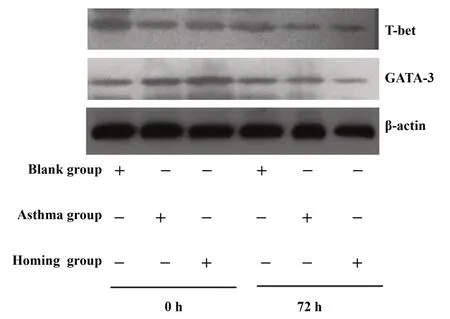
图5 肺组织T-bet、GATA-3蛋白表达Fig.5 T-bet and GATA-3 protein expression in lung tissue
表4 肺组织T-bet、GATA-3蛋白表达(±s,n=6)Tab.4 T-bet and GATA-3 protein expression in lung tissue(±s,n=6)
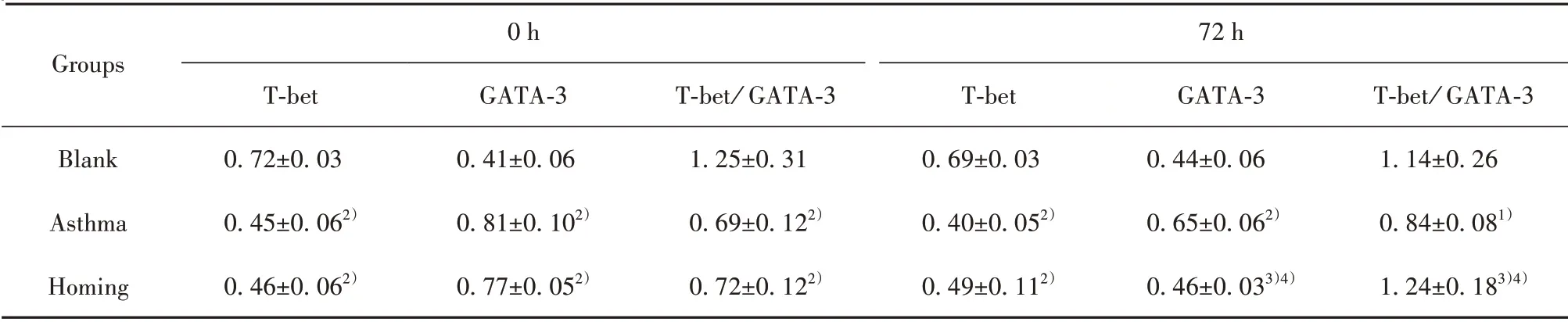
表4 肺组织T-bet、GATA-3蛋白表达(±s,n=6)Tab.4 T-bet and GATA-3 protein expression in lung tissue(±s,n=6)
Note:1)P<0.05,2)P<0.01 vs blank group;3)P<0.01 vs asthma group;4)P<0.01 vs 0 h.
Groups Blank Asthma Homing 0 h T-bet 0.72±0.030.45±0.062)0.46±0.062)GATA-30.41±0.060.81±0.102)0.77±0.052)T-bet/ GATA-31.25±0.310.69±0.122)0.72±0.122)72 h T-bet 0.69±0.030.40±0.052)0.49±0.112)GATA-30.44±0.060.65±0.062)0.46±0.033)4)T-bet/ GATA-31.14±0.260.84±0.081)1.24±0.183)4)
2.7 相关性分析 CFSE 与IFN-γ 呈正比,CFSE 与GATA-3 呈反比(P<0.05,P<0.01)。肺泡炎积分、Mφ与GATA-3呈正比(P<0.05,P<0.01)。见表5。
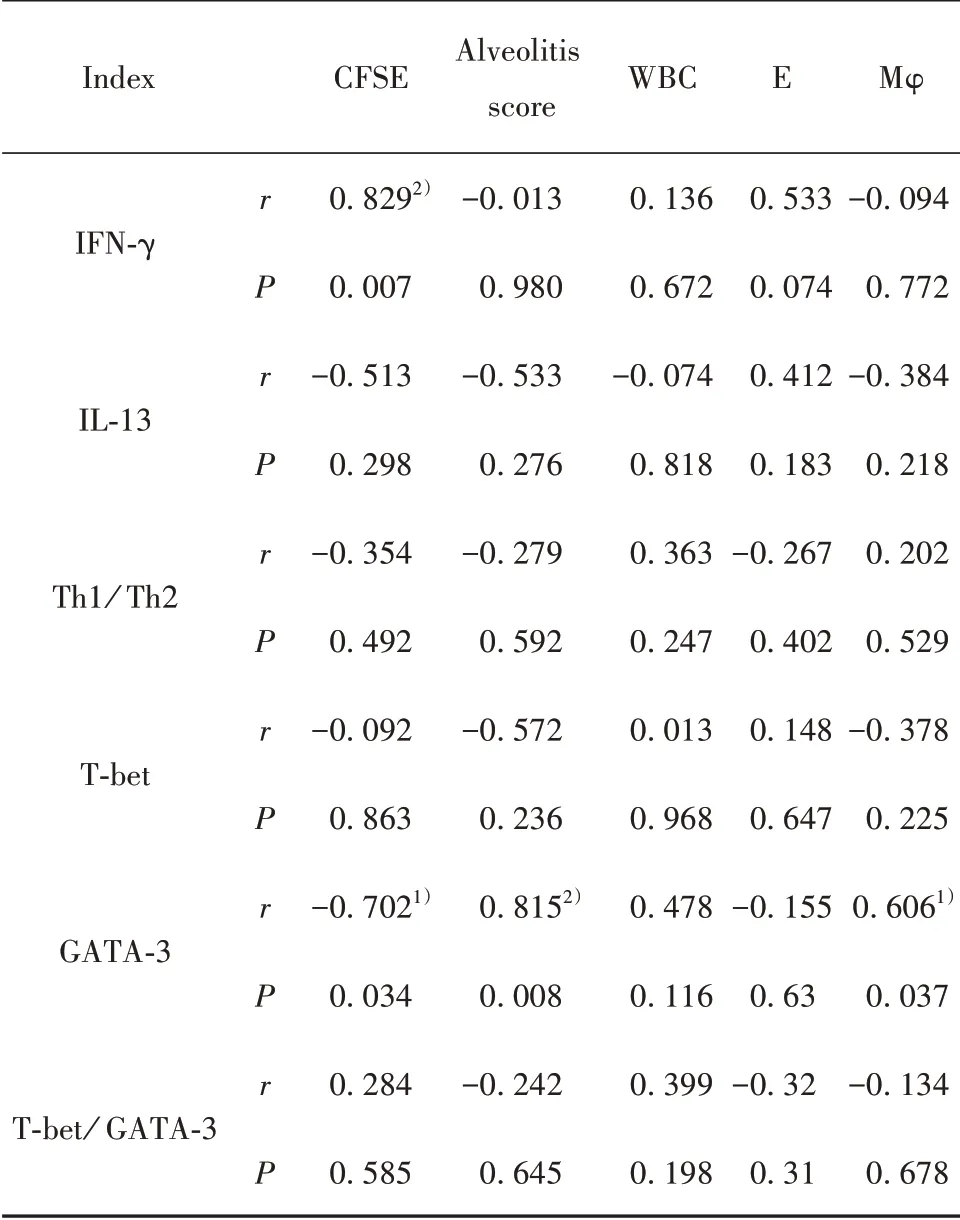
表5 哮喘各指标之间相关性分析Tab.5 Correlation analysis between asthma indicators
3 讨论
哮喘是由多种细胞及细胞组分参与的慢性炎症性气道疾病,是一种以气道炎症为特征的复杂免疫反应性疾病[12-13]。哮喘的主要特征是嗜酸性粒细胞增多、血清IgE 浓度升高、气道高反应性和气道黏液过多[14]。哮喘被认为是由Th2细胞因子(包括IL-14、IL-15和IL-13)诱导的免疫反应。免疫调节学说认为Th1/Th2 细胞功能及比例的失衡有利于Th2 极化,Th1/Th2细胞“漂移”是哮喘最主要的免疫异常[15-16]。
IFN-γ 是Th1 产生的主要细胞因子,在诱导Th1细胞产生方面起着关键作用,并参与抑制Th2 细胞反应和B 细胞IgE 合成,从而限制哮喘的进展。有研究发现,IFN-γ 能降低IL-13 诱导的杯状细胞增生和嗜酸性粒细胞增多,减少IL-13 信号传导[17]。通过降低TGF-β 和前胶原Ⅰ和Ⅲ的表达,IFN-γ 可减轻哮喘气道重塑和纤维化。IL-13 足以介导肺部Th2 炎症的所有基本特征[18-19]。IL-13 及其受体在哮喘患者的呼吸道中高表达。Th2 细胞、嗜酸性粒细胞、肥大细胞和嗜碱性粒细胞都产生IL-13。IL-13刺激人B 细胞合成IgE,是Th2 介导的疾病的关键效应因子。气道中IL-13 的产生促进嗜酸性粒细胞的存活和迁移,巨噬细胞的激活,B 细胞中IgG 同种型向IgE 的转换,气道上皮细胞的通透性和黏液分泌增加,气道上皮细胞产生诱导型一氧化氮合酶,气道成纤维细胞转化为肌成纤维细胞,胶原沉积。本次研究发现,与空白组比较,哮喘组IFN-γ、Th1/Th2表达降低,IL-13 表达升高,且WBC、E、Mφ 表达升高。提示IFN-γ 参与哮喘发生。说明Th2 极化可致哮喘的发生。表明哮喘发生与Th2源性的细胞因子密切相关。IFN-γ 的表达升高能提供有益的Th1 免疫调节信号。通过促进Th1细胞的机能而恢复Th1/Th2 平衡。而通过抑制Th2 反应的发生可能减轻哮喘气道炎症。
对不同类型病原体的免疫应答是通过将幼稚的CD4+T 细胞分化为Th1 和Th2 亚群实现,而2 个亚群的分化分别受特异性转录因子T-bet 和GATA-3调节。正常状况下,T-bet 和GATA-3 在细胞因子基因表达不同的细胞因子基因,从而动态调控Th1/Th2间的分化平衡。在哮喘发生过程中GATA-3 依赖的Th2 淋巴细胞活化[20-21]。GATA-3 可直接抑制IFN-γ的表达,促进IL-4、IL-5、IL-13 等多种Th2 细胞分化,由此Th2 型细胞效应增强,Th1 分化功能受抑制,Th1/Th2 向Th2“漂移”。IL-13 作为1 种关键的Th2细胞因子,受Th2 主要转录因子(GATA-3)调控激活产生,与哮喘气道炎症和重塑密切相关。本研究显示,与空白组比较,哮喘组T-bet、T-bet/GATA-3表达降低,GATA-3 表达升高。说明T-bet/GATA-3 可能参与哮喘发生。相关性分析发现,肺泡炎积分、Mφ与GATA-3 呈正比。上述发病机制又导致支气管高反应性并引起气流阻塞。在哮喘复杂的免疫反应中,IL-13无疑是治疗的相关靶点。
BMSCs 来源于骨髓,是具有多向分化潜能的成体干细胞,有高度可塑性和增殖能力,同时还具有特殊的低免疫原性和免疫调节功能。低免疫原性使外源性BMSCs 在宿主体内获得长期的生存能力,为BMSCs 移植的可行性提供了基础。其内在免疫调节潜能更为治疗哮喘提供了可能。BMSCs 能否发挥作用取决于BMSCs 的“归巢”能力。BMSCs“归巢”即当机体损伤时,“休眠”的BMSCs 被“唤醒”,有效地迁移到炎症损伤部位,发挥免疫调节及损伤修复作用。哮喘发作过程,BMSCs 通过“归巢”到达损伤肺组织,通过调节主转录基因和决定Th细胞亚群命运的相关细胞因子基因表达,调节Th1/Th2“漂移”,缓解破坏性炎症反应并发挥免疫调节功能。本研究显示,经BMSCs 移植72 h 后,与哮喘组比较,归巢组IFN-γ 表达升高,IL-13 表达降低。且归巢组T-bet、T-bet/GATA-3 表达升高,GATA-3 表达降低。而相关性分析显示,CFSE 与IFN-γ 呈正比,CFSE 与GATA-3 呈反比。说明BMSCs 可能是通过调节T-bet、GATA-3 的表达恢复Th1/Th2 平衡。BMSCs 对Th2 细胞具有优先抑制活性,其通过细胞-细胞接触机制介导对CD4+细胞免疫抑制,抑制Th2转录因子GATA-3 和细胞因子(如IL-10、IL-4)的表达,促进T-bet 和IFN-γ 的表达,使免疫反应偏向Th1。此外,BMSCs 可以调节释放炎症相关因子,通过刺激INF-γ 调节Th1/Th2 细胞因子平衡,并抑制IL-4、IL-5和IL-13的表达。
综上所述,BMSCs 通过调节T-bet/GATA-3 表达,促进Th1/Th2“漂移”向Th1 方向迁移,改善哮喘气道炎症。

